Le prolapsus de la valve mitrale (MVP) est un trouble valvulaire courant qui peut survenir à tout âge. Elle est la cause la plus fréquente de régurgitation mitrale dans les pays développés. Le MVP est associé à une morbidité importante chez les patients symptomatiques, alors que la forme non compliquée du MVP a une histoire naturelle bénigne. La régurgitation mitrale (RM) due au MVP peut être réparée avec un faible risque de récidive de la régurgitation mitrale et de réopération. Une chirurgie précoce est associée à de faibles risques chirurgicaux et à de meilleurs résultats.
Le prolapsus de la valve mitrale (MVP) est un trouble valvulaire courant qui peut survenir à tout âge. Elle est associée à un épaississement de la valve, une dilatation de l’anneau et une anomalie des cordes tendineuses [1]. Le prolapsus de la valve mitrale est reconnu comme une entité clinique depuis environ 60 ans, lorsque Barlow et Bosman utilisaient la cinéangiographie. Avant cette période, l’opinion générale était que les clics et les souffles systoliques sont causés par des adhérences péricardiques, et le stade avancé de la maladie avec régurgitation mitrale progressive était fréquemment diagnostiqué à tort avec une cardiopathie rhumatismale. Cependant, avec l’arrivée de l’échocardiographie bidimensionnelle (2D), l’histoire naturelle et la physiopathologie du MVP et de ses complications sont devenues manifestes. Le terme MVP a été inventé par Criley et al [2], et est maintenant reconnu comme la principale cause de régurgitation mitrale dans les pays développés. S’il n’est pas diagnostiqué et pris en charge de manière appropriée, le MVP peut être une cause de mortalité prématurée et de morbidité considérable.
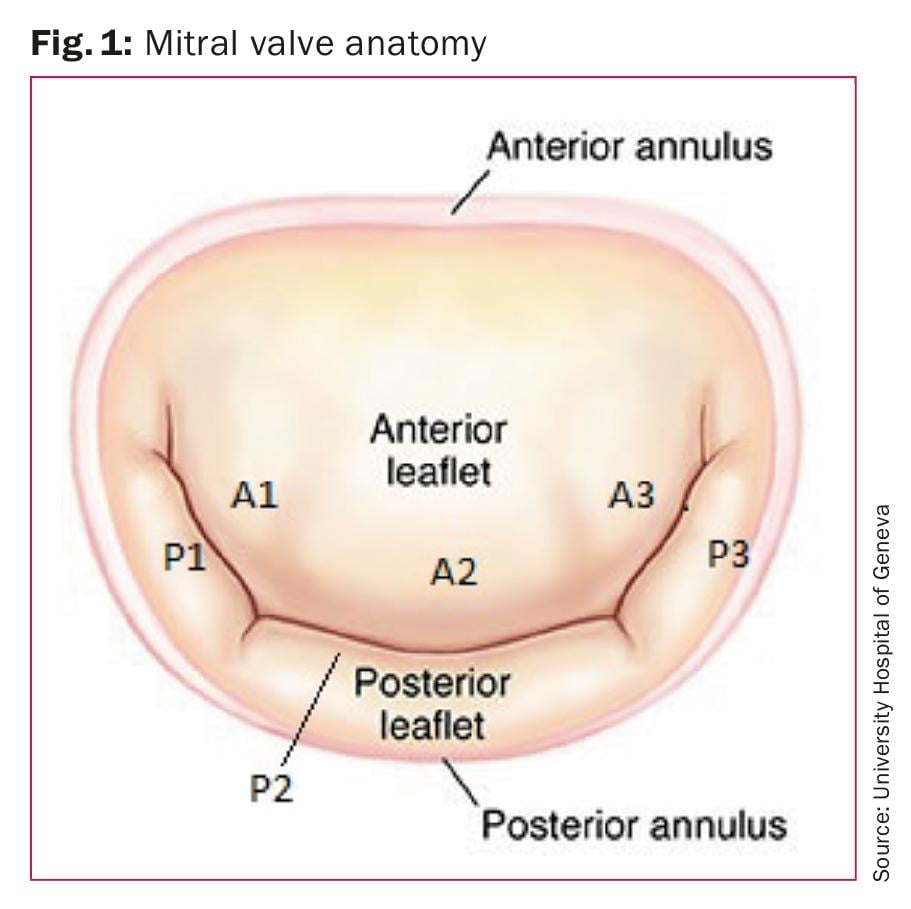
Anatomie de la valve mitrale
Une connaissance de base de l’anatomie de la valve mitrale normale (Fig. 1) est importante pour comprendre la présentation variable et le mécanisme du prolapsus de la valve mitrale. La valve mitrale est constituée de feuillets antérieurs et postérieurs fixés à leur base à un anneau fibreux ou fibromusculaire, l’anneau mitral. Les folioles sont attachées aux deux muscles papillaires (antérolatéral et postéromédial) par des chordae tendineae. L’une des fonctions des chordae tendineae est d’empêcher l’éversion ou le prolapsus des feuillets en systole. Le feuillet antérieur est généralement plus grand que le postérieur, sa base est plus étroite et il est triangulaire. Le feuillet postérieur est plus court, et segmenté en trois coquilles ou segments : latéral, moyen et médian. Bien que la coquille Saint-Jacques du milieu soit la plus grande, il existe une variabilité considérable. Les feuillets antérieur et postérieur se rejoignent au niveau de deux commissures : postéromédiale et antérolatérale.
Classification de Carpentier : Alain Carpentier [3] a proposé une classification chirurgicale de l’anatomie de la valve mitrale. Dans cette classification, les trois festons des folioles postérieures sont appelés P1 (antérolatéral), P2 (médian) et P3 (postéromédian). Les segments correspondants du feuillet antérieur sont étiquetés A1, A2 et A3 (Fig. 1).
Prolapsus de la valve mitrale – Définition, classification
Le prolapsus de la valvule mitrale (MVP) est un trouble valvulaire commun défini par le gonflement systolique d’un ou des deux feuillets mitraux dans l’oreillette gauche, avec ou sans régurgitation mitrale. C’est la cause la plus fréquente de régurgitation mitrale dans les pays développés et la cause primaire la plus courante de dysfonctionnement nécessitant une réparation ou un remplacement de la valve mitrale [4,5].
Le MVP est classé comme un trouble héréditaire du tissu conjonctif qui est considéré comme un trouble autosomique dominant à pénétrance variable. Il est divisé en MVP primaire et secondaire [6]. Le MVP primaire est généralement associé à une dégénérescence myxomateuse de la valve mitrale (MV). Le MVP secondaire est causé par une rupture des tendons chordae et/ou un mouvement anormal de la paroi du ventricule gauche (VG). Les causes potentielles de la MVP secondaire comprennent les maladies coronariennes, les cardiopathies rhumatismales, les cardiomyopathies et les endocardites infectieuses. Le MVP peut également être associé à certains troubles héréditaires, tels que le syndrome de Marfan, le syndrome d’Ehlers-Danlos ou le syndrome de Loeys-Dietz.
Boudoulas et al. [7] ont proposé une “classification clinique” du MVP et ont divisé le MVP en deux groupes : le MVP anatomique et le MVP syndromique.
Pathologie et physiopathologie
La MVP se caractérise par un élargissement progressif de l’anneau de la valve mitrale et un épaississement des folioles et des cordons, entraînant un prolapsus des folioles vers le haut, dans l’oreillette gauche, au-delà de l’anneau mitral en systole, ce qui entraîne une RM. Histologiquement, les folioles de la valve mitrale dans la MVP présentent une dégénérescence myxomateuse avec dégradation du collagène et production de fibrilles de collagène anormales.
On sait que des gènes particuliers jouent un rôle important dans la formation des valves cardiaques : calcineurine, Wnt/beta-caténine, facteur de croissance des fibroblastes (FGF)-4, Sox4 et TGF-β. Des défauts dans un ou plusieurs de ces gènes et leurs cascades de signalisation peuvent provoquer des modifications myxomateuses et un affaiblissement des valves. Il est rapporté que la régulation ascendante du TGF-β joue un rôle important dans la pathogenèse du MVP anatomique ou non-syndromique et du MVP syndromique [8].
Histoire naturelle et épidémiologie
Le MVP est la principale cause de régurgitation mitrale dans les pays développés, avec une prévalence d’environ 2,4 % de la population. Le MVP a été détecté dans de nombreux groupes de population de différentes origines ethniques et raciales. Marks et al. [9] ont signalé que les patients présentant des valves épaissies et redondantes avaient un risque accru d’endocardite infectieuse, de RM et de remplacement de la MV.
L’âge d’apparition du MVP est variable. Les manifestations cliniques se produisent rarement avant l’âge adulte, et l’intervention chirurgicale pour une RM grave a lieu le plus souvent au cours de la sixième ou septième décennie. Le délai moyen entre la détection d’un souffle et la présentation des symptômes est d’environ 20-25 ans [6,10].
La présence d’une RM conduit à une RM de plus en plus grave, car le niveau initial de RM entraîne une dilatation du ventricule gauche, ce qui augmente le stress sur l’appareil mitral. Ce stress cause d’autres dommages à l’appareil valvulaire, ce qui entraîne une RM plus sévère et une nouvelle dilatation du ventricule gauche, provoquant ainsi un cycle perpétuel d’augmentation constante des volumes du ventricule gauche et de la RM. Cette surcharge volumique entraîne un dysfonctionnement irréversible du VG et un mauvais pronostic.
Symptômes
La plupart des patients chez qui l’on vient de diagnostiquer un MVP sont asymptomatiques, et le diagnostic est souvent basé sur l’auscultation cardiaque ou en raison d’une découverte échocardiographique inattendue. Les symptômes courants des patients atteints de MVP sont l’essoufflement, les palpitations, la gêne thoracique et les symptômes d’insuffisance cardiaque lorsque la RM est déjà importante. Certains patients peuvent présenter une apparition soudaine de ces symptômes qui peuvent résulter d’une rupture aiguë de la corde ou d’une perforation du feuillet de la valve ou d’une rupture de la valve dans le cas d’une endocardite.
Diagnostic échocardiographique
L’échocardiographie 2D est une technique de diagnostic standard pour le diagnostic précis du MVP et pour déterminer la présence d’une RM et d’autres constatations qui affectent le pronostic et le risque de complications. L’échocardiographie transoesophagienne (ETO) et l’échocardiographie tridimensionnelle (3D) peuvent donner des informations supplémentaires sur l’évaluation de l’appareil de la valve mitrale. L’échocardiographie de stress peut aider à différencier la RM modérée de la RM sévère en générant des informations diagnostiques et pronostiques supplémentaires chez des patients sélectionnés.
En échocardiographie 2D, la MVP est diagnostiquée lorsqu’un ou les deux feuillets sont déplacés de 2 mm ou plus en systole au-dessus d’une ligne reliant les points d’articulation annulaires en vue parasternale ou apicale grand axe [5,11].
Complications du MVP
Le MVP est associé à une morbidité importante chez les patients symptomatiques, alors que la forme non compliquée du MVP a une histoire naturelle bénigne. Les complications les plus courantes du MVP sont l’endocardite, la mort cardiaque subite, les arythmies, les événements cérébrovasculaires et la RM grave avec indication chirurgicale.
Le risque d’endocardite infectieuse est cinq fois plus élevé chez les patients atteints de MVP que dans la population générale [12], mais le risque absolu est faible, soit environ 0,2 % par an. Les facteurs de risque de développement d’une endocardite infectieuse chez les patients atteints de MVP sont le sexe masculin, l’âge de plus de 45 ans, la présence d’un souffle systolique, l’épaisseur valvulaire.
Des arythmies cardiaques sont fréquemment détectées chez les patients atteints de MVP. La fibrillation auriculaire est l’une des complications les plus courantes du MVP. La tachycardie supraventriculaire paroxystique est la tachyarythmie la plus courante. La plupart des arythmies identifiées chez les patients atteints de MVP sont bénignes. Cependant, certains cas d’arythmies ventriculaires et de mort subite cardiaque (MSC) ont été signalés. Les arythmies ventriculaires et le SCD sont la complication la plus grave du MVP. Le taux estimé de MCS chez les MVP varie de 0,2 %/an à 0,4 %/an dans différentes études prospectives [13,14]. Corrado et al. [15] ont étudié 200 cas consécutifs de mort subite (âge ≥35 ans) et ont constaté que la plupart des patients atteints de MVP (10% du total) étaient des femmes asymptomatiques sans régurgitation significative de la valve mitrale. Basso et al. [14] ont examiné le registre de 650 jeunes adultes (âge ≤40 ans) atteints de MCS et ont constaté que le MVP est une cause importante de MCS arythmique, principalement chez les jeunes femmes adultes (7% de tous les MCS, 13% des femmes).
Le MVP est la cause la plus fréquente de régurgitation mitrale, avec le développement d’une RM dans environ 10 % des cas de MVP isolés [6,7], résultant de la dégénérescence progressive des feuillets myxomateux, de la redondance des cordes tendineuses et de l’élargissement de l’anneau mitral. Cependant, la contribution générale de ces facteurs n’est pas claire. Tous les patients atteints de MVP ne progressent pas vers une RM sévère, la progression est souvent lente sur une moyenne de 25 ans [10]. La RM grave peut avoir un début aigu en raison d’une rupture de la chorde tendineuse ou d’une endocardite infectieuse. Les hommes de plus de 45 ans atteints de MVP ont un risque deux à trois fois plus élevé de développer une MR grave qui nécessite finalement une intervention chirurgicale. Une fois que la RM grave est établie, la surcharge volumique entraîne une hypertrophie progressive des chambres de l’oreillette gauche et du ventricule gauche, ce qui entraîne une fibrillation auriculaire, une hypertension pulmonaire et une insuffisance cardiaque congestive [6,7].
Gestion du prolapsus de la valve mitrale
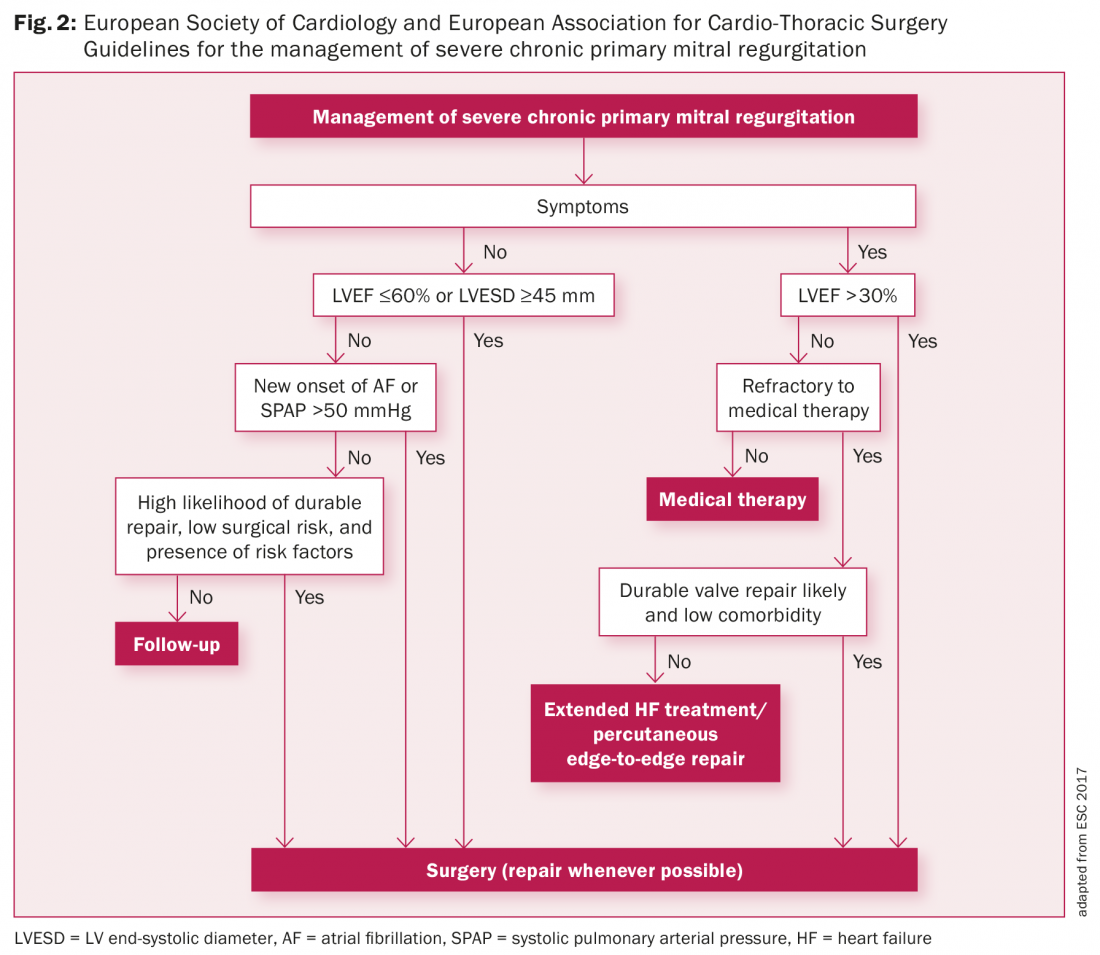
Les patients asymptomatiques atteints de MVP ou ceux qui ne présentent que des symptômes légers, pas d’arythmies, un ECG normal et aucun signe de RM ont un excellent pronostic et une histoire naturelle généralement bénigne. Les patients asymptomatiques présentant une RM modérée et une fonction ventriculaire gauche préservée doivent faire l’objet d’un suivi annuel avec un contrôle échocardiographique tous les 1 à 2 ans. Les patients asymptomatiques présentant une RM sévère et une bonne fonction ventriculaire gauche (FEVG >60 %) doivent bénéficier d’un suivi clinique et échocardiographique tous les six mois. S’ils atteignent les indications des lignes directrices pour la chirurgie MV (Fig. 2), une chirurgie précoce est associée à de faibles risques chirurgicaux et à de meilleurs résultats [16–18].
En cas de MVP symptomatique, un traitement médical avec des inhibiteurs de l’ECA, des bêta-bloquants et de la spironolactone (ou de l’éplérénone) est envisagé chez les patients présentant des symptômes d’insuffisance cardiaque qui ne sont pas aptes à subir une intervention chirurgicale ou lorsque ces symptômes persistent après l’intervention. Les patients souffrant d’arythmies ventriculaires ou de palpitations associées à des vertiges et/ou à une syncope doivent faire l’objet d’un examen attentif des antécédents familiaux en vue de détecter une MCS. Il est recommandé pour ces patients d’effectuer une surveillance ambulatoire de 24 heures (Holter) et une épreuve d’effort pour détecter d’éventuelles arythmies. Il est recommandé aux patients souffrant de fibrillation auriculaire chronique ou paroxystique, qu’une embolie artérielle soit survenue ou non, de suivre un traitement anticoagulant (par ex. Sintrom, Warfarin) s’il n’est pas contre-indiqué.
Intervention chirurgicale
Dans la figure 2, nous présentons les dernières directives de la Société européenne de cardiologie et de l’Association européenne de chirurgie cardio-thoracique pour la gestion de la régurgitation mitrale primaire sévère. Les patients symptomatiques présentant une régurgitation mitrale (RM) sévère doivent être envisagés pour une chirurgie de la RM [16]. Il a été signalé que la survie à long terme après une reconstruction de la valve mitrale est moins favorable chez les patients de classe III ou IV de la New York Heart Association (NYHA) que chez les patients de classe I ou II de la NYHA [17,18]. Une chirurgie précoce est associée à de meilleurs résultats. Les indications chirurgicales pour les patients atteints de RM sévère sont une FEVG ≤60 % ou un diamètre end-systolique du ventricule gauche (DAVG) ≥45 mm, une fibrillation auriculaire d’apparition récente et une pression pulmonaire systolique ≥50 mmHg [16].
Il n’existe pas de comparaison randomisée entre les résultats du remplacement et de la réparation de la valve, mais il est largement admis que, lorsque cela est possible, la réparation de la valve est l’approche privilégiée. La régurgitation mitrale due au prolapsus de la valve mitrale peut être réparée avec un faible risque de récidive de la régurgitation mitrale et de réopération. L’échocardiographie transoesophagienne préopératoire joue un rôle important dans le diagnostic de la gravité de la RM et peut donner des informations supplémentaires sur l’évaluation de l’appareil valvulaire mitral. L’échocardiographie transœsophagienne peropératoire doit être utilisée pour évaluer le résultat de la réparation de la MV.
Technique chirurgicale – réparation de la valve
Il est largement admis que la majorité des patients présentant un prolapsus de la valve mitrale et une régurgitation sévère peuvent subir une réparation réussie en utilisant différentes techniques. Une analyse correcte de tous les segments de la MV et de l’appareil sous-valvulaire est importante pour la reconstruction de la MV. L’objectif de la reconstruction valvulaire est d’obtenir une fonction valvulaire normale durable. La réparation de la valve mitrale repose sur trois principes de base [19]: mouvement normal des folioles, grande surface de coaptation des folioles et remodelage de l’orifice de la valve mitrale ainsi que stabilisation de l’anneau mitral. L’objectif de la plastie de MV pour MVP est de corriger le prolapsus et de transformer le feuillet postérieur en un contrefort lisse, régulier et vertical, parallèle à la paroi postérieure du ventricule gauche. De nombreuses techniques chirurgicales ont été développées pour corriger le MVP. En raison de la grande variabilité des dysfonctionnements et des lésions, ainsi que de la qualité du tissu foliaire, il est difficile de recommander des techniques standardisées pour la réparation. Le choix de la technique dépend de nombreux facteurs, tels que l’étendue du prolapsus, le degré de prolapsus et les lésions à l’origine du prolapsus. Le principe “une lésion, une technique” proposé par Carpentier [3,20] facilite le choix entre les différentes techniques chirurgicales. Dans toutes les techniques de réparation de la valve mitrale qui impliquent l’appareil sous-valvulaire, un remodelage de la valve mitrale avec une annuloplastie est nécessaire pour réduire la tension sur les sutures [19].
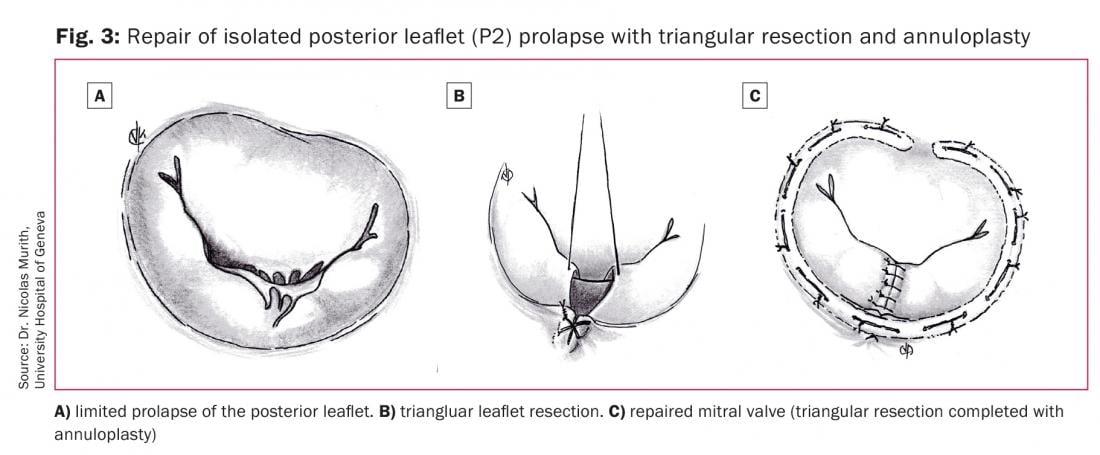
Un prolapsus limité du feuillet antérieur ou postérieur (Fig. 3A) peut être traité par une résection triangulaire du feuillet. La zone prolabée est identifiée, deux crochets ou sutures sont passés autour de la chorde non allongée aux limites de la zone prolabée et après une traction douce, le triangle de tissu créé est identifié. Une suture 5-0 est placée sur le dessus du triangle et le tissu est ensuite réséqué (Fig. 3B). Les deux bords nouvellement créés du feuillet sont ensuite suturés par des sutures en polyester 4-0 ou 5-0 en utilisant des sutures éversées ou inversées (Fig. 3C). Pour le prolapsus du feuillet antérieur, la zone de résection ne doit pas concerner plus de 10 % de la surface du feuillet. [19].
S’il existe une chorde secondaire non allongée à moins de 5 mm du bord libre d’un segment prolabé du feuillet antérieur, une fixation du feuillet peut être effectuée avec deux sutures monofilament 5-0 passant à travers la chorde puis à travers le bord libre du feuillet.
Pour le prolapsus du feuillet postérieur, la résection triangulaire est indiquée lorsque la longueur du bord libre du segment prolabé ne dépasse pas un tiers de la longueur totale de ce segment. Si plus d’un tiers de la longueur est concerné par un prolapsus étendu du feuillet postérieur, une résection quadrangulaire et une plicature annulaire peuvent être effectuées. La zone de résection ne doit pas impliquer plus de 40 % de la surface du feuillet postérieur. En cas de prolapsus plus étendu, une technique composite de résection partielle du feuillet postérieur associée à une réparation de la chorde peut être utilisée.
La plicature du feuillet triangulaire ou la résection triangulaire peuvent être utilisées en cas de prolapsus limité impliquant ≤5 mm du bord commissural. En cas de prolapsus commissural étendu causé par une rupture de la chorde, une résection quadrangulaire peut être effectuée. Si la commissure postérieure est impliquée, la résection quadrangulaire est complétée par une plicature annulaire et le “point magique” de Carpentier, lorsque la zone prolabée est de 5-10 mm. Si le prolapsus est supérieur à 10 mm, la résection quadrangulaire est complétée par une plastie des feuillets coulissants [19]. Au niveau de la comissure antérieure, la résection quadrangulaire est généralement complétée par une plastie du feuillet coulissant.
Une régurgitation aiguë de la MV peut survenir après un infarctus du myocarde ou un traumatisme dû à une MVP provoquée par la rupture du muscle papillaire. En général, cette affection nécessite une opération chirurgicale d’urgence. Dans la plupart des cas, la réparation de la MV est difficile ou impossible, un remplacement de la valve est donc nécessaire. Cependant, dans certains cas, la réparation du MV peut être effectuée. La réimplantation du muscle papillaire, la réimplantation de la tête du muscle papillaire ou la technique de raccourcissement du muscle peuvent être utilisées en fonction du type de lésion.
En cas de prolapsus bi-feuillets étendu, une combinaison de ces techniques doit être utilisée pour obtenir un bon résultat.
Dans les situations de prolapsus étendu des deux feuillets, ou de présence de multiples jets régurgitants, lorsque la réparation anatomique est difficile ou impossible, une technique de réparation chirurgicale “bord à bord” peut être réalisée, qui consiste à suturer ensemble les parties en regard des feuillets antérieurs et postérieurs de la valve mitrale [21].
Occasionnellement, après que toutes les corrections majeures ont été accomplies, il peut rester un prolapsus commissural aux jonctions des feuillets. Ceci peut souvent être corrigé par des points latéraux de type Alfieri ou un “point magique” de Carpentier, ou par une comissuroplastie latérale. Le succès chirurgical et les résultats tardifs de la plastie de la valve mitrale sont déterminés par l’emploi de l’approche chirurgicale correcte pour une pathologie donnée. Dans tous les cas de réparation chirurgicale de la valve mitrale, l’anneau de la valve mitrale est stabilisé par une annuloplastie à l’aide d’un dispositif d’annuloplastie rigide ou semi-rigide fermé. Le fait de ne pas soutenir l’anneau mitral avec une annuloplastie augmente le taux de récidive de RM.
Remplacement de la valve mitrale
Le remplacement de la valve mitrale par une prothèse biologique ou mécanique peut être effectué lorsque la reconstruction n’est pas satisfaisante ou ne permet pas d’obtenir un succès durable de la réparation.
Conclusion
Le prolapsus de la valve mitrale peut se produire à tout âge et il est la principale cause de régurgitation mitrale dans les pays développés. La majorité des patients présentant un prolapsus de la valve mitrale et une régurgitation sévère peuvent subir une réparation réussie. La réparation de la valve mitrale pour le prolapsus de la valve mitrale est une procédure chirurgicale durable et à faible risque. Les résultats et la survie à long terme après une réparation de la valve mitrale sont meilleurs si les patients sont orientés tôt vers la chirurgie.
Take-Home-Messages
- Le MVP est la cause la plus fréquente de régurgitation mitrale dans les pays développés.
- L’échocardiographie 2D est une technique standard pour le diagnostic précis du MVP.
- La régurgitation mitrale (RM) due au MVP peut être réparée avec un faible risque de récidive de la régurgitation mitrale et de réintervention.
- Une chirurgie précoce est associée à de faibles risques chirurgicaux et à de meilleurs résultats.
- Lorsque cela est possible, la réparation de la valve est l’approche privilégiée.
Bibliographie :
- Otto MC, Bonow OR : Valvular Heart Disease.4e éd. Philadelphie : WB Saunders ; 2014.
- Criley SM, et al : Prolapsus de la valve mitrale : Résultats cliniques et ciné-angiographiques. Br Heart J 1966 ; 28 : 488-496.
- Carpentier A : Chirurgie valvulaire cardiaque – la “correction française”. J Thorac Cardiovasc Surg 1983 ; 86 : 323-37.
- Braunwald E : Prolongement de la valve mitrale. Dans : Braunwald’s heart disease : a textbook of cardiovascular medicine, Philadelphie : WB Saunders 1997 ; 5(2) : 1029-1035.
- Guy FC, et al : Le prolapsus de la valve mitrale comme cause de régurgitation mitrale hémodynamiquement importante. Can J Surg 1980 ; 23 : 166-170.
- Jacobs W, Chamoun A, Stouffer GA : Le prolapsus de la valve mitrale : A Review of the Literature. Am J Med Sci 2001 ; 321(6) : 401-410.
- Boudoulas H, et al : Le prolapsus de la valve mitrale et le syndrome du prolapsus de la valve mitrale. Am Heart J 1989 ; 118 : 796-818.
- Delling FN, Vasan RS : Epidémiologie et pathophysiologie du prolapsus de la valve mitrale : New Insights into Disease Progression, Genetics, and Molecular Basis. Circulation 2014 ; 129(21) : 2158-2170.
- Marks AR, et al : Identification de sous-groupes à haut risque et à faible risque de patients présentant un prolapsus de la valve mitrale. N Engl J Med 1989 ; 320 : 1031-1036.
- Cohen IS : Prolapsus de la valve mitrale par échocardiographie bidimensionnelle : preuve d’une relation entre la morphologie échocardiographique, les résultats cliniques et la taille de l’anneau mitral. Am Heart J 1987 ; 113 : 859-868.
- Shah, PM : Current concepts in mitral valve prolapse – Diagnosis and management. J Cardiol 2010 ; 56(2) : 125-133.
- Hickey RJ, MacMahon SW, Wileken DEL : Prolongement de la valve mitrale et endocardite bactérienne : quand une prophylaxie antibiotique est-elle nécessaire ? Am Heart J 1985 ; 109 : 431-435.
- Nishimura RA, et al : Prolapsus de la valve mitrale documenté par échocardiographie : suivi à long terme de 237 patients. N Engl J Med 1985 ; 313 : 1305-1309.
- Basso C, et al : Prolapsus arythmique de la valve mitrale et mort subite d’origine cardiaque. Circulation 2015 ; 132(7) : 556-566.
- Corrado D, et al : Mort subite chez des jeunes gens présentant un prolapsus valvulaire mitral apparemment isolé. G Ital Cardiol 1997 ; 27 : 1097-1105.
- Baumgartner H, et al. : 2017 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J 2017 ; 38(36) : 2739-2791.
- Tribouilloy CM, et al : Impact des symptômes préopératoires sur la survie après correction chirurgicale d’une régurgitation mitrale organique : justification de l’optimisation des indications chirurgicales. Circulation 1999 ; 99(3) : 400-405.
- Mohty D, Enriquez-Sarano M. The long-term outcome of mitral valve repair for mitral valve prolapse. Curr Cardiol Rep 2002 ; 4(2) : 104-110.
- Carpentier A, Adams D, Filsoufi F : Carpentier’s Reconstructive valve surgery. 1ère édition. Saunders ; 2010.
- Carpentier A, et al : Gestion conservatrice de la valve mitrale prolabée. Ann Thorac Surg 1978 ; 26(4) : 294-302.
- Maisano F, et al : La technique du bord à bord : une méthode simplifiée pour corriger l’insuffisance mitrale. Eur J Cardiothorac Surg 1998 ; 13(3) : 240-245 ; discussion 245-246.
CARDIOVASC 2017 ; 16(6) : 10-15