Le traitement interventionnel de la fibrillation auriculaire est basé sur l’élimination des déclencheurs et la modification du substrat. Par modification du substrat, on entend la création de lésions linéaires dans l’oreillette gauche et l’ablation focale sur des sites présentant des signaux électriques auriculaires fractionnés complexes (CFAE). La recommandation selon laquelle la fibrillation auriculaire paroxystique doit être traitée par l’élimination du trigger et la fibrillation persistante par la création supplémentaire de lésions linéaires est remise en question par de nouvelles méthodes de diagnostic qui peuvent localiser et quantifier les changements structurels et électriques dans les oreillettes.
La fibrillation auriculaire est le trouble du rythme le plus fréquent dans les sociétés occidentales. Les rapports de Haissaguerre sur les dépolarisations électriques focales dans les cordons musculaires au sein des veines pulmonaires en tant que déclencheurs de la fibrillation auriculaire ont été à l’origine d’un traitement interventionnel de la fibrillation auriculaire [1]. La technique du cathéter et différentes formes d’énergie (radiofréquence, froid, laser) permettent de sectionner ces cordons musculaires par voie endocardique, ce qui isole le trigger du myocarde auriculaire. L’isolation des veines pulmonaires s’est imposée comme le traitement de choix de la fibrillation auriculaire paroxystique, mais elle est de plus en plus pratiquée en cas de fibrillation auriculaire persistante. Toutefois, le taux de réussite du traitement interventionnel de la fibrillation auriculaire n’est pas satisfaisant. Chez les patients atteints de fibrillation auriculaire paroxystique, le taux de réussite passe de 80% à un an à 60% à cinq ans, malgré des interventions multiples et des améliorations constantes de la technique et de la méthode. Seuls 40% environ des patients souffrant de fibrillation auriculaire persistante sont encore en rythme sinusal après trois ans [2]. Les mécanismes sous-jacents à la fibrillation auriculaire, en particulier dans le cas d’une fibrillation auriculaire persistante, sont largement méconnus. Bien que les récidives de fibrillation auriculaire paroxystique puissent souvent être expliquées par des lacunes dans la ligne d’ablation, d’autres mécanismes sont susceptibles d’être à l’origine de l’apparition ou du maintien de l’arythmie chez une partie des patients, et en particulier chez les patients souffrant de fibrillation auriculaire persistante.
Le substrat décrit les modifications cellulaires et ultrastructurelles du myocarde auriculaire qui, outre le déclencheur dans les veines pulmonaires, constitue la base de l’apparition ou du maintien de l’arythmie. De multiples dépolarisations focales ectopiques, l’apparition de plusieurs “ondes” électriques se propageant de manière hétérogène à travers le myocarde auriculaire, des rotors, des excitations circulant rapidement dans un petit espace, mais aussi des mécanismes de réentrée fonctionnelle sans la présence de modifications structurelles du myocarde sont considérés comme responsables du maintien de la fibrillation auriculaire [3–5]. Cet article présente un aperçu des nouveaux développements permettant de différencier plus précisément les modifications structurelles et électriques chez les patients atteints de fibrillation auriculaire.
Fibrillation auriculaire – déclencheur et substrat
L’explication électrophysiologique de l’apparition et du maintien de la fibrillation auriculaire est le déclencheur et le substrat. Le déclenchement de la fibrillation auriculaire est généralement dû à des extensions musculaires de l’oreillette gauche dans les veines pulmonaires [6]. D’autres dépolarisations focales pouvant servir de déclencheur peuvent être trouvées, par exemple, au sein du myocarde auriculaire ou dans les fibres musculaires à la jonction entre l’oreillette droite et la veine cave supérieure. Des amas de ganglions nerveux se trouvent souvent à proximité de la jonction entre l’oreillette gauche et les veines pulmonaires et peuvent provoquer des dépolarisations électriques de ces fibres musculaires, initiant ainsi une fibrillation auriculaire. Les influences externes sur le système nerveux végétatif (p. ex. opération chirurgicale, stress) ainsi que les substances toxiques comme l’alcool, qui peuvent induire une fibrillation auriculaire, sont également considérées comme des déclencheurs.
La fibrose de l’oreillette gauche est à l’origine du maintien de la fibrillation auriculaire. La définition de ce tissu, appelé substrat, n’est toutefois pas uniforme. La description sommaire d’une fibrose repose sur des modifications cellulaires et ultrastructurelles des muscles de l’oreillette. La fibrillation auriculaire chronique entraîne à son tour des modifications électrophysiologiques, notamment un raccourcissement de la période réfractaire des cellules musculaires, ce qui favorise à son tour le maintien de la fibrillation auriculaire.
L’évolution clinique de la fibrillation auriculaire paroxystique à la fibrillation auriculaire persistante et enfin à la fibrillation auriculaire permanente doit refléter ces modifications de l’oreillette. Chez les patients atteints de fibrillation auriculaire paroxystique, la fibrillation auriculaire est donc due à une activité électrique spontanée de haute fréquence dans les veines pulmonaires. Dès que l’activité électrique cesse dans les veines pulmonaires, il y a conversion en rythme sinusal. Si la fibrillation auriculaire persiste, par définition à partir de sept jours, on parle de fibrillation auriculaire persistante et on suppose qu’il y a des modifications de la musculature auriculaire qui favorisent le maintien de la fibrillation. D’autres déclencheurs et excitations circulaires – des rotors – apparaissent, ce qui entretient la fibrillation auriculaire. Pendant les phases de rythme sinusal, ces mécanismes sont, au moins partiellement, inversés. La fibrillation auriculaire favorise donc la fibrillation auriculaire et le rythme sinusal favorise le rythme sinusal [7–9]. Sur cette base, des recommandations ont été formulées pour le traitement par cathéter de la fibrillation auriculaire : l’isolation des veines pulmonaires avec création d’une ligne d’ablation circonférentielle autour des deux paires de veines pulmonaires en cas de lésions paroxystiques, et en outre linéaires, dans l’oreillette gauche, ou l’ablation des déclencheurs en dehors de l’oreillette gauche en cas de fibrillation persistante et permanente. La base des lésions linéaires, qui vise à modifier le substrat, a été reprise du traitement chirurgical de la fibrillation auriculaire. L’opération Maze (labyrinthe en anglais) consiste à découper et à suturer l’oreillette gauche selon un schéma précis. La cicatrisation ultérieure, qui constituait une barrière aux impulsions électriques, a permis d’interrompre les impulsions électriques non coordonnées.
Cependant, sur la base d’études d’imagerie récentes sur des patients atteints de fibrillation auriculaire, on peut se demander si le choix du traitement basé sur le cathéter doit être fait en fonction de l’apparition clinique. Il est généralement admis que l’isolation des veines pulmonaires de l’oreillette gauche constitue la base d’une intervention par cathétérisme. Cependant, on ne sait pas exactement qui bénéficie de lésions supplémentaires et, dans la pratique, cela se fait de manière très différente. Cette question est importante, notamment parce que toute création de lésion linéaire augmente le risque de l’intervention et entraîne un risque supplémentaire d’arythmie.
Le substrat de la fibrillation auriculaire
La fibrose des muscles de l’oreillette est considérée comme une caractéristique du remodelage structurel [10]. La multiplication des fibroblastes modifie l’architecture des cellules. Des influences externes telles que l’ischémie, le stress oxydatif et mécanique ainsi que des stimuli inflammatoires entraînent une prolifération et une migration des fibroblastes et une différenciation en myofibroblastes, qui favorisent à leur tour la fibrose par la production de cytokines et de facteurs de croissance [11, 12]. La modification de l’architecture cellulaire et les interactions myocellules-fibroblastes modifient la vitesse de conduction, le potentiel de la membrane au repos, la repolarisation et l’excitabilité. Il en résulte un substrat arythmogène avec des dépolarisations spontanées, l’apparition de rotors et des mécanismes de réentrée, ce qui constitue la base du maintien de la fibrillation auriculaire.
Il est intéressant de noter qu’une fibrose auriculaire est observée non seulement chez les patients atteints de fibrillation auriculaire avec une cardiopathie structurelle, mais aussi chez ceux atteints de “fibrillation auriculaire solitaire” ; il semble y avoir une corrélation entre le pourcentage de fibrose auriculaire et la persistance de la fibrillation [13, 14]. Les mécanismes par lesquels la fibrose auriculaire maintient la fibrillation auriculaire font l’objet d’études approfondies. Il serait intéressant pour le clinicien de connaître l’étendue de la fibrose avant de procéder à une intervention par cathétérisme, afin de pouvoir planifier l’intervention en conséquence (isolation des veines pulmonaires ou lésions linéaires supplémentaires en fonction du degré de fibrose, ou déconseiller l’intervention en cas de fibrose importante).
Thérapie médicamenteuse
Les approches thérapeutiques médicamenteuses reposent sur la manipulation de l’activité ou de la prolifération des fibroblastes. Dans des études expérimentales, les statines et l’inhibition du système rénine-angiotensine-aldostérone (SRAA) par les inhibiteurs de l’ECA, les antagonistes des récepteurs de l’angiotensine et les antagonistes de l’aldostérone ont eu un effet favorable sur le substrat. Cependant, les données cliniques sont actuellement insuffisantes pour émettre des recommandations générales. Cependant, le blocage du système RAAS est une approche intéressante dans le traitement médicamenteux de la fibrillation auriculaire, du moins dans certaines populations de patients.
Évaluation non invasive du substrat auriculaire
La taille de l’oreillette gauche permet une évaluation indirecte de l’oreillette gauche. Les méthodes couramment utilisées à cet effet sont l’échocardiographie transthoracique et l’imagerie par ordinateur ou par résonance magnétique (IRM). Il est généralement admis que la fibrose auriculaire augmente avec la taille de l’oreillette gauche.
Plusieurs études ont montré un taux de récidive plus élevé après le traitement par cathéter de la fibrillation auriculaire chez les patients présentant une augmentation du diamètre ou du volume de l’oreillette gauche [15, 17]. Les limites de cette méthode sont la disponibilité d’un ordinateur et surtout d’une imagerie par résonance magnétique dans la pratique et la faible sensibilité de la méthode. L’IRM présente un avantage décisif par rapport aux autres méthodes, à savoir la possibilité de visualiser les tissus fibrosés.
Alors que les patients souffrant de fibrillation auriculaire paroxystique ont majoritairement un faible pourcentage de fibrose et ceux souffrant de fibrillation persistante un pourcentage plus élevé, une fibrose de l’oreillette gauche est trouvée de manière hétérogène dans les deux groupes. De plus, le taux de récidive après une ablation par cathéter est corrélé au degré de fibrose et les patients présentant une fibrose de l’oreillette gauche bénéficient de lésions linéaires supplémentaires. Cependant, le pourcentage de fibrose n’est pas corrélé au volume de l’oreillette [18]. Des observations personnelles soutiennent cette approche. La détermination endocardique du voltage électrique du myocarde auriculaire (voltage map) a montré d’une part qu’une augmentation de la taille de l’oreillette n’était pas nécessairement associée à des zones de voltage abaissé, et d’autre part que des zones de “faible voltage” étaient présentes chez 20% des patients atteints de fibrillation auriculaire paroxystique et dans seulement 35% des cas en cas de fibrillation auriculaire persistante(Fig. 1, données non publiées).
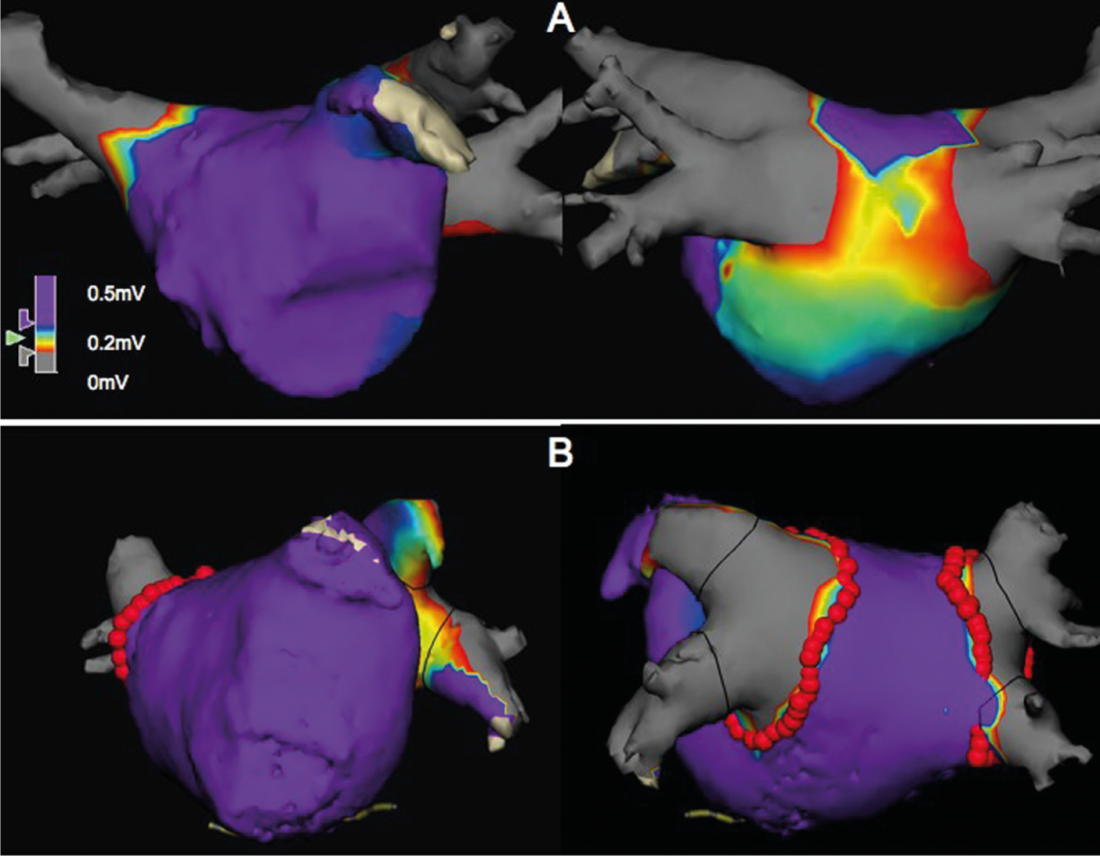
Fig. 1 : Cartes de voltage endocardique bipolaires de l’oreillette gauche, vue antéro-postérieure à gauche, vue postéro-antérieure à droite, avec respectivement 2 veines pulmonaires droites et lenticulaires et l’oreillette (vue antéro-postérieure). Les zones en violet ont une tension électrique >0,5mV. La zone verte à rouge a une tension de 0,2- 0,5 mV et correspond à une zone de “faible tension”, ce qui est compatible avec une fibrose. Les deux images supérieures montrent une zone de “faible voltage” étendue sur la paroi postérieure chez un patient souffrant de fibrillation auriculaire paroxystique, tandis que les images inférieures ne montrent aucune zone de “faible voltage” chez un patient souffrant de fibrillation auriculaire persistante. Les points rouges représentent la ligne d’ablation antrale circonférentielle.
L’IRM des oreillettes permettrait de conseiller les patients sur les chances de succès et les risques attendus en fonction du pourcentage de fibrose, et l’interventionniste pourrait mieux planifier l’intervention, par exemple en évitant les lésions linéaires en cas de fibrillation auriculaire persistante sans fibrose significative. Cependant, cette méthode n’est pas encore disponible pour une utilisation en routine.
La cartographie endocardique à haute résolution des oreillettes à l’aide de cathéters multipolaires a permis d’identifier des rotors électriques stables qui maintiennent la fibrillation chez les patients atteints de fibrillation auriculaire [19]. Les rotors et les déclencheurs focaux ont été trouvés à la fois dans l’oreillette gauche et dans l’oreillette droite, indépendamment du type de fibrillation auriculaire (paroxystique, persistante, prolongée). L’ablation par radiofréquence de ces rotors a entraîné une terminaison ou un ralentissement aigu de la fibrillation auriculaire significativement plus fréquent et a montré une plus grande absence de récidive par rapport à l’isolation conventionnelle des veines pulmonaires [20]. Cette découverte suggère que les rotors électriques jouent un rôle crucial dans le maintien de la fibrillation auriculaire.
Il est intéressant de noter que les rotors stables n’ont pas été trouvés dans les zones d’électrogrammes auriculaires fractionnés complexes (CFAE) [21], dont l’ablation, outre l’isolation des veines pulmonaires, est recommandée chez les patients atteints de fibrillation auriculaire persistante.
En se basant sur les connaissances de la cartographie intracardiaque, on tente de traduire l’activité électrique très complexe pendant la fibrillation auriculaire en paramètres dans l’ECG de surface. On peut se demander si cette information peut devenir une méthode non invasive de localisation précise et d’ablation par radiofréquence ultérieure de ces rotors. Il est cependant possible d’imaginer des déclarations sur le nombre et la localisation dans l’oreillette droite ou gauche, qui permettent de planifier une intervention dans un certain sens [22].
Une autre méthode non invasive en cours d’expérimentation est le “body surface mapping”. L’activité de la fibrillation auriculaire est mesurée à l’aide d’un grand nombre (>250) d’électrodes placées à la surface du corps. La position relative des électrodes est ensuite reportée sur un scanner des oreillettes. Après traitement de cette information électrique, le nombre et la localisation des rotors et des dépolarisations focales sont reportés à la surface des oreillettes. Les premiers rapports utilisant cette méthode pour cibler l’ablation des triggers et des rotors sont prometteurs, mais doivent encore être testés sur de plus grandes populations de patients [23].
Conclusions
Il n’existe actuellement aucune méthode utilisable en routine pour différencier le substrat auriculaire chez les patients atteints de fibrillation auriculaire. Les stratégies thérapeutiques interventionnelles actuelles reposent sur l’hypothèse d’une augmentation de la fibrose en cas de fibrillation auriculaire persistante et sur la recommandation qui en découle de produire des lésions linéaires en plus de l’isolation des veines pulmonaires. De nouvelles études sont prometteuses pour caractériser la localisation et la quantification du substrat électrique, des rotors et des dépolarisations électriques focales, et pour permettre une ablation ciblée.
On peut imaginer qu’à l’avenir, le traitement de la fibrillation auriculaire par cathéter sera individuel, basé sur la présence de tissus fibrosés ou sur l’identification des déclencheurs et des rotors.
Dr. med. David Altmann
Littérature :
- Haissaguerre M, Jais P, Shah DC, et al : Initiation spontanée de la fibrillation auriculaire par des battements ectopiques provenant des veines pulmonaires. N Engl J Med 1998 ; 339 : 659-666.
- Ganesan AN, Shipp NJ, Brooks AG, et al : Long-term Outcomes of Catheter Ablation of Atrial Fibrillation : A Systematic Review and Meta-analysis. J Am Heart Assoc 2013 ; 2 : e004549.
- Moe GK, Abildskov JA : La fibrillation auriculaire comme arythmie auto-entretenue indépendante de la décharge focale. Am Heart J 1959 ; 58 : 59-70.
- Jalife J, Berenfeld O, Mansour M : Mother rotors and fibrillatory conduction : a mechanism of atrial fibrillation. Cardiovasc Res 2002 ; 54 : 204-216.
- Eckstein J, Verheule S, de Groot NM, Allessie M, Schotten U : Mechanisms of perpetuation of atrial fibrillation in chronically dilated atria. Prog Biophys Mol Biol 2008 ; 97 : 435-451.
- Cheung DW : Activité électrique de la veine pulmonaire et son interaction avec l’oreillette droite chez le cochon de guinée. J Physiol 1981 ; 314 : 445-456.
- Wijffels MC, Kirchhof CJ, Dorland R, Allessie MA : La fibrillation auriculaire provoque une fibrillation auriculaire. Une étude chez des animaux endormis et instrumentés de manière chronique. Circulation 1995 ; 92 : 1954-1968.
- Morillo CA, Klein GJ, Jones DL, Guiraudon CM : Pacing atrial rapide chronique. Caractéristiques structurelles, fonctionnelles et électrophysiologiques d’un nouveau modèle de fibrillation auriculaire soutenue. Circulation 1995 ; 91 : 1588-1595.
- Kaseda S, Zipes DP : Contraction-excitation feedback in the atria : a cause of changes in refractoriness. J Am Coll Cardiol 1988 ; 11 : 1327-1336.
- Burstein B, Nattel S : Atrial fibrosis : mechanisms and clinical relevance in atrial fibrillation. J Am Coll Cardiol 2008 ; 51 : 802-809.
- Swynghedauw B : Mécanismes moléculaires du remodelage du myocarde. Physiol Rev 1999 ; 79 : 215-262.
- Weber KT, Sun Y, Tyagi SC, Cleutjens JP : Réseau de collagène du myocarde : fonction, remodelage structurel et mécanismes de régulation. J Mol Cell Cardiol 1994 ; 26 : 279-292.
- Boldt A, Wetzel U, Lauschke J, et al : Fibrosis in left atrial tissue of patients with atrial fibrillation with and without underlying mitral valve disease. Heart 2004 ; 90 : 400-405.
- Frustaci A, Chimenti C, Bellocci F, Morgante E, Russo MA, Maseri A : Substrat histologique des biopsies auriculaires chez les patients atteints de fibrillation auriculaire solitaire. Circulation 1997 ; 96 : 1180-1184.
- den Uijl DW, Tops LF, Delgado V, et al : Effet de l’anatomie de la veine pulmonaire et des dimensions de l’oreillette gauche sur le résultat de l’ablation circonférentielle par cathéter radiofréquence pour fibrillation auriculaire. Am J Cardiol 2011 ; 107 : 243-249.
- Berruezo A, Tamborero D, Mont L, et al : Pre-procedural predictors of atrial fibrillation recurrence after circumferential pulmonary vein ablation. Eur Heart J 2007 ; 28 : 836-841.
- Shin SH, Park MY, Oh WJ et al. Le volume de l’oreillette gauche est un prédicteur de la récidive de la fibrillation auriculaire après ablation par cathéter. J Am Soc Echocardiogr 2008 ; 21 : 697-702.
- Akoum N, Daccarett M, McGann C, et al : La fibrose atriale aide à sélectionner le patient et la stratégie appropriés dans l’ablation par cathéter de la fibrillation atriale : une approche guidée par DE-MRI. J Cardiovasc Electrophysiol 2011 ; 22 : 16-22.
- Shivkumar K, Ellenbogen KA, Hummel JD, Miller JM, Steinberg JS : Arrêt immédiat de la fibrillation auriculaire humaine par identification et ablation par cathéter de rotors et de sources localisés : première expérience multicentrique d’ablation par modulation d’impulsions focales et de rotor (FIRM). J Cardiovasc Electrophysiol 2012 ; 23 : 1277-1285.
- Narayan SM, et al : Traitement de la fibrillation auriculaire par l’ablation de sources localisées : CONFIRM (Conventional Ablation for Atrial Fibrillation With or Without Focal Impulse and Rotor Modulation) trial. J Am Coll Cardiol 2012 ; 60 : 628-636.
- Narayan SM, et al : Panoramic Electrophysiological Mapping but not Electrogram Morphology Identifies Stable Sources for Human Atrial Fibrillation : Stable Atrial Fibrillation Rotors and Focal Sources Relate Poorly to Fractionated Electrograms. Circ Arrhythm Electrophysiol 2013 ; 6 : 58-67.
- Jones AR, Krummen DE, Narayan SM : Non-invasive identification of stable rotors and focal sources for human atrial fibrillation : mechanistic classification of atrial fibrillation from the electrocardiogram. Europace 2013.
- Haissaguerre M, et al : Noninvasive Panoramic Mapping of Human Atrial Fibrillation Mechanisms : A Feasibility Report. J Cardiovasc Electrophysiol 2012 doi : 10.1111/jce.12075. [Epub ahead of print]