Les plasmocytoses réactives sont rares, mais elles sont alors souvent prononcées. Ils doivent être distingués d’une prolifération de plasmocytes réactifs (polyclonaux) et monoclonaux. Un diagnostic différentiel précis permet un traitement efficace.
La plasmocytose réactionnelle a été décrite pour la première fois en 1988 comme une prolifération polyclonale de plasmocytes dans le sang périphérique et est globalement rare [1,2]. Les maladies associées à une prolifération de plasmocytes réactifs comprennent d’une part des processus non néoplasiques tels que les maladies auto-immunes, les infections et les anémies par déficit en substrat, et d’autre part des processus néoplasiques malins, en particulier les maladies tumorales hématologiques [3,4]. Dans la plupart des cas, l’ampleur de la prolifération des plasmocytes est faible et souvent limitée à la moelle osseuse, mais des plasmocytoses prononcées sont possibles et peuvent conduire à un diagnostic de suspicion de leucémie à plasmocytes (tableau 1) .
Rapport de cas
Une patiente de 70 ans s’est présentée aux urgences d’un hôpital régional pour une dyspnée aiguë aggravée. Deux semaines auparavant, le médecin généraliste a initié un traitement antibiotique en présence d’un tableau clinique de pneumonie. En raison d’une dyspnée persistante au-delà du traitement antibiotique, un scanner thoracique a été réalisé, qui a révélé des embolies pulmonaires sous-segmentaires des deux côtés ainsi que des lymphadénopathies diffuses d’un diamètre maximal de 16 mm. Une anticoagulation orale par edoxaban a été établie et une évaluation des lymphadénopathies était prévue.
Aux urgences, la patiente s’est présentée tachydyspnéique avec une fréquence respiratoire de 35/min et une saturation en oxygène de 93% inférieure à 5 litres d’oxygène par minute. Les paramètres vitaux se présentaient par ailleurs comme suit : DP 119/81 mmHg, pouls 81/min, température 35,6°C. L’examen physique a mis en évidence des bruits respiratoires obstructifs et un stridor inspiratoire. Le reste de l’examen physique était sans particularité. En raison de la respiration obstructive, 125 mg de méthylprednisolone ont été administrés à titre probatoire, ce qui a entraîné une régression partielle de la dyspnée.
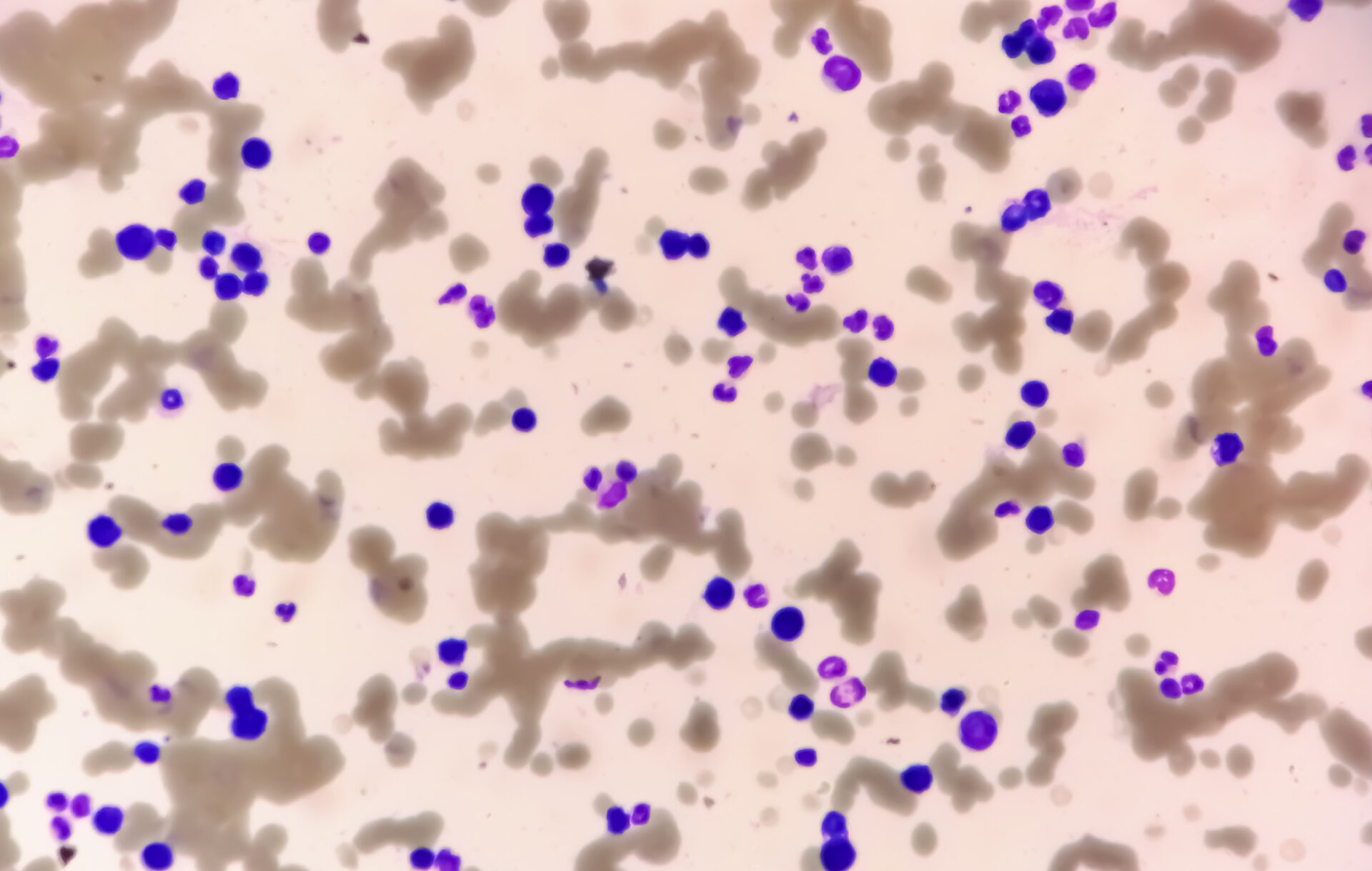
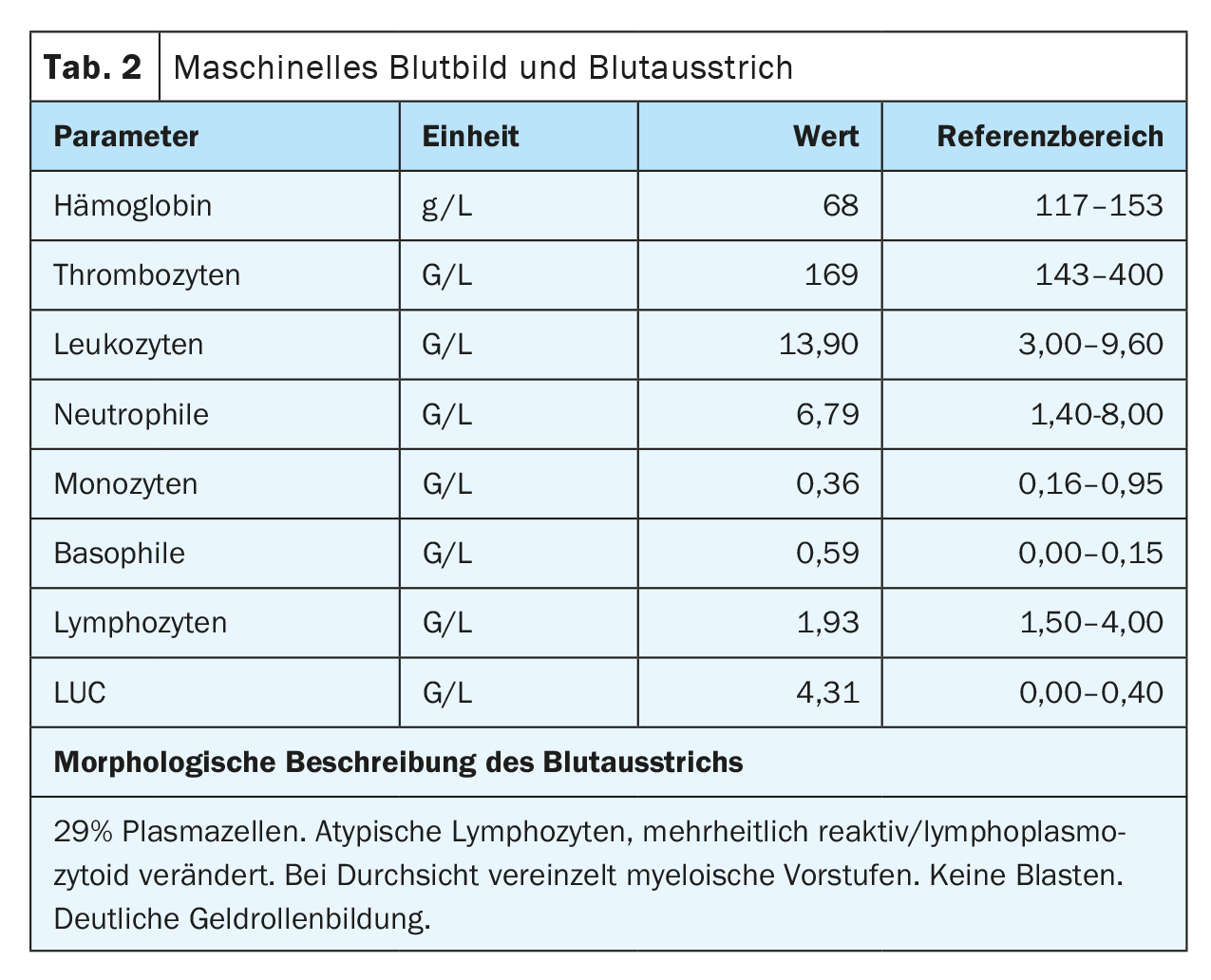
Le sang périphérique a révélé une anémie avec une hémoglobine de 77 g/L, des taux de plaquettes normaux et une leucocytose de 20,4 G/L, due à une exsudation de 29,5% de plasmocytes. En outre, les érythrocytes présentaient une forte formation de rouleaux d’argent, ce qui indique la présence d’une paraprotéinémie. Il en résulte une augmentation de la protéine sérique totale de 106 g/L (intervalle de référence : 62-80 g/L), une légère diminution de l’albumine de 28 g/L (intervalle de référence : 32-46 g/L) et une augmentation de la lactate déshydrogénase (LDH) de 987 U/L (intervalle de référence : 232-430 U/L).
Cette constellation de résultats a conduit à suspecter une leucémie à cellules plasmatiques et la dyspnée aiguë a été interprétée comme un signe possible de syndrome d’hyperviscosité. La patiente a donc été adressée à notre hôpital central pour l’évaluation d’une plasmaphérèse.
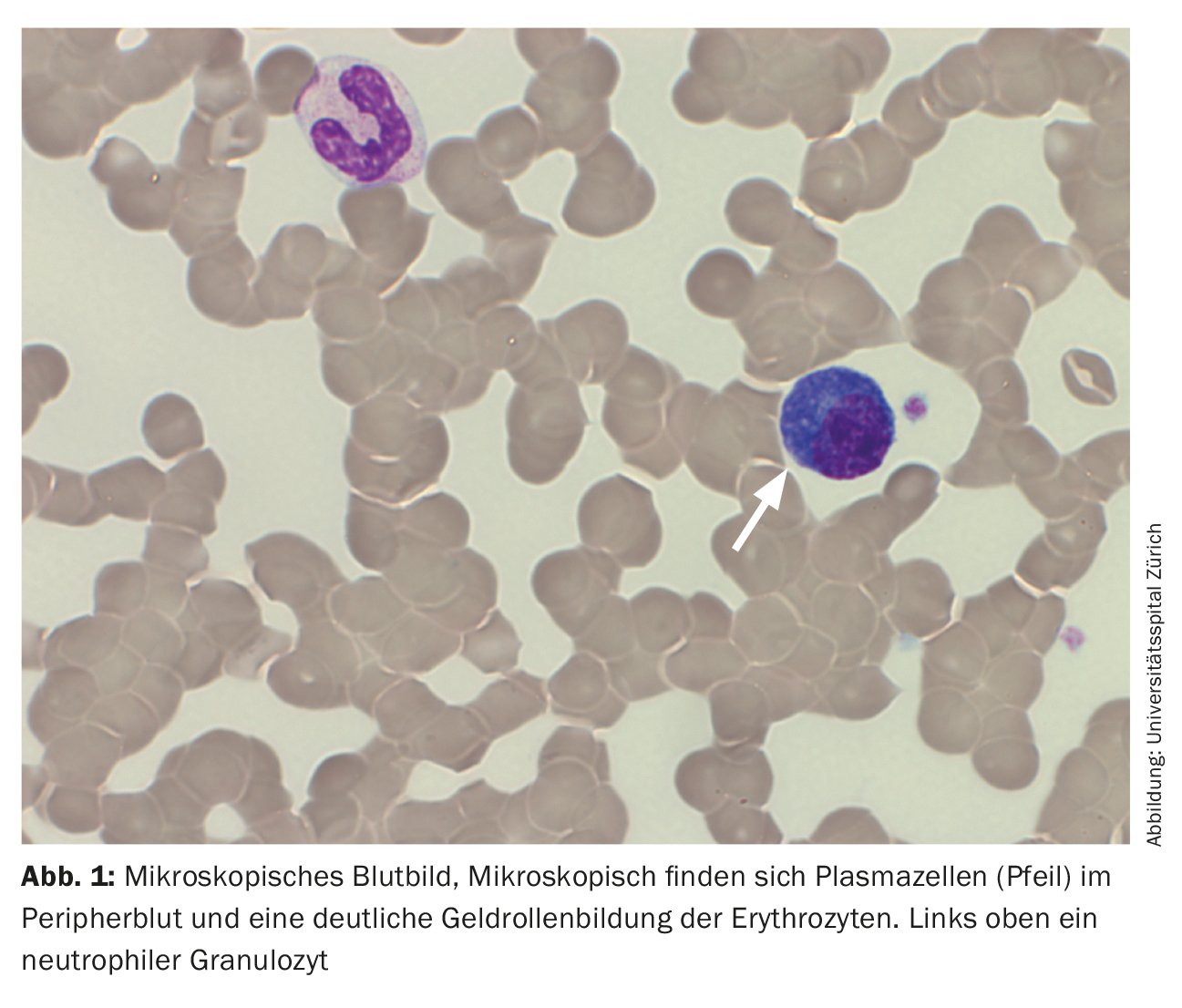
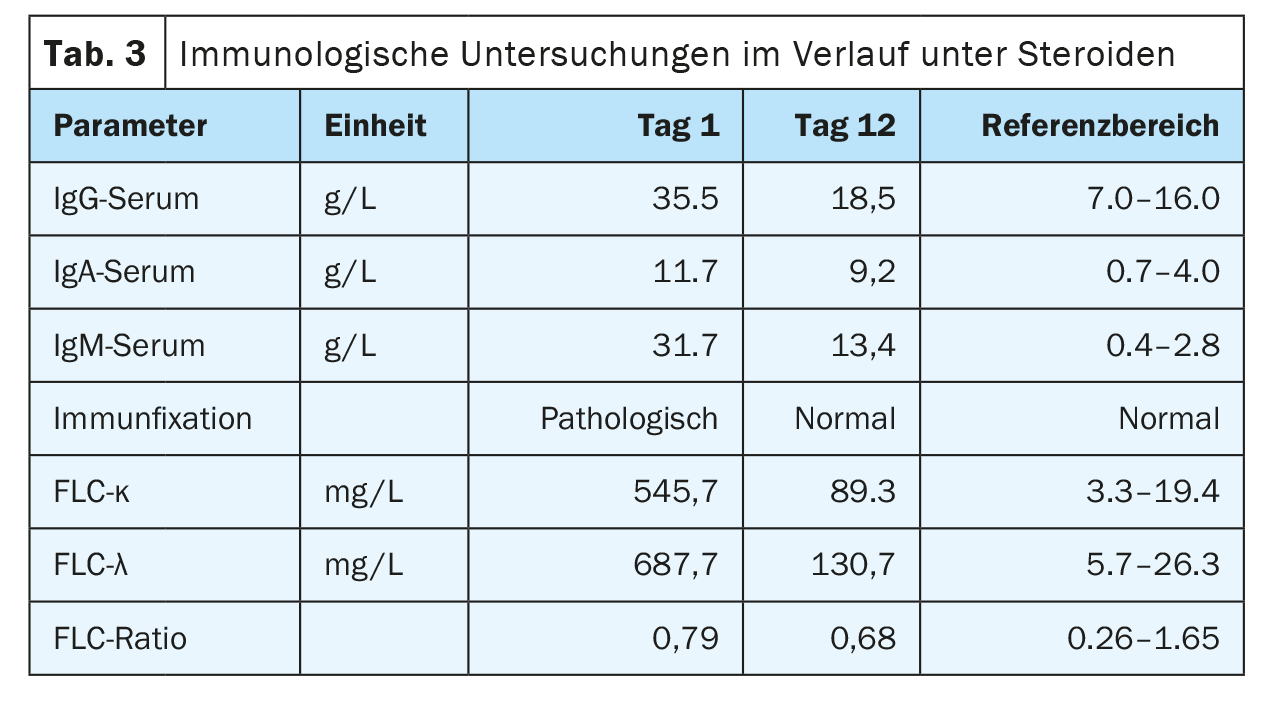
Lors de la prise en charge, la patiente se trouvait dans un état cardiopulmonaire stable avec une situation respiratoire compensée. Aucun autre symptôme nécessitant un traitement et pouvant être lié à l’hyperviscosité n’a été constaté, de sorte que la plasmaphérèse n’était pas indiquée. Les résultats externes impressionnants de plasmocytose périphérique à 29% ont été confirmés. (Tab. 2) (Fig. 1). Les analyses de sang ultérieures ont révélé une augmentation significative des immunoglobulines (IgG, IgM, IgA) et des chaînes légères libres dans le sérum, mais le rapport des chaînes légères n’est pas significatif. (tableau 3). Une large bande IgM lambda a été détectée en immunofixation, mais il n’a pas été possible de différencier avec certitude une bande clonale avec di/multimérisation d’un modèle polyclonal. La β2-microglobuline était également élevée à 17,6 mg/L (plage de référence <2,5 mg/L). Pour poursuivre le diagnostic, il a fallu procéder à une clarification de la clonalité des plasmocytes par immunophénotypage.
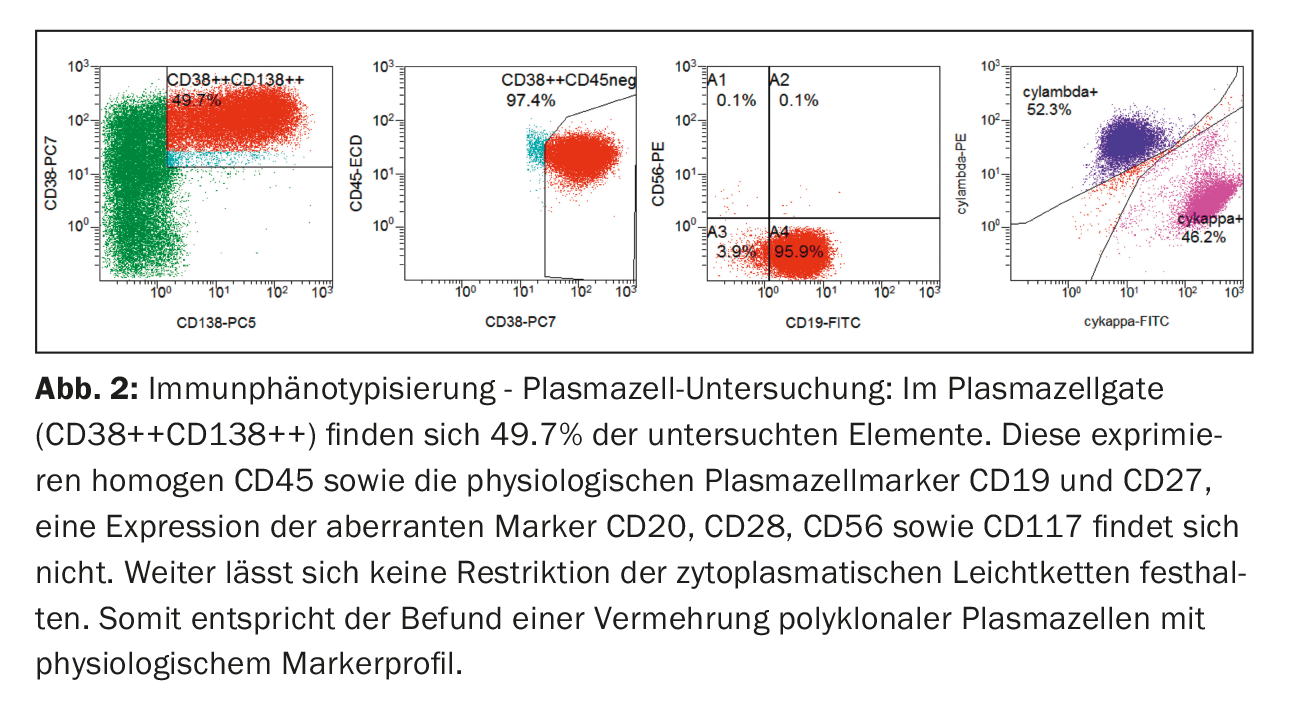
D’un point de vue immunophénotypique, les plasmocytes dans le sang périphérique étaient clairement plus nombreux dans la porte classique des plasmocytes (CD38++CD138++). Celles-ci ont montré une expression de CD45 ainsi que des marqueurs physiologiques des plasmocytes CD19 et CD27. Il n’y a pas eu d’expression de marqueurs aberrants (CD20, CD28, CD56 et CD117), ni de restriction des chaînes légères cytoplasmiques, de sorte qu’en résumé, on a assisté à une prolifération de plasmocytes polyclonaux (figure 2).
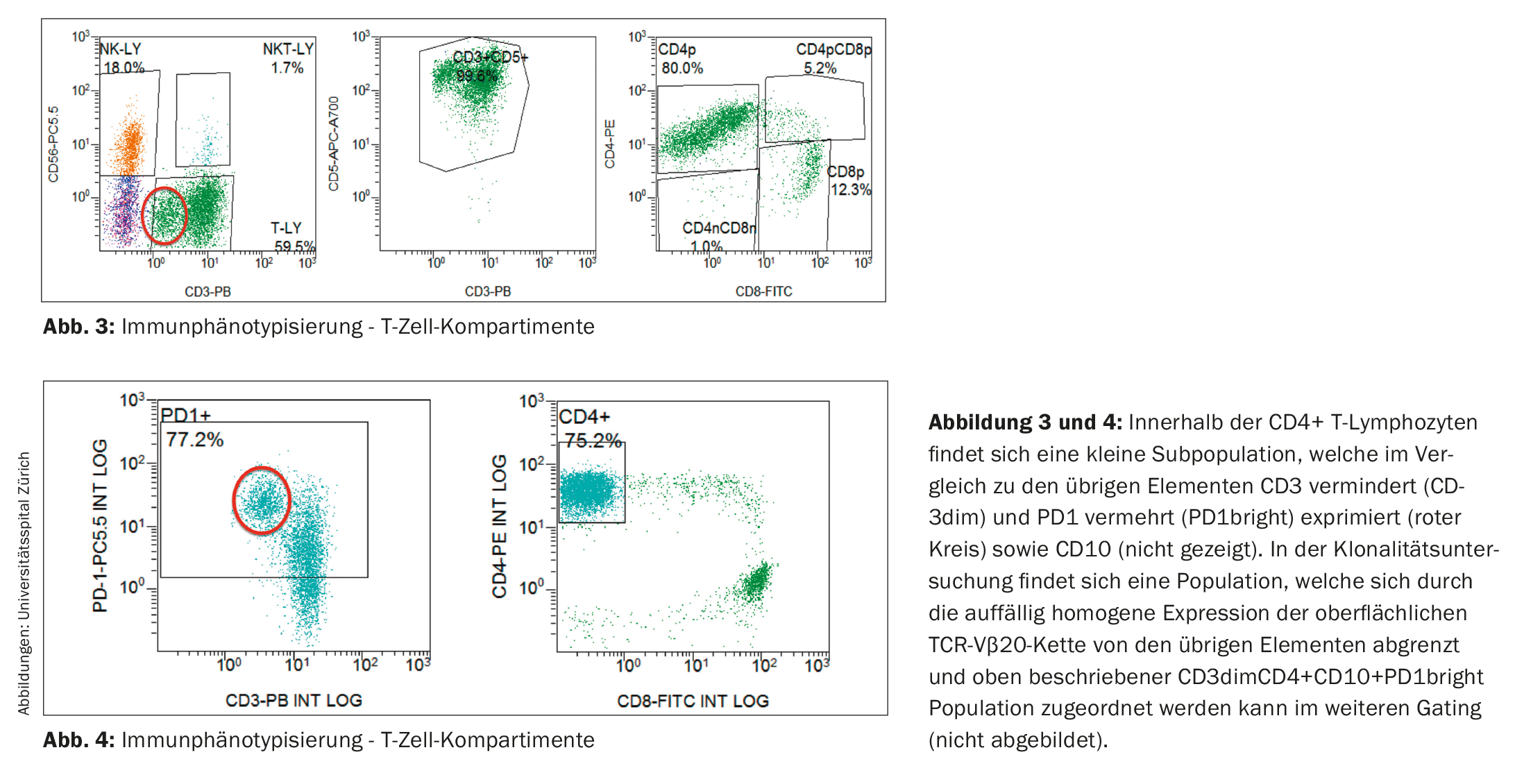
L’analyse immunophénotypique des lymphocytes n’a pas permis de mettre en évidence une population de cellules B clonales. En revanche, le compartiment des cellules T a montré un déplacement du rapport CD4:CD8 en faveur des lymphocytes T CD4 positifs (6,5:1 dans la présente étude ; plage de référence dans le sang périphérique : rapport CD4:CD8 2:1) ainsi qu’une petite population avec une expression réduite de CD3 (CD3dim). (Fig. 3). Dans l’étude de suivi, un immunophénotype CD4+CD3dimPD-1+CD10+ a été attribué à cette population anormale. (Fig. 4) et elle s’est avérée clonale pour la chaîne TCR-Vβ20 sur la base de l’analyse TCR. Le résultat était donc compatible avec un lymphome périphérique non hodgkinien à cellules T (LNH-T) de type lymphome angio-immunoblastique à cellules T (AITL).
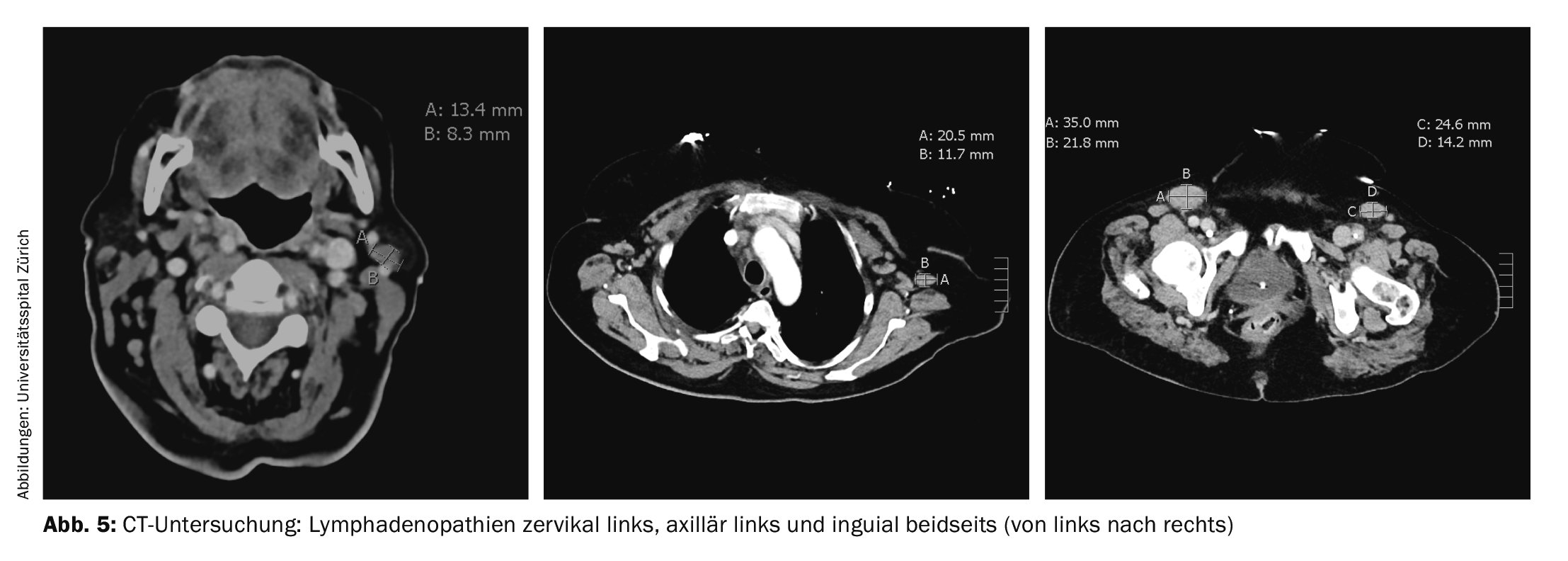
En raison de la dyspnée persistante, un nouveau scanner a été réalisé. L’examen n’a pas révélé d’embolie pulmonaire, mais a mis en évidence plusieurs lymphadénopathies, la plus importante étant inguinale gauche (35×22 mm) (figure 5). Une exérèse ganglionnaire axillaire droite a été réalisée en conséquence, confirmant le diagnostic de lymphome angio-immunoblastique à cellules T (AITL). L’examen de la moelle osseuse a montré une atteinte médullaire de l’AITL avec une infiltration de 10 à 15% ainsi qu’une prolifération médullaire de plasmocytes polyclonaux de 20%.
Le diagnostic de lymphome angio-immunoblastique à cellules T (AITL) de stade IV Ann-Arbor avec plasmocytose réactive a donc été posé (figure 6). Un traitement cytoréducteur à base de corticostéroïdes à haute dose a été initialement administré, ce qui a permis d’observer une amélioration rapide de l’état clinique et une nette régression de l’hyperglobulinémie G/M/A à court terme (tableau 3). Après confirmation du diagnostic, un traitement ciblé sur l’AITL par CHOP a été instauré.
Définition
La plasmocytose est définie comme une prolifération de plasmocytes dans le sang périphérique et peut être d’origine néoplasique, dans le sens d’une maladie clonale des plasmocytes, mais aussi d’origine réactionnelle [12]. La plasmocytose réactionnelle a été décrite pour la première fois en 1988 par Peterson et al. décrites comme des “proliférations immunoblastiques polyclonales systémiques” chez quatre patients présentant une prolifération plasmocytaire polyclonale dans le sang périphérique .
Dans la littérature, le terme plasmocytose est parfois assimilé à une prolifération de plasmocytes en général et le compartiment concerné (sang périphérique, moelle osseuse, autres tissus) est précisé.
Épidémiologie et étiologie
Les plasmocytoses réactives sont un phénomène rare, avec peu de cas rapportés, alors que les proliférations de plasmocytes réactifs dans la moelle osseuse sont relativement fréquentes [13,14]. Batdorf et al. ont constaté une prolifération de plasmocytes (définie comme une proportion de plasmocytes >2,0%) chez 8,8% (303/3435) des 3435 examens de moelle osseuse. Dans une étude plus restreinte menée par Gupta et al. 830 examens de la moelle osseuse ont été traités et une prolifération de plasmocytes (définie comme une proportion de plasmocytes >3,5%) a été constatée dans 13,7% (114/830) des cas. Dans les deux études, la prolifération des plasmocytes était due à un myélome plasmocytaire dans moins de 10% des cas [3,4].
Les maladies associées aux proliférations de plasmocytes réactifs sont d’une part des causes non malignes telles que les anémies par carence en substrat, les anémies hémolytiques, les infections (en particulier le VIH), les maladies auto-immunes et les maladies du foie (en particulier en cas de cirrhose du foie), et d’autre part des processus malins. Dans ce dernier cas, il s’agissait dans 15,7% à 55,4% des cas d’une tumeur hématologique. [3,4]. L’ampleur de la prolifération des plasmocytes était de 5 à 24% en cas d’étiologie non néoplasique, de moins de 10% en cas d’anémie et de 10 à 30% en cas d’infection ou de moelle osseuse hypoplasique [3]. Les proliférations réactives de plasmocytes peuvent également être dues à des médicaments. Par exemple, une étude de Zamarin et al. a montré que 20% des patients atteints de myélome plasmocytaire exposés de manière prolongée au lénalidomide (>6 mois) présentaient une hyperglobulinémie polyclonale et une prolifération de plasmocytes médullaires de 5-20% (médiane 12%). [15]. Ce phénomène est associé à une survie sans progression prolongée, le mécanisme n’est pas clair.
On ne trouve que des rapports de cas de plasmocytoses réactives, mais il n’est pas inattendu que le spectre des maladies sous-jacentes soit comparable : on trouve ainsi des rapports de plasmocytoses dans le cadre d’infections virales (hépatite aiguë A, virus Ebstein-Barr, parvovirus B19, dengue, virus SFTS) mais aussi bactériennes (S. aureus, K. pneumoniae) [5,7,10,16–20]. Un cas a été décrit chez une patiente atteinte du syndrome de Sjögren [8]. En outre, plusieurs cas de plasmocytoses prononcées sont associés à des lymphomes angio-immunoblastiques à cellules T et, dans un cas, un lien est même postulé avec un myélome à plasmocytes coexistant [6,9,13,21,22]. Bien que les cas rapportés présentent tous une plasmocytose importante, les plasmocytoses réactionnelles sont vraisemblablement faibles dans la plupart des cas ; par exemple, dans une série de cas de Jego et al. seulement 2 patients sur 10 ont présenté un taux d’excrétion plasmatique >20% sur [23].
Physiopathologie
Dans les proliférations plasmocytaires réactives, il existe un mélange de précurseurs de plasmocytes (blastes plasmocytaires) et de précurseurs (plasmocytes précoces), qui présentent tous une expression homogène de CD45bright, alors que dans la moelle osseuse normale et le myélome plasmocytaire, l’expression de CD45 est hétérogène [24]. Le mécanisme exact qui conduit à la prolifération n’est pas connu, mais une augmentation de la sécrétion de cytokines semble être une cause probable, d’autant plus que l’IL-2 et l’IL-10 sont des stimulants puissants pour la formation de blastes plasmatiques et de plasmocytes précoces [25]. L’IL-6 renforce cet effet et est essentielle à la survie des plasmocytes .
Le lymphome angio-immunoblastique à cellules T se caractérise histologiquement par un infiltrat inflammatoire polymorphe et, par rapport aux autres lymphomes périphériques à cellules T, il est plus souvent associé à des taux élevés de cytokines sériques (dont l’IL-6 et l’IL-10). Cette observation suggère que dans ces cas, la prolifération réactive de plasmocytes associée est médiée par des cytokines. Des cas isolés ont été décrits dans la littérature, dans lesquels une prolifération monoclonale de plasmocytes a également été constatée [13,27,28].
Messages Take-Home
- Les plasmocytoses réactives sont rares, mais peuvent être importantes (épuisement des plasmocytes >20%).
- En cas de plasmocytose, il est possible de distinguer rapidement et de manière fiable une prolifération plasmocytaire réactive (polyclonale) d’une prolifération plasmocytaire monoclonale grâce à un immunophénotypage par cytométrie de flux à partir du sang périphérique.
- Le diagnostic différentiel porte principalement sur les infections, les tumeurs malignes (en particulier les tumeurs hématologiques) et les maladies auto-immunes.
- Le mécanisme pathologique exact n’est pas clair, une augmentation de la sécrétion de cytokines (IL-2, IL-6, IL-10) est possible comme cause.
Littérature :
- Peterson LC, Kueck B Fau-Arthur DC, Arthur Dc Fau-Dedeker K, et al : Systemic polyclonal immunoblastic proliferations.
- Li L, et al : Prolifération de cellules plasmatiques polyclonales avec hypergammaglobulinémie marquée et auto-antibodies multiples. Ann Clin Lab Sci 36, 479-484 (2006).
- Gupta M, et al : Profil étiologique de la plasmocytose sur les aspirations de moelle osseuse. Dicle Medical Journal 43, 4, doi : 10.5798/diclemedj.0921.2016.01.0628 (2016).
- Batdorf B, Kroft S, Olteanu H, Harrington A : Reactive Bone Marrow Plasmacytosis : An Update for the Modern Era. American Journal of Clinical Pathology 142, A102-A102, doi : 10.1093/ajcp/142.suppl1.102 %J American Journal of Clinical Pathology (2014).
- Shtalrid M, Shvidel L, Vorst E : Polyclonal Reactive Peripheral Blood Plasmacytosis Mimicking Plasma Cell Leukemia in a Patient with Staphylococcal Sepsis. Leukemia & lymphoma 44, 379-380, doi : 10.1080/1042819021000029713 (2003).
- Ahsanuddin AN, Brynes RK, Li S : Plasmacytosis polyclonal du sang périphérique mimant la leucémie à cellules plasmatiques chez les patients atteints de lymphome T angio-immunoblastique : rapport de 3 cas et revue de la littérature. Int J Clin Exp Pathol 4, 416-420 (2011).
- Desborough MJ, Grech H : Epstein-Barr virus-driven bone marrow aplasia and plasmacytosis miming a plasma cell neoplasm. Br J Haematol 165, 272, doi : 10.1111/bjh.12721 (2014).
- Lee J, Chang Je Fau-Cho YJ, Cho Yj Fau-Han, et al. : cas de plasmacytose réactive mimant un myélome multiple chez un patient atteint du syndrome de Sjogren primaire.
- Sokol K, et al : Plasmocytose périphérique extrême mimant la leucémie à cellules plasmatiques comme caractéristique actuelle du lymphome angio-immunoblastique à cellules T (AITL). Front Oncol 9, 509, doi : 10.3389/fonc.2019.00509 (2019).
- Zhang J, et al : Reactive plasmacytosis mimicking multiple myeloma associated with SFTS virus infection : a report of two cases and literature review. BMC Infect Dis 18, 528, doi : 10.1186/s12879-018-3431-z (2018).
- SH S, et al. : Classification OMS des tumeurs des tissus hématopoïétiques et lymphoïdes. IARC Press, Lyon Classification des tumeurs de l’OMS, 4e édition révisée, Volume 2 (2017).
- J., B. B., Karl-Anton K : L’hémogramme – Méthodes de diagnostic et interprétation clinique. De Gruyter (2017).
- Xu J. et al : Angioimmunoblastic T-cell lymphoma with coexisting plasma cell myeloma : a case report and review of the literature. Tohoku J Exp Med 235, 283-288, doi : 10.1620/tjem.235.283 (2015).
- Pellat-Deceunynck C, et al : Les plasmocytoses réactives, un modèle pour l’étude de la biologie des progéniteurs et précurseurs de cellules plasmatiques humaines. The hematology journal : the official journal of the European Haematology Association / EHA 1, 362-366, doi : 10.1038/sj/thj/6200053 (2000).
- Zamarin D, et al : Polyclonal immune activation and marrow plasmacytosis in multiple myeloma patients receiving long-term lenalidomide therapy : incidence and prognostic significance. Leukemia 27, 2422-2424, doi : 10.1038/leu.2013.126 (2013).
- Wada T, et al. : Plasmocytose réactive du sang périphérique chez un patient atteint d’hépatite A aiguë.
- Koduri PR, Naides SJ : Transient blood plasmacytosis in parvovirus B19 infection : a report of two cases. Ann Hematol 72, 49-51, doi : 10.1007/bf00663017 (1996).
- Thai KT, et al : Forte incidence de plasmocytose sanguine périphérique chez les patients infectés par le virus de la dengue. Clin Microbiol Infect 17, 1823-1828, doi : 10.1111/j.1469-0691.2010.03434.x (2011).
- Wada T, Iwata Y, Kamikawa Y, et al : Plasmacytose du sang périphérique dans une fièvre sévère avec syndrome de thrombocytopénie. Jpn J Infect Dis 70, 470-471, doi : 10.7883/yoken.JJID.2016.575 (2017).
- Moon Y, et al : Klebsiella pneumoniae associated extreme plasmacytosis. Infect Chemother 45, 435-440, doi:10.3947/ic.2013.45.4.435 (2013).
- Sakai H, et al : Lymphome T angio-immunoblastique se présentant initialement avec un remplacement de la moelle osseuse et une plasmocytose périphérique. Intern Med 46, 419-424, doi : 10.2169/internalmedicine.46.6121 (2007).
- Yamane A, Awaya N, Shimizu T, et al : Lymphome angio-immunoblastique à cellules T avec prolifération polyclonale de cellules plasmatiques dans le sang et la moelle périphériques. Acta Haematol 117, 74-77, doi : 10.1159/000096894 (2007).
- Jego G, et al : Les macytoses plasmatiques réactives sont des expansions de plasmablasts qui conservent la capacité de se différencier en cellules plasmatiques.
- Pellat-Deceunynck C, Bataille R : Cellules plasmatiques humaines normales et malignes : prolifération, différenciation, et expansions en relation avec l’expression du CD45. Blood Cells Mol Dis 32, 293-301, doi:10.1016/j.bcmd.2003.12.001 (2004).
- Jego G, Bataille R, Pellat-Deceunynck C : L’interleukine-6 est un facteur de croissance pour les plasmablasts humains non malins. Blood 97, 1817-1822, doi:10.1182/blood.v97.6.1817 (2001).
- Jourdan M, et al : L’IL-6 soutient la génération de cellules plasmatiques humaines de longue durée en combinaison avec soit l’APRIL soit des facteurs solubles de cellules stromales. Leukemia 28, 1647-1656, doi:10.1038/leu.2014.61 (2014).
- Dogan A, Attygalle AD, Kyriakou C : Lymphome T angio-immunoblastique. Br J Haematol 121, 681-691, doi : 10.1046/j.1365-2141.2003.04335.x (2003).
- Yi JH, Ryu KJ, Ko YH, et al : Profiles of serum cytokines and their clinical implications in patients with peripheral T-cell lymphoma. Cytokine 113, 371-379, doi : 10.1016/j.cyto.2018.10.009 (2019).
InFo ONKOLOGIE & HÉMATOLOGIE 2023 ; 11(6) : 6-10