Le cancer du poumon est le cancer le plus meurtrier au monde et son incidence continue d’augmenter de nos jours. Malgré les progrès réalisés dans le domaine du diagnostic et du traitement, le taux de létalité du cancer du poumon est le plus élevé pour les deux sexes par rapport à tous les autres types de cancer. En principe, on distingue les cancers du poumon à petites cellules des cancers non à petites cellules, ce qui est d’une importance capitale pour le régime thérapeutique et le pronostic. Alors que les cancers du poumon à petites cellules sont le domaine de la chimiothérapie et de la radiothérapie, les cancers du poumon non à petites cellules (“non-small cell lung cancer”, NSCLC) sont opérés au stade localisé, ce qui permet d’obtenir une guérison. Cet article de synthèse traite exclusivement du suivi et du pronostic des CBNPC opérés à visée curative.
Comme le cancer du poumon n’est souvent diagnostiqué qu’à un stade avancé et souvent déjà métastasé, seuls 25 à 30 % des cancers du poumon non à petites cellules (NSCLC) peuvent être opérés [1]. La condition préalable à un concept de traitement chirurgical est la possibilité d’une résection radicale, à condition que le patient soit opérable [2]. En règle générale, pour les stades I à IIIA, il convient d’opter pour une approche chirurgicale, éventuellement accompagnée d’une chimiothérapie (néo)adjuvante. Le taux de survie à 5 ans correspondant aux stades de la tumeur se situe entre 24 et 73% pour ce groupe de patients (Fig. 1) [2].

Récidive et carcinome métachrone
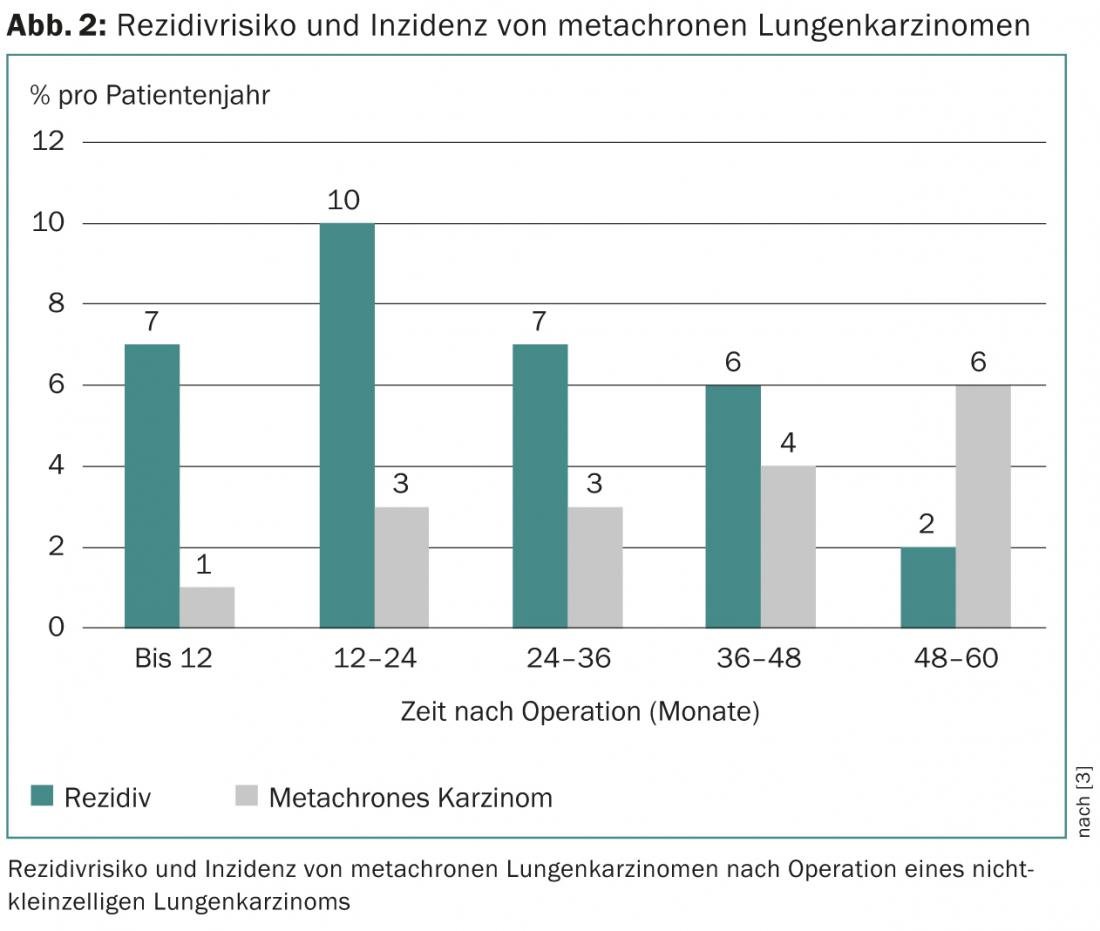
La probabilité de survie du patient dépend du stade de la tumeur et du risque de récidive correspondant. Ce dernier augmente au cours des deux premières années après l’opération pour atteindre un maximum de 10% par an, puis diminue lentement [3]. De manière cumulative, 5 à 71% des patients – en fonction du stade initial de la tumeur – souffrent d’une récidive, qui survient dans la moitié des cas au cours des deux premières années postopératoires [4–7]. Il faut également distinguer la récidive de la survenue d’un carcinome métachrone (“second primary carcinoma”), dont le risque augmente progressivement avec le temps après l’opération (figure 2).
Le pour et le contre du suivi postopératoire
Compte tenu du taux de récidive et du risque de carcinome métachrone, il semble judicieux que ces néoplasmes puissent être détectés précocement, c’est-à-dire à un stade asymptomatique, grâce à un suivi structuré (en anglais “post therapy surveillance”) – à condition qu’une nouvelle intervention thérapeutique améliore les chances de survie et la qualité de vie.
Malheureusement, les données concernant la valeur des contrôles postopératoires après un cancer du poumon opéré sont plutôt rares et parfois même contradictoires. Le taux de chirurgie des récidives locorégionales étant relativement faible (1-4%), il n’est pas possible de tirer des conclusions fiables sur l’utilité d’un suivi de la tumeur [7]. Les études randomisées et contrôlées qui se sont penchées sur cette question sont totalement absentes. Une étude prospective non randomisée a montré que la durée médiane de survie était significativement plus longue pour les récidives asymptomatiques que pour les récidives symptomatiques [6]. D’autres auteurs n’ont cependant pas constaté d’influence d’un suivi structuré sur la durée de survie ou sur la qualité de vie [8–10]. Cependant, malgré l’hétérogénéité des programmes de suivi utilisés dans les études incluses, une méta-analyse récente a montré que le suivi structuré permettait de diagnostiquer plus facilement les récidives à un stade d’étude asymptomatique, ce qui améliore significativement la probabilité de survie (Hazard Ratio 0,61, intervalle de confiance à 95% 0,50-0,74, p<0,01) [11]. Il faut toutefois tenir compte du rapport coût-efficacité des contrôles postopératoires réguliers, qui s’élève à environ 90 000 francs suisses par patient-année [12, 13].
Malheureusement, les études qui se sont penchées sur cette question jusqu’à présent n’ont pas pris en compte le stade initial de la tumeur ni la résécabilité d’une récidive locorégionale. C’est la raison pour laquelle plusieurs voix s’élèvent pour réclamer un programme de suivi “individualisé”, c’est-à-dire adapté au stade de la tumeur et à l’état de santé [7].
Méthodes de suivi postopératoire
En principe, le suivi postopératoire peut faire appel à différentes modalités, seules ou combinées (radiographie, scanner, tomographie par émission de positons [PET], bronchoscopie, laboratoire et examen clinique).
Cependant, l’hétérogénéité des programmes de suivi rend difficile une évaluation définitive de leur utilité et de leur rentabilité. Comme nous l’avons déjà mentionné, il n’existe pas d’études randomisées comparant les différentes stratégies chez les patients opérés d’un NSCLC. Ainsi, on ne sait pas actuellement quelle méthode de contrôle a posteriori doit être appliquée et à quels intervalles. A cet égard, les recommandations et les avis d’experts des différentes sociétés savantes ne sont pas non plus uniformes. En revanche, tout le monde s’accorde à dire que des contrôles de suivi réguliers sont utiles (tableau 1). En ce qui concerne la méthode, la tomodensitométrie semble être la méthode de choix en raison de son rapport coût-efficacité, de son exposition relativement faible aux radiations et de sa sensibilité relativement bonne (62-100%), bien que la TEP/TDM soit supérieure en termes de sensibilité (97-100%) [7].
Autre question non résolue : qui doit effectuer les contrôles postopératoires ? Néanmoins, une étude rétrospective portant sur 245 patients indique qu’il n’y a pas de différence significative en termes de mortalité lorsque les contrôles postopératoires sont effectués par l’équipe chirurgicale traitante ou par un médecin généraliste [14]. Selon une étude britannique, il semble même justifiable que des infirmières spécifiquement formées puissent assurer un suivi comparable à celui des médecins en termes de satisfaction des patients et de coûts [15]. Cependant, l’impact sur les taux de mortalité n’a pas été pris en compte dans cette étude.

Conclusion
Bien qu’il n’y ait pas de données claires sur l’utilité d’un suivi postopératoire structuré pour le NSCLC, un programme de suivi semble être recommandé lorsqu’une approche thérapeutique curative peut être proposée. La fréquence des récidives étant nettement plus élevée au cours des deux premières années postopératoires qu’au cours des années suivantes, les contrôles de suivi doivent être plus rapprochés (par exemple tous les 3 à 6 mois), en particulier au cours de cette période. Dans le même temps, il convient toutefois de noter que le nombre de tomographies, en particulier chez les jeunes patients, doit être pris en compte en raison de l’exposition aux radiations. Néanmoins, la tomodensitométrie semble être la méthode de choix pour le suivi des tumeurs en raison de sa grande sensibilité et de son exposition relativement faible aux radiations.
Conclusion pour la pratique
- Le risque de récidive après un cancer du poumon non à petites cellules opéré à titre curatif est le plus élevé au cours des deux premières années postopératoires (7-10%/an).
- La détection précoce d’une récidive à un stade asymptomatique permet probablement de réduire la mortalité, à condition qu’une approche thérapeutique curative puisse être proposée. Toutefois, les données disponibles à ce sujet sont insuffisantes.
- Il n’existe pas d’études randomisées comparant différents programmes de suivi (modalité, moment et intervalle) en termes d’utilité et de rentabilité. C’est pourquoi les recommandations des différentes sociétés savantes sont hétérogènes à cet égard.
- En raison de sa grande sensibilité et de son exposition relativement faible aux radiations, le scanner est actuellement la méthode de choix pour détecter les récidives précoces.
Dr. med. Daniel Franzen
Littérature :
- Eur Respir Rev 2013 ; 22 : 382-404.
- Chest 2009 ; 136 : 260-271.
- J Thorac Cardiovasc Surg 2013 ; 145 : 75-81 ; discussion 81-72.
- Cancer Res 1995 ; 55 : 51-56.
- Ann Thorac Surg 1984 ; 38 : 331-338.
- Ann Thorac Surg 2000 ; 70 : 1185-1190.
- Ann Thorac Surg 2013 ; 95 : 1112-1121.
- Chest 1999 ; 115 : 1494-1499.
- J Thorac Cardiovasc Surg 1996 ; 112 : 356-363.
- Ann Surg 1995 ; 222 : 700-710.
- J Thorac Oncol 2011 ; 6 : 1993-2004.
- Ann Thorac Surg 1995 ; 60 : 1563-1570 ; discussion 1570-1562.
- Eur Respir J 2002 ; 19 : 464-468.
- Ann Thorac Surg 2000 ; 69 : 1696-1700.
- BMJ 2002 ; 325 : 1145.
- J Clin Oncol 2004 ; 22 : 330-353.
- Ann Oncol 2010 ; 21 Suppl 5 : v103-115.
- Chest 2007 ; 132 : 355S-367S.
- Radiology 2000 ; 215 Suppl : 1363-1372.
- National Comprehensive Cancer Network (NCCN) Guidelines in Oncology : Non-Small Cell Carcinoma. Disponible à : www.nccn.org/professionals/physician_gls/PDF/nscl.pdf
InFo Oncologie & Hématologie 2013 ; 1(1) : 22-24