Le récepteur HER2 fait partie de la famille des quatre récepteurs tyrosine kinases transmembranaires (EGFR/HER1, HER2, HER3 et HER4) qui influencent la croissance, la différenciation et la survie des cellules. La surexpression de HER2 est présente dans environ 20% des cas de cancer du sein au stade précoce et est associée à une évolution plus agressive de la maladie et à un mauvais pronostic. Seule l’introduction de substances spécifiques ciblant HER2 a permis d’améliorer considérablement le pronostic des patientes atteintes d’un cancer du sein HER2 positif.
La seule substance autorisée au stade précoce du carcinome mammaire est l’anticorps monoclonal trastuzumab (Herceptin®), selon la conférence internationale de consensus de Saint-Gall [1]. D’autres substances telles que le lapatinib (Tyverb®) et le pertuzumab (Perjeta®) sont actuellement évaluées dans cette indication dans le cadre de grandes études internationales. Ils sont déjà autorisés en situation métastatique et le T-DM1 (Kadcyla®) est une autre nouvelle option thérapeutique.
Trastuzumab
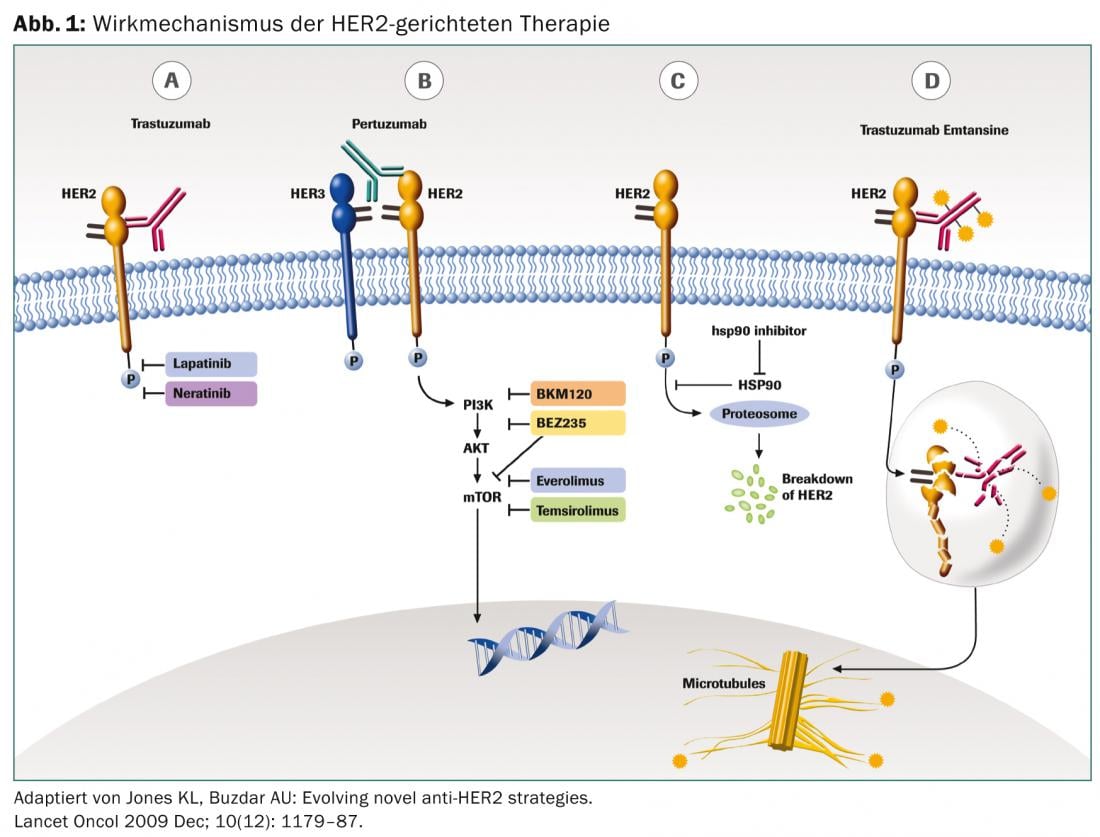
L’anticorps monoclonal trastuzumab a pour cible le domaine extracellulaire du récepteur HER2. En tant que médiateur de la cytotoxicité à médiation cellulaire dépendante des anticorps (ADCC), il empêche la poursuite de la prolifération. L’administration se fait par voie intraveineuse. Le traitement est généralement bien toléré. Lors de la première application, une réaction liée à la perfusion peut se produire avec de la fièvre, des frissons et des douleurs articulaires, qui peuvent être bien traitées avec du paracétamol. Une cardiotoxicité cumulative est connue, c’est pourquoi une échocardiographie est recommandée avant le début du traitement et à intervalles réguliers par la suite.
Lapatinib
Le lapatinib administré par voie perorale inhibe de manière réversible les domaines tyrosine kinase des récepteurs EGF (ErbB1) et ErbB2 (HER2). De plus, contrairement au trastuzumab, la molécule lapatinib est plus petite, ce qui pourrait expliquer son meilleur effet sur les métastases cérébrales. Les effets secondaires sont principalement des symptômes gastro-intestinaux avec diarrhée, perte d’appétit et nausées, ainsi que des éruptions cutanées, de la fatigue et de l’hépatotoxicité. Une cardiotoxicité cumulative a également été décrite avec le lapatinib, raison pour laquelle une surveillance appropriée est recommandée.
Pertuzumab
Le pertuzumab est également un anticorps monoclonal qui se lie spécifiquement au domaine de dimérisation extracellulaire (sous-domaine II) du récepteur HER2, tandis que le trastuzumab se lie au domaine IV. Le pertuzumab bloque ainsi la formation de l’hétérodimérisation dépendante du ligand de HER2 avec d’autres membres de la famille HER2, y compris HER1, HER3 et HER4. Le pertuzumab se lie ainsi à une autre région du récepteur HER2 que le trastuzumab, ce qui entraîne un effet synergique. Le profil d’effets secondaires est le même que celui du trastuzumab.
T-DM1
Le trastuzumab-emtansine est un conjugué de trastuzumab et de l’agent cytostatique mertansine, un inhibiteur de la microtubuline. L’anticorps se lie spécifiquement aux cellules tumorales HER2-positives, ce qui explique pourquoi le cytostatique a comparativement peu d’effet en dehors des manifestations tumorales. Cela explique également sa bonne tolérance.
Les effets secondaires suivants sont observés : Réactions à la perfusion avec frissons et fièvre, hématotoxicité avec notamment une thrombocytopénie à contrôler et des élévations des enzymes hépatiques (ALT, AST).
Indications
Avant un éventuel traitement, le statut HER2 doit être déterminé par un examen immunohistochimique validé sur la préparation tumorale. Cela peut également être étudié sur un bloc de tumeur retiré précédemment. Seul un résultat triple positif est considéré comme suffisant pour un traitement anti-HER2 et donc positif. En cas de doute (2+), on procède en outre à la détermination de l’amplification du gène HER2 par hybridation in situ en fluorescence (FISH), qui est considérée comme positive à partir d’un ratio >2,2 et permet ainsi de se qualifier pour une thérapie ciblée.
Stade précoce – Traitement adjuvant
A ce stade, seul le trastuzumab est autorisé, en association avec la chimiothérapie. L’autorisation de mise sur le marché a été accordée après la publication de l’étude HERA en 2005, qui a démontré un avantage significatif en termes de survie sans maladie et de survie globale pour les patientes atteintes d’un cancer du sein HER2-positif et traitées par trastuzumab pendant un an. Une durée de prise de deux ans de trastuzumab n’augmente pas davantage l’efficacité, comme nous le savons depuis fin 2012 [2]. Récemment, les données de l’étude PHARE ont également été présentées, comparant un traitement de six mois contre un an de trastuzumab [3]. Cette étude a été négative, resp. elle n’a pas atteint le critère d’évaluation primaire de “non-infériorité”.
Sur la base des données NOAH, le trastuzumab est également utilisé en néoadjuvant, c’est-à-dire en préopératoire en combinaison avec une chimiothérapie. La survie sans récidive à 3 ans était significativement meilleure avec 71% contre 56% pour les patients traités sans trastuzumab [4].
L’immunothérapie adjuvante au trastuzumab est généralement débutée après une chimiothérapie à base d’anthracycline (pas d’association en raison de la cardiotoxicité cumulative potentielle ) et peut être associée à une chimiothérapie non anthracycline, à un traitement endocrinien et à une radiothérapie.
Le lapatinib fait également l’objet d’études. Cette année, une étude de phase III a été publiée, comparant le lapatinib au trastuzumab et montrant une survie sans progression comparable avec une toxicité plus élevée [5].
Les données ALTTO, qui ont également examiné cette question et en plus une combinaison de trastuzumab et de lapatinib, sont en attente, le bras lapatinib ayant dû être fermé prématurément. Ceci parce que le bras lapatinib semble être inférieur au bras trastuzumab.
Le standard thérapeutique actuel en situation adjuvante dans le cancer du sein HER2-positif comprend donc une immunothérapie par trastuzumab pour une durée d’un an.
Stade avancé, métastasé
Il existe plusieurs options thérapeutiques pour le traitement des patientes atteintes d’un cancer du sein métastatique HER2-positif. Outre la thérapie endocrinienne ainsi que la thérapie cytostatique, l’immunothérapie revêt ici une grande importance. En principe, toute patiente atteinte d’un cancer du sein HER2-positif devrait se voir proposer une thérapie ciblée appropriée.
Alors que seuls le trastuzumab et le lapatinib étaient disponibles il y a quelques années, l’éventail des options thérapeutiques s’est encore élargi ces derniers mois.
Traitement de première ligne : en 2001, Slamon a publié la première grande étude de phase III qui a montré une survie sans progression nettement plus longue, une meilleure réponse et une réponse plus longue ainsi qu’un avantage de survie pour un traitement combiné par chimiothérapie et trastuzumab [6]. Un bénéfice a également été démontré en combinaison avec un traitement endocrinien [7].
Une étude du SAKK (Groupe suisse de recherche clinique sur le cancer, www.sakk.ch) examine si une monothérapie par trastuzumab est suffisante en premier traitement, suivie d’une combinaison avec une chimiothérapie. Les résultats sont en attente. Aujourd’hui, le trastuzumab est le plus souvent utilisé en première ligne en association avec la chimiothérapie ou, si la chimiothérapie ne semble pas appropriée, avec la thérapie endocrinienne.
Des données récentes de l’étude CLEOPATRA ont montré que le docétaxel associé au trastuzumab et au pertuzumab était supérieur au docétaxel et au trastuzumab en termes de survie sans progression et de survie globale. Cependant, il faut aussi accepter une toxicité accrue , notamment en termes de neutropénies fébriles et de diarrhée [8]. Le pertuzumab est désormais autorisé par Swissmedic dans cette indication et remboursé par les caisses-maladie après obtention préalable d’une garantie de paiement.
A partir du traitement de deuxième ligne : malgré le traitement ciblé, la maladie progresse sous trastuzumab en raison du développement de résistances. Ce développement de résistance est dû, entre autres, à une modification du récepteur HER2 et de la voie de signalisation PI3K/Akt. De plus, il y a une régulation positive de HER3 ou IGF1R [9]. Le traitement anti-HER2 doit cependant être poursuivi conformément au consensus général (ESMO-Guidelines) [10].
Une possibilité est de poursuivre le trastuzumab en changeant de composante de chimiothérapie [11, 12]. Comme alternative, le lapatinib (en association avec la capécitabine) est disponible dès la deuxième ligne de traitement [13]. L’avantage de cette combinaison thérapeutique est qu’elle peut être administrée par voie orale, mais la toxicité est généralement plus élevée (en particulier syndrome main-pied, symptômes gastro-intestinaux). En plus du lapatinib, le T-DM1 est désormais utilisé à partir de la deuxième ligne. Il a été comparé à l’association lapatinib et capécitabine et s’est révélé supérieur tant en termes de survie globale que de tolérance [14]. Celui-ci est autorisé en Suisse depuis 2013, mais il n’est pas encore remboursé et nécessite une garantie de prise en charge préalable.
La meilleure séquence thérapeutique en situation métastatique n’est pas claire. Les nouvelles substances pertuzumab et T-DM1 sont actuellement évaluées dans le cadre de l’étude SAKK 22/10. En première ligne de traitement, on randomise dans un double blocage de HER2 (trastuzumab et pertuzumab) avec chimiothérapie vs sans chimiothérapie. Le T-DM1 est alors envisagé comme traitement de deuxième ligne.
Perspectives
L’application sous-cutanée du trastuzumab [15] a déjà été testée, ce qui pourrait constituer à l’avenir un nouveau mode d’application potentiellement attrayant.
De grandes études internationales sont actuellement en cours pour déterminer si les nouvelles substances sont également efficaces en situation adjuvante.
De plus, de nouveaux inhibiteurs de tyrosine kinase (ITK) per os sont en cours d’évaluation. Le nératinib en particulier, un EGFR-HER2-TKI irréversible, semble prometteur.
TAKE HOME MESSAGE
- Le pronostic du cancer du sein HER2-positif peut être considérablement amélioré par l’immunothérapie ciblée.
- Au stade précoce (adjuvant), le trastuzumab est le traitement standard actuel pendant un an au total.
- En situation palliative, le traitement dirigé contre HER2 doit être poursuivi même après une progression. Outre le trastuzumab et le lapatinib, de nouvelles options thérapeutiques efficaces et bien tolérées sont disponibles avec le T-DM1 et le pertuzumab.
A RETENIR
- Une immunothérapie ciblée peut sensiblement améliorer le pronostic du carcinome mammaire HER2 positif.
- La thérapie standard au stade précoce (adjuvant) repose actuellement sur l’administration de trastuzumab pendant un an.
- En situation palliative, la thérapie anti-HER2 doit être poursuivie, même en cas de progression. Outre le trastuzumab et le lapatinib, le T-DM1 et le pertuzumab offrent de nouvelles options de traitement efficaces et bien tolérées.
Dr. med. Michael Schwitter
Littérature :
- Goldhirsch A, et al : Personalizing the treatment of women with early breast cancer : highlights of the St Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2013. Ann Oncol 2013 Sep ; 24(9) : 2206-23.
- Goldhirsch A, et al : 2 ans versus 1 an de trastuzumab adjuvant pour le cancer du sein HER2-positif (HERA) : un essai contrôlé randomisé en open-label. Lancet 2013 Jul 17. pii : S0140-6736(13)61094-6.
- Pivot X, et al : 6 mois contre 12 mois de trastuzumab adjuvant pour les patients atteints de cancer du sein précoce HER2-positif (PHARE) : un essai randomisé de phase 3. Lancet Oncol 2013 juillet ; 14(8) : 741-8.
- Gianni L, et al : Chimiothérapie néoadjuvante avec trastuzumab suivie de trastuzumab adjuvant versus chimiothérapie néoadjuvante seule, chez des patientes atteintes d’un cancer du sein localement avancé HER2-positif (the NOAH trial) : un essai randomisé contrôlé de supériorité avec une cohorte parallèle HER2-négative. Lancet 2010 Jan 30 ; 375(9712) : 377-84.
- Goss PE, et al : Adjuvant lapatinib pour les femmes atteintes d’un cancer du sein HER2-positif précoce : un essai randomisé, contrôlé, phase 3. Lancet Oncol 2013 Jan ; 14(1) : 88-96.
- Slamon DJ, et al : Use of chemotherapy plus a monoclonal antibody against HER2 for metastatic breast cancer that overexpresses HER2. N Engl J Med 2001 Mar 15 ; 344(11) : 783-92.
- Huober J, et al : Efficacité supérieure du letrozole en association avec le trastuzumab par rapport à la monothérapie par letrozole en tant que traitement de première ligne chez les patients atteints de cancer du sein métastatique HER2-positif avec récepteurs hormonaux positifs – résultats de l’essai eLEcTRA. Breast 2012 ; 21 : 27-33.
- Swain SM, et al : Pertuzumab, trastuzumab, et docetaxel pour le cancer du sein métastatique HER2-positif (étude CLEOPATRA) : résultats de survie globale d’une étude randomisée, en double aveugle, contrôlée par placebo, phase 3. Lancet Oncol 2013 May ; 14(6) : 461-71.
- Wong AL, Lee SC : Mécanismes de résistance au trastuzumab et nouvelles stratégies thérapeutiques dans le cancer du sein HER2-positif. Int J Breast Cancer 2012 ; 2012 : 415170.
- Cardoso F, et al : Cancer du sein localement récurrent ou métastatique : Lignes directrices de pratique clinique de l’ESMO pour le diagnostic, le traitement et le suivi. Ann Oncol 2012 Oct ; 23(7) : vii11-9.
- von Minckwitz G, et al : Trastuzumab beyond progression in human epidermal growth factor receptor 2 positive advanced breast cancer : a German breast group 26/breast in-ternational group 03-05 study. J Clin Oncol 2009 ; 27 : 1999-2006.
- Huober J, et al : Trastuzumab treatment beyond progression in advanced breast cancer : patterns of care in six Swiss breast cancer centers. Oncology 2011 ; 81(3-4) : 160-6.
- Geyer CE, et al : Lapatinib plus capecitabine pour le cancer du sein HER2-positif en phase avancée. N Engl J Med 2006 ; 355 : 2733-2743.
- Verma S, et al : Trastuzumab emtansine for HER2-positive advanced breast cancer. N Engl J Med 2012 Nov 8 ; 367(19) : 1783-91.
- Ismael G, et al : Administration sous-cutanée versus intraveineuse de tras-tuzumab (néo)adjuvant chez les patients atteints de cancer du sein HER2-positif, clinique de stade I-III (étude HannaH) : un essai de phase 3, en ouvert, multicentrique, randomisé. Lancet Oncol 2012 Sep ; 13(9) : 869-78.
InFo Oncologie & Hématologie 2014 ; (2)1 : 5-7











