Le dépistage du cancer du poumon comporte certains risques, tels que des examens complémentaires inutiles ou des opérations en cas de résultats faussement positifs. En conséquence, il doit être réalisé dans des centres où toutes les disciplines nécessaires collaborent. Les données doivent être collectées à des fins de contrôle qualité.
Le cancer du poumon est la principale cause de mortalité liée au cancer dans une grande partie du monde. Selon le rapport mondial sur le cancer de l’OMS pour 2014, 13% de tous les cas de cancer et 19,4% des décès liés au cancer sont dus au cancer du poumon [1].
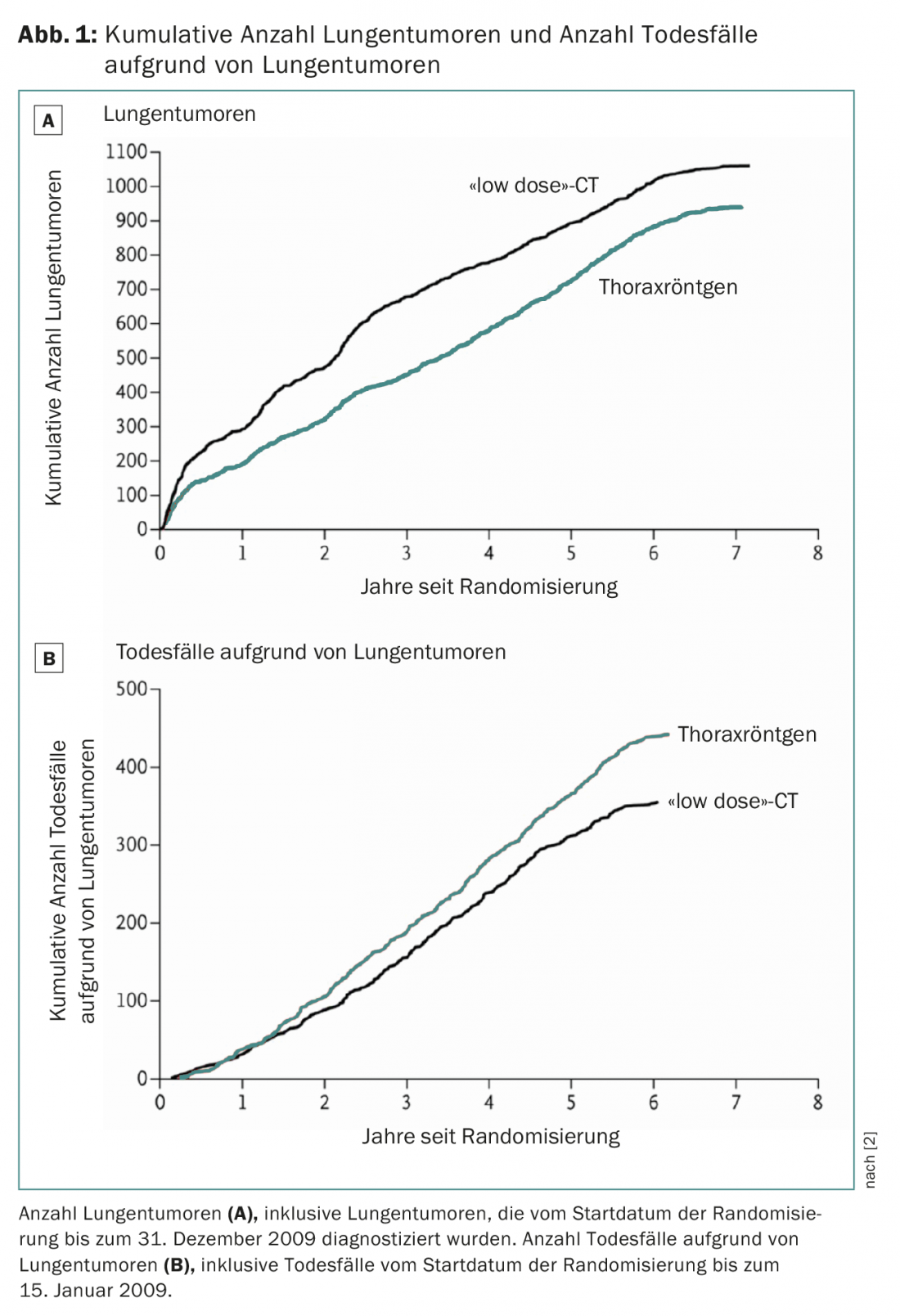
Les résultats de l’étude nationale américaine sur le dépistage du cancer du poumon (NLST) ont montré qu’un scanner à faible dose permettait de réduire la mortalité par cancer du poumon de 20% (figure 1) [2]. Depuis, plusieurs sociétés savantes et organisations de santé ont publié des recommandations pour le dépistage par scanner (American Association for Thoracic Surgery, ATS [3] ; Society of Thoracic Surgeons, STS [4] ; National Comprehensive Cancer Network [5] ; International Association for the Study of Lung Cancer, IASLC [6] ; American Society of Clinical Oncology, ASCO [7] et autres [8–10]. Aux États-Unis, les frais de dépistage sont couverts par les assurances.
En Europe, des recommandations ont été élaborées par l’ERS et l’ESMO, bien que les décisions des organisations nationales de santé soient en suspens et reportées en raison de l’attente des résultats de l’essai hollando-belge NELSON [11].
En Suisse également, un groupe universitaire composé de radiologues, de pneumologues, de chirurgiens thoraciques et d’épidémiologistes s’est formé en 2012 et s’est activement penché sur la question du dépistage systématique des tumeurs pulmonaires en Suisse. En 2014, il a émis des recommandations pour l’introduction du dépistage du cancer du poumon dans le cadre d’un programme complet d’assurance qualité dans des centres médicaux interdisciplinaires certifiés [12]. Une demande de prise en charge par l’assurance obligatoire des soins a été déposée en 2014 dans le but de prévenir un dépistage opportuniste et de mettre en place un dépistage systématique en Suisse avec des directives claires et un registre central. Cette demande a été rejetée par l’OFSP en raison de l’absence de données du trial NELSON.
Fin 2017, un groupe mené par d’éminents spécialistes de toutes les disciplines concernées en Europe a publié une déclaration faisant le point sur le dépistage du cancer du poumon et les éléments essentiels nécessaires à l’élaboration de programmes de dépistage européens efficaces [13]. Le présent avis de l’UE se concentre sur la mise en œuvre effective de programmes de dépistage du cancer du poumon par scanner en Europe par des radiologues assistés par des épidémiologistes, des pneumologues et des chirurgiens thoraciques dans le contexte du diagnostic clinique et du traitement du cancer du poumon. L’objectif de toutes les recommandations est de minimiser le nombre de faux positifs, pour les nodules détectés par le dépistage, mais aussi pour les nodules non détectés par le dépistage. La nécessité d’un scanner à faible dose dans l’intervalle ne doit pas être considérée comme un test faussement positif, car le patient ne subit pas d’examen clinique invasif et le risque de dommage physique est donc très faible.
Résultats des études européennes sur le dépistage du cancer du poumon
Plusieurs études randomisées financées au niveau national ont déjà été menées en Europe afin de vérifier la faisabilité du dépistage du cancer du poumon. Dans ce domaine, l’étude NELSON, dont les résultats sont encore attendus, est le seul essai contrôlé randomisé en Europe qui fournira des données sur la mortalité et le rapport coût-efficacité.
Modèles de prédiction du risque de cancer du poumon
Le concept de définir clairement la population cible appropriée pour le dépistage du cancer du poumon est d’une importance capitale [14]. La sélection basée uniquement sur l’âge – comme pour la plupart des autres dépistages du cancer (par exemple du sein et du côlon) – n’est pas suffisante pour le cancer du poumon, car les facteurs de risque (en particulier l’abus de nicotine) jouent un rôle important. Les autres facteurs de risque à prendre en compte sont les maladies respiratoires (BPCO, emphysème, bronchite, pneumonie et tuberculose), les antécédents de tumeur, les antécédents familiaux de cancer du poumon et l’exposition à l’amiante. Plusieurs modèles de prédiction du risque ont été publiés après avoir été testés dans l’ensemble de données NLST et partiellement validés, mais jusqu’à présent, seuls deux modèles de sélection des patients ont été utilisés dans des essais cliniques : le “Modified Liverpool Lung Project” (LLPv2) et le “Prostate, Lung, Colorectal and Ovarian Cancer Screening Trial” (PLCO) modèle [15,16]. Il est apparu que les critères de sélection NLST pourraient être améliorés si des modèles de prédiction des risques étaient mis en œuvre [17]. De plus, une augmentation du rapport coût-efficacité a été observée dans les groupes à haut risque, ce qui signifie que la prédiction des risques peut également réduire le coût par vie sauvée [18].
Dommages, avantages et conditions
Les établissements participant à des programmes de dépistage ont besoin d’équipes multidisciplinaires offrant toutes les spécialités pertinentes (pneumologie, chirurgie thoracique, radiologie) et dans lesquelles les résultats du dépistage peuvent être discutés de manière interdisciplinaire. Ces établissements devraient régulièrement démontrer qu’ils respectent des normes de base [12,13].
Les risques associés au dépistage du cancer du poumon, tels que le surdiagnostic, l’opération de lésions bénignes, le stress psychologique et les dommages causés par les radiations, doivent être acceptés avant l’introduction du dépistage et peuvent être réduits par des critères d’inclusion adaptés et un niveau élevé d’expertise clinique. Le dépistage du cancer du poumon ne devrait donc être effectué que selon un protocole obligatoire et dans des unités et des centres de dépistage capables de garantir un contrôle de qualité rigoureux et de proposer tous les experts nécessaires ainsi qu’un programme de sevrage tabagique. Des comités nationaux d’assurance qualité garantissent le respect des normes techniques minimales et une standardisation des critères diagnostiques pour les foyers pulmonaires détectés lors du dépistage (à l’instar des programmes européens de dépistage du cancer du sein). Le risque d’irradiation est probablement surestimé et diminuera à l’avenir avec l’introduction des dernières plates-formes de tomodensitométrie utilisant la technologie de tomodensitométrie “à ultra faible dose”.
Le nombre de résections bénignes ne devrait pas dépasser 10% [13]. L’inclusion de chirurgiens thoraciques certifiés dans un tel programme de dépistage est essentielle pour maintenir le risque de résection inutile [4] et le risque périopératoire aussi bas que possible. La Société européenne de chirurgie thoracique (ESTS) a publié des directives claires à ce sujet [19], y compris des conditions préalables sur la manière dont une telle clinique doit être structurée et conçue [20].
Algorithme pour les nœuds détectés
Dans l’étude NLST, un résultat de scanner était considéré comme positif s’il montrait un nodule non calcifié d’un diamètre d’au moins 4 mm. Une méthode alternative consiste à déterminer le volume du cœur pulmonaire [21]. Le groupe d’experts européens recommande, pour la gestion future des foyers solides, d’utiliser le temps de doublement du volume et du volume dérivé semi-automatiquement plutôt que le diamètre (Fig. 2) [13].
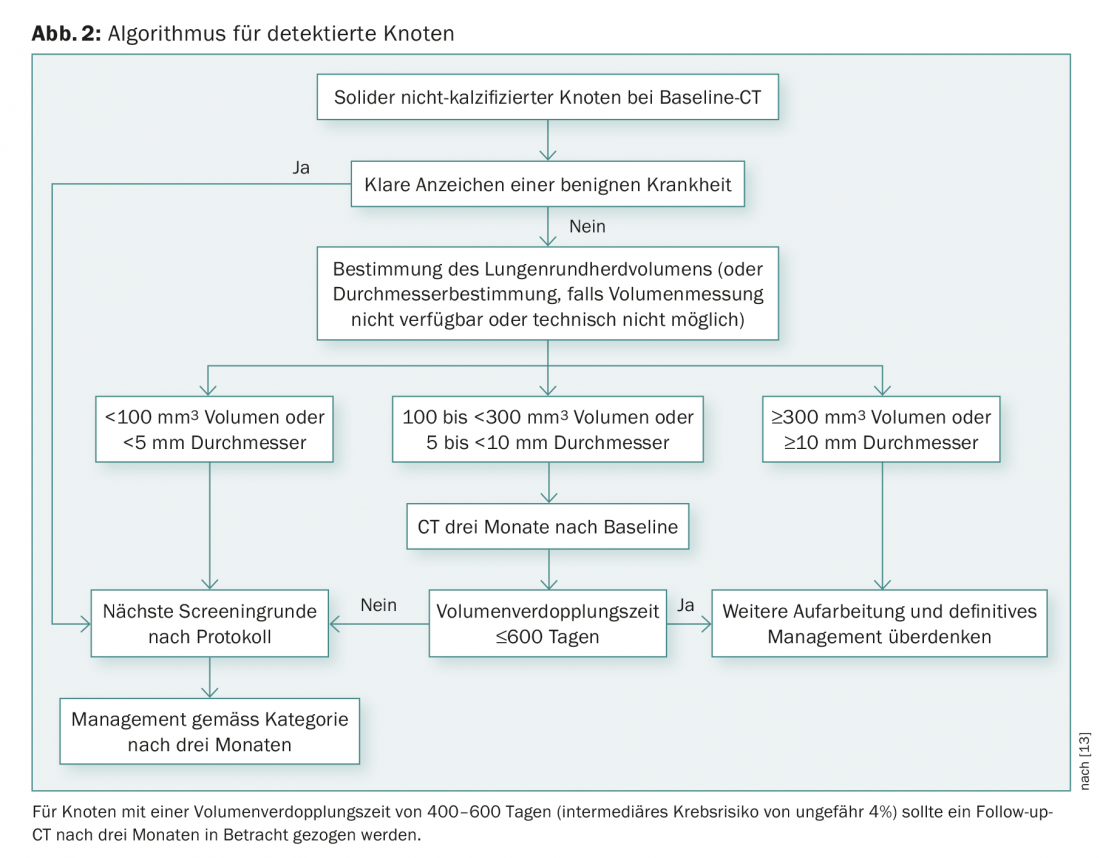
Sur la base des données actuelles, les nodules solides d’un volume inférieur à 100 mm3 doivent faire l’objet d’un examen annuel ; les nodules d’un volume compris entre 100 et 300 mm3 doivent faire l’objet d’un retour du patient au scanner après trois mois ; pour les volumes supérieurs à 300 mm3, le patient doit être adressé à une équipe multidisciplinaire [22].
Intervalles optimaux de dépistage du cancer du poumon
L’US Preventive Services Task Force (USPSTF) sur le dépistage par scanner a recommandé un dépistage annuel entre 55 et 80 ans. Dans une publication NELSON, un intervalle de dépistage de deux ans et demi a entraîné une augmentation significative des cancers d’intervalle au quatrième tour de dépistage, ce qui a fourni un argument contre l’utilisation d’intervalles aussi longs. Une analyse détaillée du rapport coût-efficacité de différents scénarios de dépistage a montré que, pour presque toutes les approches, le rapport coût-efficacité augmentait lorsque le dépistage était effectué chaque année.
La moitié des participants à l’étude NELSON n’ont pas eu de foyer pulmonaire détecté et la probabilité à 2 ans de développer un cancer du poumon était de 0,4%, ce qui suggère que, dans le cadre de programmes de dépistage similaires, un intervalle de dépistage allant jusqu’à 2 ans pourrait être envisagé dans une approche stratifiée en fonction des risques pour des groupes à risque analogues [23].
Dépistage systématique en Suisse
Il convient tout d’abord de rappeler qu’à l’heure actuelle, un tel dépistage chez les fumeurs asymptomatiques à haut risque ne figure pas dans le catalogue des prestations de l’AOS. Les coûts devraient donc être supportés par le patient. La situation est différente si des symptômes suspects tels qu’une toux sèche persistante, des expectorations sanguinolentes ou des difficultés respiratoires sont signalés et doivent faire l’objet d’un examen plus approfondi. À l’Hôpital universitaire de Zurich, nous proposons des dépistages du cancer du poumon dans le cadre d’un algorithme structuré pour les patients qui recherchent un conseil primaire ou un deuxième avis à ce sujet. Les données seront à l’avenir recueillies de manière prospective dans un registre et des projets de recherche sont prévus.
Sur la base des résultats des activités de dépistage du cancer du poumon achevées et en cours, les conditions suivantes sont nécessaires à l’évaluation d’un dépistage systématique du cancer du poumon au sein d’études d’observation :
- Centres médicaux accrédités disposant d’un savoir-faire pluridisciplinaire et d’un accès à des spécialistes formés (au minimum) en radiologie, pneumologie, oncologie, pathologie et chirurgie thoracique.
- Intégration d’un programme de sevrage tabagique établi
- Programme de dépistage complet couvrant toute la période d’inclusion, de suivi et de réadmission potentielle.
- Critères d’inclusion : Âge compris entre 55 et 74 ans, au moins 30 paquets-années et arrêt du tabac depuis moins de 15 ans si ancien fumeur.
- Procédure standardisée pour informer et conseiller les personnes intéressées de manière objective et indépendante sur l’opportunité de réaliser le dépistage avec toutes ses conséquences possibles (soutenue par des modèles d’évaluation des risques individuels).
- Procédures de travail standardisées pour l’acquisition d’images, l’évaluation volumétrique du foyer pulmonaire, les résultats de dépistage positifs et leur gestion, ainsi que la surveillance des faux positifs et des complications iatrogènes.
- Collecte et transmission des données de dépistage du cancer du poumon à un registre national de dépistage des tumeurs pulmonaires
- Vérification régulière de la qualité.
Messages Take-Home
- Le dépistage du cancer du poumon par TDM “à faible dose” réduit la mortalité par cancer du poumon de 20% dans une population à risque.
- Le dépistage du cancer du poumon comporte également des risques tels que des examens complémentaires inutiles et des opérations inutiles en cas de faux positifs.
- En conséquence, le dépistage du cancer du poumon doit être effectué dans des centres où toutes les disciplines nécessaires (radiologues, pneumologues, chirurgiens thoraciques) sont impliquées dans la discussion des résultats et qui disposent d’une saisie des données pour le contrôle de qualité.
- Les critères d’inclusion doivent être basés sur des données scientifiques.
Littérature :
- OMS : Rapport mondial sur le cancer. 2014.
- Aberle DR, et al : Réduction de la mortalité par cancer du poumon grâce au dépistage tomodensitométrique à faible dose. The New England journal of medicine 2011 ; 365(5) : 395-409.
- Jaklitsch MT, et al : The American Association for Thoracic Surgery guidelines for lung cancer screening using low-dose computed tomography scans for lung cancer survivors and other high-risk groups. J Thorac Cardiovasc Surg 2012 ; 144(1) : 33-38.
- Rocco G, et al : Déclaration clinique sur le rôle du chirurgien et les questions chirurgicales relatives aux programmes de dépistage du cancer du poumon par tomodensitométrie. Ann Thorac Surg 2013 ; 96(1) : 357-360.
- Wood DE : National Comprehensive Cancer Network (NCCN) Clinical Practice Guidelines for Lung Cancer Screening. Thorac Surg Clin 2015 ; 25(2) : 185-197.
- Field JK, et al : International Association for the Study of Lung Cancer Computed Tomography Screening Workshop 2011 report. J Thorac Oncol 2012 ; 7(1) : 10-19.
- Bach PB, et al : Benefits and harms of CT screening for lung cancer : a systematic review. JAMA 2012 ; 307(22) : 2418-2429.
- American Lung Association : Providing Guidance on Lung Cancer Screening to Patients and Physicians. www.lung.org
- Wender R, et al : American Cancer Society lung cancer screening guidelines. CA Cancer J Clin 2013 ; 63(2) : 107-117.
- Mulshine JL, D’Amico TA : Issues with implementing a high-quality lung cancer screening program. CA Cancer J Clin 2014 ; 64(5) : 352-363.
- van Klaveren RJ, et al. : Prise en charge des nodules pulmonaires détectés par tomodensitométrie volumétrique. The New England journal of medicine 2009 ; 361(23) : 2221-2229.
- Frauenfelder T, et al : Early detection of lung cancer : a statement from an expert panel of the Swiss university hospitals on lung cancer screening. Respiration ; international review of thoracic diseases 2014 ; 87(3) : 254-264.
- Oudkerk M, et al : Déclaration de position européenne sur le dépistage du cancer du poumon. The Lancet Oncology 2017 ; 18(12) : e754-e766.
- Tammemagi MC, et al. : Participant selection for lung cancer screening by risk modelling (the Pan-Canadian Early Detection of Lung Cancer [PanCan] study) : a single-arm, prospective study. The Lancet Oncology 2017 ; 18(11) : 1523-1531.
- Cassidy A, et al : The LLP risk model : an individual risk prediction model for lung cancer. British journal of cancer 2008 ; 98(2) : 270-276.
- Tammemagi MC, Mayo JR, Lam S : Cancer dans les nodules pulmonaires détectés sur un premier scanner de dépistage. The New England journal of medicine 2013 ; 369(21) : 2060-2061.
- Katki HA, et al. : Développement et validation de modèles de risque pour sélectionner les fumeurs invétérés pour le dépistage du cancer du poumon par scanner. Jama 2016 ; 315(21) : 2300-2311.
- Tammemagi MC, et al : Selection criteria for lung-cancer screening. The New England journal of medicine 2013 ; 368(8) : 728-736.
- Pedersen JH, et al : Recommandations de la Société européenne des chirurgiens thoraciques (ESTS) concernant le dépistage par tomodensitométrie du cancer du poumon en Europe. European journal of cardio-thoracic surgery : journal officiel de l’Association européenne de chirurgie cardio-thoracique 2017 ; 51(3) : 411-420.
- Brunelli A, et al : European guidelines on structure and qualification of general thoracic surgery. European journal of cardio-thoracic surgery : official journal of the European Association for Cardio-thoracic Surgery 2014 ; 45(5) : 779-786.
- Henschke CI, et al : Early Lung Cancer Action Project : overall design and findings from baseline screening. Lancet (Londres, Angleterre) 1999 ; 354(9173) : 99-105.
- Horeweg N, et al : Probabilité de cancer du poumon chez les patients présentant des nodules pulmonaires détectés par scanner : une analyse prédictive des données du test NELSON de dépistage par scanner à faible dose. The Lancet Oncology 2014 ; 15(12) : 1332-1341.
- Pastorino U, et al : Annual or biennial CT screening versus observation in heavy smokers : 5-year results of the MILD trial. European journal of cancer prevention : the official journal of the European Cancer Prevention Organisation 2012 ; 21(3) : 308-315.
InFo ONKOLOGIE & HÉMATOLOGIE 2018 ; 6(2) : 14-17











