Dans le cadre des Medidays, la semaine de formation continue en médecine interne de l’Hôpital universitaire de Zurich (USZ), un après-midi a également été consacré à différents thèmes oncologiques. Dans le cas du myélome multiple et du lymphome diffus à grandes cellules B, de nouvelles substances actives et modalités thérapeutiques ont été développées ces dernières années, ce qui a permis d’améliorer de manière réjouissante le pronostic des patients. Le bilan est moins positif en ce qui concerne le dépistage du cancer : beaucoup d’efforts ne signifient pas automatiquement beaucoup de succès.
(ee) Le professeur Bernhard Pestalozzi, médecin-chef de la clinique d’oncologie de l’USZ, a présenté les aspects contradictoires des mesures de dépistage du cancer.
Il a commencé par une étude de cas : vous recevez un appel d’un bon ami qui vous dit avec excitation qu’un résultat suspect est apparu sur la mammographie de dépistage de sa femme. Quel est donc le risque que cette découverte fortuite corresponde effectivement à un cancer du sein invasif ?
Réduction relative et absolue du risque de dépistage du cancer du sein
Les avis de l’auditoire étaient très partagés : certains pensaient que la probabilité était de 90%, d’autres estimaient qu’elle était de 1%.
En réalité, le risque est d’environ 10% : Sur 1000 femmes qui se soumettent à une mammographie de dépistage tous les deux ans pendant dix ans, environ 200 doivent faire examiner un résultat anormal, ce qui entraîne des contraintes physiques et psychologiques. Environ 24 d’entre elles sont finalement diagnostiquées avec un cancer du sein.
Toutefois, le cancer du sein n’est pas non plus détecté chez quatre à sept femmes ; une mammographie négative ne signifie donc pas que l’on est sûr à 100 % de l’absence de cancer du sein. Dans un groupe de 1000 femmes non dépistées, cinq meurent finalement d’un cancer du sein, dans un groupe de 1000 femmes dépistées, il y en a toujours quatre.
Le dépistage réduit donc le risque relatif de décès par cancer du sein de 20%, mais la réduction absolue du risque n’est que de 0,1% (seule une femme dépistée sur 1000 bénéficie réellement de la réduction du risque). Les chiffres présentés ici peuvent être consultés sur la fiche d’information de la Ligue suisse contre le cancer, qui est favorable au dépistage (https://assets.krebsliga.ch/downloads/1451.pdf).
Ces “mauvais” chiffres du dépistage par mammographie s’améliorent chez les femmes présentant un risque de cancer du sein supérieur à la moyenne et grâce à l’utilisation de meilleures techniques de dépistage. Ainsi, la mammographie 3D détecte 30% de cancers en plus et le taux de rappel est inférieur de 30%. L’IRM mammaire, recommandée pour les patientes porteuses de mutations BRCA, présente également une sensibilité plus élevée (mais une spécificité encore plus faible).
Dosage du PSA et dépistage du cancer colorectal : quels sont les avantages ?
En ce qui concerne le dépistage du cancer de la prostate, le bilan n’est pas meilleur. Sur 1000 hommes qui subissent un dépistage du PSA tous les un à quatre ans pendant dix ans, 100 à 120 obtiennent un résultat faussement positif, c’est-à-dire qu’ils sont dépistés par biopsie et n’ont pas de cancer de la prostate, mais les éventuels effets secondaires de la biopsie tels que la douleur et l’anxiété. Chez 110 autres, un cancer de la prostate est effectivement diagnostiqué et probablement traité par la suite dans la majorité des cas, avec les effets secondaires possibles sur la continence urinaire et la fonction sexuelle. Mais au total, le dépistage de 1000 hommes permet d’éviter au maximum un décès dû au cancer de la prostate. Un dépistage généralisé du PSA n’est donc pas recommandé par la task force américaine. La Société suisse d’urologie recommande le dosage du PSA uniquement aux patients ayant des antécédents familiaux de cancer de la prostate (à partir de 45 ans) et si un homme informé en fait la demande (entre 50 et 70 ans).
La situation est plus favorable pour le dépistage du cancer du côlon, qui est remboursé par l’assurance de base depuis juin 2013. Sont remboursés un test de recherche de selles tous les deux ans et/ou une coloscopie tous les dix ans (pour les personnes âgées de 50 à 69 ans). Tant pour le test de recherche de sang dans les selles que pour la sigmoïdoscopie/coloscopie, il existe de bonnes preuves que cela réduit l’incidence et la mortalité du cancer colorectal. En ce qui concerne la réduction de la mortalité due au dépistage par coloscopie, il faut extrapoler à partir des études randomisées de la sigmoïdoscopie. Pour éviter un décès par cancer colorectal, 300 à 600 coloscopies de dépistage sont nécessaires.
Mise à jour sur le lymphome diffus à grandes cellules B
Le Dr Panagiotis Samaras, médecin-chef de la clinique d’oncologie de l’USZ, a donné un aperçu de deux maladies hématologiques courantes : le lymphome diffus à grandes cellules B (DLBCL) et le myélome multiple (MM). Le DLBCL est le lymphome le plus fréquent. Le pronostic et le traitement dépendent fortement du nombre de facteurs de risque évalués par l’International Prognostic Index (IPI) (tableau 1). Les patients âgés de 18 à 60 ans avec un IPI <2 sont considérés comme jeunes et à faible risque. Leur taux de survie est supérieur à 90%. Chez les patients de moins de 60 ans avec un IPI ≥2, considérés comme des patients à haut risque, les taux de survie sont d’environ 50%. Les patients sont traités selon le schéma R-CHOP (tableau 2), avec un nombre de cycles variable selon l’âge du patient et les facteurs de risque (6 à 8 cycles sont la norme) et éventuellement avec l’ajout d’étoposide.
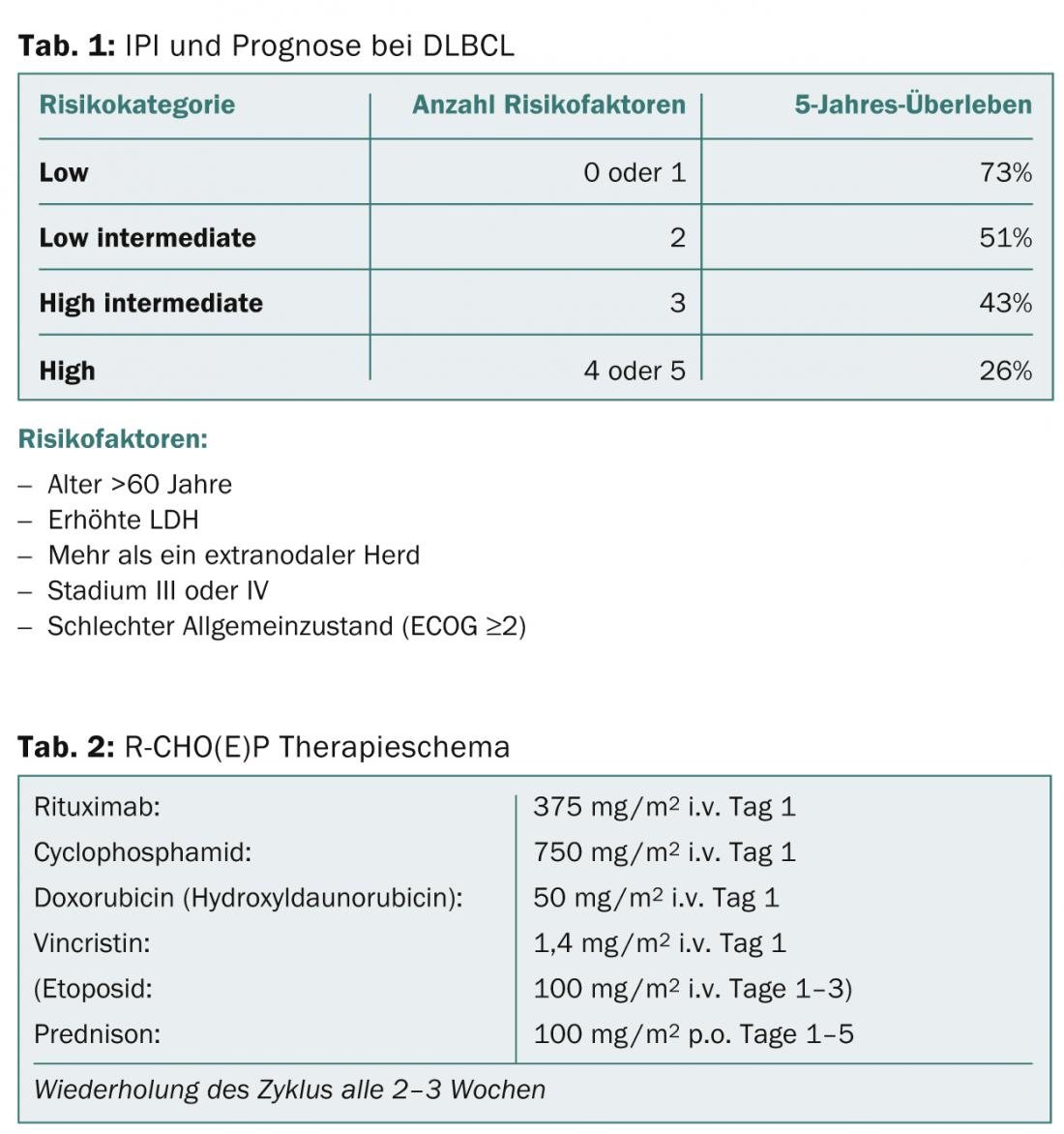
Pendant la chimiothérapie, un contrôle clinique et un contrôle de l’hémogramme sont effectués chaque semaine. Dans le cadre d’un schéma thérapeutique de 14 jours, les patients reçoivent des antibiotiques pour contrôler l’infection et du G-CSF pour réduire la durée de la neutropénie. En cas d’effets indésirables (tableau 3), d ‘incertitudes ou de complications, les patients ou les professionnels de la santé doivent être informés de la situation. le médecin généraliste peut prendre contact avec l’oncologue à bas seuil, même la nuit ou le week-end. Si une récidive du DLBCL se produit, la prochaine option est une autogreffe de cellules souches après une chimiothérapie à haute dose.
Myélome multiple – nouvelles options thérapeutiques
Le myélome multiple (MM) est la deuxième néoplasie la plus fréquente en hématologie. Les hommes sont légèrement plus touchés que les femmes (rapport 1,4:1). Le MM est aujourd’hui une maladie non curable, mais des traitements appropriés permettent de réduire les symptômes et de stopper la progression de la maladie. En cas de MM asymptomatique (MM “smoldering”), aucun traitement actif n’est administré, mais le patient est surveillé (“watch and wait”). En cas de MM symptomatique, un traitement est indiqué (tableau 4).

Les symptômes les plus fréquents sont l’anémie (73%), les lésions osseuses (66%), les douleurs osseuses (58%), l’insuffisance rénale (19%) et l’hypercalcémie (11%). Des protéines monoclonales peuvent être détectées chez 97% des patients.
On distingue trois objectifs dans le traitement : Traitement aigu pour prévenir les lésions potentiellement mortelles (par exemple, plasmaphérèse en cas de syndrome d’hyperviscosité ou dialyse en cas d’insuffisance rénale), soulagement des symptômes et amélioration de la qualité de vie (par exemple, radiothérapie en cas de fractures instables, bisphosphonates, analgésie) et réduction des symptômes et arrêt de la progression (chimiothérapie, transplantation de cellules souches). Ces dernières années, le bortézomib (Velcade®) et le lénalidomide (Revlimid®) ont considérablement amélioré le pronostic des patients atteints de MM. Chez les jeunes patients de moins de 70 ans, il est possible de réaliser une greffe de cellules souches après un traitement d’induction par bortézomib ou lénalidomide, suivi d’une chimiothérapie à haute dose. Deux cycles supplémentaires du traitement initial sont ensuite administrés et, chez les patients présentant un profil à haut risque, un traitement d’entretien est administré pendant plus d’un an. Chez les patients âgés, une chimiothérapie contenant du bortézomib ou du lénalidomide est administrée pendant au moins 12 à 18 mois – l’efficacité dépend de la durée du traitement.
Source : Medidays, Update Onkologie, 3 septembre 2014, Zurich
InFo ONKOLOGIE & HÄMATOLOGIE 2014 ; 2(8) : 32-34