Une consultation interdisciplinaire rapide lors du diagnostic d’une tumeur maligne est impérative et permet aux personnes concernées de prendre une “décision informée”. La protection de la fertilité ne doit pas aggraver le pronostic. L’omission d’une information peut avoir des conséquences en matière de responsabilité civile. En cas d’affections bénignes hématologiques, rhumatologiques ou gynécologiques, il faut penser à réduire la réserve ovarienne. Même en cas de risque moyen ou faible de dommages aux ovaires, il faut s’attendre à un raccourcissement de la phase de vie fertile pouvant aller jusqu’à dix ans. Après un traitement gonadotoxique dans l’enfance, la réserve de fertilité doit être vérifiée chez la jeune femme. La cryoconservation d’ovocytes à ce stade peut permettre de satisfaire ultérieurement le désir d’enfant.
Selon le registre allemand du cancer, 1 800 enfants <15 ans et 30 000 adultes âgés de 16 à 45 ans sont atteints de cancer chaque année en Allemagne, contre environ 250 enfants par an en Suisse. Avec un taux de survie de 80% pour les enfants et de 50% pour tous les groupes d’âge, cela représente chaque année des milliers de survivants de moins de 45 ans. Si nous ajoutons les maladies bénignes avec traitement gonadotoxique, le nombre total de personnes concernées dont la fertilité est réduite en raison d’une maladie et du traitement correspondant est bien plus élevé. Il existe désormais des preuves que la grossesse après un cancer n’aggrave pas le pronostic, même pour les tumeurs hormonodépendantes comme le cancer du sein. La protection de la fertilité n’est donc pas un sujet exotique, mais concerne les oncologues, les gynécologues et les médecins généralistes [1]. L’accent est mis sur la consultation interdisciplinaire en temps réel avec des spécialistes de la médecine de la reproduction, afin de permettre aux personnes concernées de prendre une “décision éclairée”, même dans une situation exceptionnelle où leur vie est en danger. Pour des raisons de place, je me limiterai dans ce travail à la protection de la fertilité chez les femmes.
Atteinte à la réserve ovarienne
La chirurgie, la chimiothérapie et la radiothérapie sont les piliers du traitement du cancer. Les dommages directs causés par la tumeur elle-même ou par des interventions chirurgicales concernent les tumeurs malignes du petit bassin, c’est-à-dire les cancers du côlon, de l’ovaire, de l’utérus et du col de l’utérus.
L’effet gonadotoxique d’une chimiothérapie dépend de la substance, de la dose et de la durée du traitement ainsi que de l’âge de la patiente et de la réserve ovarienne (tab. 1) [2]. Il faut s’attendre à un risque accru d’avortement ou de malformation au cours des six premiers mois après la fin de la chimiothérapie. Contrairement à la chimiothérapie, la radiothérapie concerne les ovaires et l’utérus [3].

90% des patientes ayant subi une irradiation corporelle totale avant une greffe de cellules souches présentent une insuffisance ovarienne, et près de 100% après une irradiation directe du petit bassin. Les séquelles de la radiothérapie infantile sur l’utérus sont la fibrose du myomètre et l’atrophie de l’endomètre, avec un risque accru d’avortement et d’accouchement prématuré. La transposition des ovaires en dehors du champ d’irradiation n’est pas sans poser de problèmes.
La méthode de préservation de la fertilité qui peut être proposée dépend de du diagnostic oncologique et de la fenêtre temporelle jusqu’au début prévu du traitement (tab. 2). La technique de vitrification des ovocytes a considérablement amélioré les chances de succès. Parallèlement, la cryoconservation de tissu ovarien avec retransplantation est sortie du stade expérimental. Pour les deux options, il faut garder à l’esprit que les patientes atteintes d’une tumeur présentent souvent un risque plus élevé de thromboembolie, d’hémorragie ou d’infection. Des précautions appropriées doivent être prises.

Cryoconservation d’ovocytes ou de zygotes
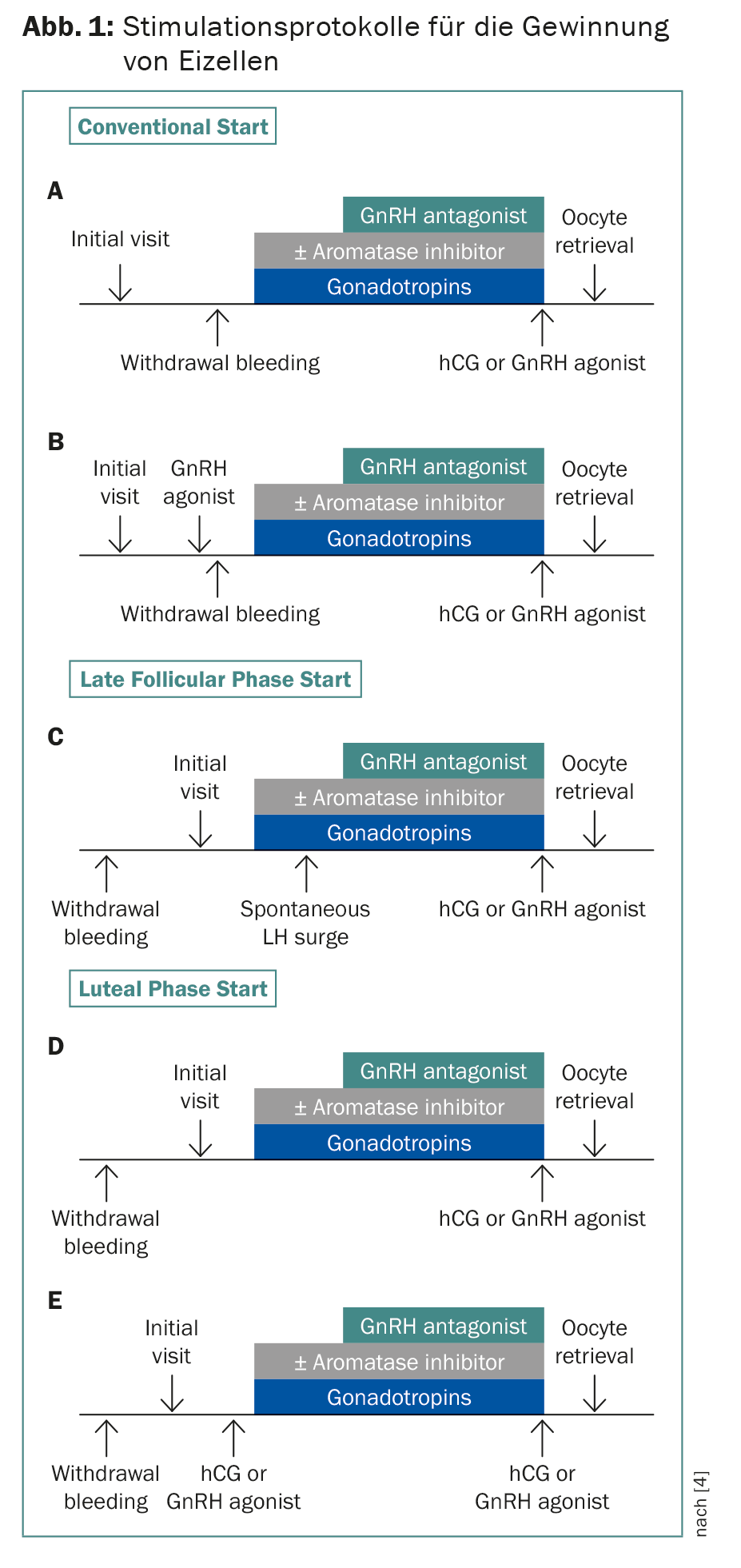
La cryoconservation de zygotes et d’embryons est établie depuis des années. Grâce à la technique de vitrification, plus de 90% des ovocytes survivent désormais. Comme le temps est généralement compté, des protocoles de stimulation ont été développés, qui démarrent indépendamment du début des règles, avec un délai de deux à trois semaines pour la chimiothérapie (fig. 1). Il est également possible d’effectuer des stimulations doubles, en commençant par la phase folliculaire et la phase lutéale. Cela permet d’obtenir deux fois plus d’ovules en quatre semaines. Ceci est important car chez les patientes de moins de 36 ans, environ 12 à 14 ovules sont nécessaires pour la future naissance d’un enfant, et plus du double chez les patientes de 37 à 39 ans [4]. L’association avec le létrozole diminue le taux d’œstrogènes, ce qui est important pour les tumeurs hormonodépendantes et pour éviter le syndrome d’hyperstimulation [5]. En principe, je conseille plutôt – même dans une relation de couple – la cryoconservation d’ovocytes plutôt que de zygotes, afin que la femme conserve son autonomie reproductive.
Cryoconservation de tissu ovarien
Dès 2004, Donnez a publié un article sur une naissance après une transplantation orthotopique de tissu ovarien [6]. Entre-temps, la méthode a quitté le stade expérimental. Par laparoscopie, près de la moitié d’un ovaire est retirée et cryoconservée. Une analyse rétrospective du réseau FertiPROTEKT a recensé 21 grossesses après 95 transplantations dans l’ovaire restant ou dans une poche péritonéale du petit bassin [7]. En 2011, le premier bébé suisse est né après une retransplantation de tissu ovarien par l’équipe du Kinderwunschzentrum Baden. Pour la cryoconservation de tissu ovarien, un certain nombre de conditions doivent être remplies (tableau 3).

Les analogues de la GnRh en tant que traitement adjuvant fertiprotecteur
Le développement de médicaments ovoprotecteurs est un objectif prioritaire afin de préserver la fertilité naturelle des patientes après un traitement cytotoxique. Plusieurs substances sont en cours d’évaluation, mais jusqu’à présent, seuls les analogues de la GnRh se sont imposés. Les mécanismes de protection postulés sont la suppression des gonadotrophines à des niveaux prépubertaires et une diminution de la perfusion utéro-ovarienne. Une grande étude prospective randomisée a montré que le risque d’insuffisance ovarienne prémature pouvait être réduit de 50% [8]. Les craintes que le traitement par analogues de la GnRh puisse réduire l’efficacité de la chimiothérapie ont été dissipées. Cette thérapie peut donc être généreusement recommandée, même en combinaison avec d’autres méthodes.
Protection de la fertilité avant la ménarche
Aujourd’hui, en Suisse, plus de 80% des enfants atteints de cancer survivent. Deux sur trois souffrent de séquelles, notamment de stérilité. Bien sûr, l’idée d’avoir un enfant plus tard est lointaine pour une fillette de dix ans au moment du diagnostic de cancer ; il s’agit de survivre. C’est précisément pour cette raison que la consultation interdisciplinaire des parents et – dans la mesure du possible – des enfants concernés est indispensable, afin de ne manquer aucune décision importante pour “la vie après”. Euphorique, la première retransplantation réussie après freezing de l’ovaire chez l’enfant a été publiée récemment [9]. La cryoconservation de tissus ovariens est la seule possibilité de protection de la fertilité chez les filles et les très jeunes femmes, associée à une intervention chirurgicale avec des complications rares telles que des infections et des hémorragies.
Seules 8% des filles atteintes de cancer présentent un risque élevé d’insuffisance ovarienne post-thérapeutique et bénéficient donc de la cryoconservation de tissu ovarien. Mais même en cas de risque faible ou moyen, il faut s’attendre à une période fertile raccourcie jusqu’à dix ans. C’est d’autant plus important que le fait d’avoir des enfants est de plus en plus souvent repoussé au 4e décan. En Suisse, l’âge moyen de la femme à la naissance de son premier enfant est de 31 ans, et la tendance est à la hausse. En conséquence, toutes les jeunes adultes survivantes doivent être conseillées sur leur réserve ovarienne. L’hormone antimüllérienne et le nombre de follicules antraux sont déterminés. Cela est également possible sous contraception orale, les valeurs sont alors inférieures d’environ 20%. Un cycle spontané normal ne dit pas grand-chose sur une phase de vie fertile raccourcie. La cryoconservation des ovocytes au début de la vingtaine pourrait laisser à la jeune femme l’option de reporter son désir d’enfant au moment souhaité – après la formation ou les études.
Protection de la fertilité chez les patientes non oncologiques
La protection de la fertilité est désormais bien établie chez les patientes oncologiques. La situation est différente pour les maladies bénignes traitées par des substances gonadotoxiques (tableau 4). Il est également important de noter que les maladies auto-immunes telles que le lupus érythémateux peuvent en soi s’accompagner d’une réduction de la réserve ovarienne [10]. Contrairement à la situation aiguë lors du diagnostic d’une tumeur maligne, il reste généralement suffisamment de temps chez ces patientes pour un conseil différencié et la cryoconservation d’un nombre suffisant d’ovocytes ou de zygotes avant le début du traitement.

Que nous réserve l’avenir ?
Des sujets tels que la chirurgie conservatrice des organes pour les cancers épithéliaux de l’ovaire au stade précoce, les tumeurs séreuses borderline de l’ovaire ou les tumeurs ovariennes des cellules souches, le traitement par progestatif local et systémique au stade précoce du cancer de l’endomètre ou même la transplantation utérine après un cancer du col de l’utérus sont en cours de discussion et ont déjà été testés dans certains cas. La maturation in vitro (MIV) de gamètes immatures est encore expérimentale [11]. De très nombreuses questions restent actuellement en suspens et doivent être résolues par des études afin de pouvoir offrir aux patientes une approche adéquate et sûre.
Aspects juridiques de la protection de la fertilité
La loi fédérale sur la procréation médicalement assistée autorise expressément la conservation illimitée des gamètes en cas de traitement gonadotoxique. Dans le cas de tumeurs malignes, la plupart des personnes concernées sont informées des méthodes de préservation de la fertilité, alors que dans le cas de processus bénins, elles sont rarement informées avant un traitement cytotoxique. Des procès en responsabilité civile ont déjà été gagnés en cas d’omission de conseils (ou de conseils non documentés) concernant la cryoconservation de sperme. Les coûts de la protection de la fertilité ne sont malheureusement pas pris en charge par les caisses d’assurance maladie.
L’entretien de conseil
Une évaluation interdisciplinaire rapide entre les oncologues et les spécialistes de la fertilité permet de conseiller les personnes concernées de manière différenciée [12]. Il s’agit de questions telles que le type et le stade de la tumeur, le traitement prévu avec la fenêtre temporelle avant le début, le risque d’infertilité après le traitement oncologique, l’état général de la patiente, mais aussi la résistance psychologique, la situation familiale et l’environnement social. Le traitement d’assistance médicale à la procréation ne doit en aucun cas mettre en péril le pronostic de la patiente. Nous menons l’entretien avec la patiente, éventuellement avec son partenaire ou ses parents, en suivant une liste de contrôle (tab. 5).

L’examen clinique comprend l’échographie de l’utérus et des ovaires (pathologie du petit bassin, taille de l’utérus et des ovaires et nombre de follicules antraux). L’hormone antimüllérienne est actuellement considérée comme le paramètre pronostique le plus important concernant la réserve ovarienne.
Outre les détails techniques d’une éventuelle thérapie, l’accent est mis sur les aspects émotionnels de l’entretien de conseil [12]. La patiente et tout son entourage sont sous le choc d’un diagnostic menaçant. Des termes tels que danger de mort, peur de la mort, perte, douleur, souffrance, tristesse et colère sont présents. En parlant de la préservation de la fertilité, du désir d’enfant ultérieur, nous pouvons apporter un contrepoint. Nous voulons donner de l’espace à l’espoir, à la joie et au sens de la vie, aux pensées sur la vie après le cancer.
Littérature :
- von Wolff M, et al : Fertility-preservation counselling and treatment for medical reasons : data from a multinational network of over 5000 women. Reprod Biomed Online 2015 Nov ; 31(5) : 605-612.
- Meirow D, et al : Toxicité de la chimiothérapie et de la radiothérapie sur la reproduction féminine. Clin Obstet Gynecol 2010 ; 53 : 727-739.
- Mahajan N : Préservation de la fertilité chez les femmes atteintes d’un cancer : vue d’ensemble. J Hum Reprod Sci 2015 ; 8(1) : 3-13.
- Cakmak H, et al : Méthode efficace pour la préservation de la fertilité d’urgence : stimulation ovarienne contrôlée random-start. Fertil Steril 2013 ; 100 : 1673-1680.
- Rodriguez-Wallberg KA, et al : Préservation de la fertilité et grossesse chez les femmes avec et sans cancer du sein à mutation BRCA. The Oncologist 2012 ; 17 : 1409-1417.
- Donnez J, et al : Naissance à terme après transplantation orthotopique de tissu ovarien cryopréservé. Lancet 2004 ; 364 : 1405-1414.
- Van der Ven, et al. : Ninety-five orthotopic transplantations of ovarian tissue after cytotoxic treatment in a fertility network – tissue activity, pregnancy and delivery rates. FertiPROTEKT 2015 (en préparation).
- Moore HC, et al : Goserelin for ovarian protection during breast-cancer adjuvant chimiotherapy. N Eng J Med 2015 ; 372 : 923-932.
- Demeestere I, et al : Naissance vivante après autogreffe de tissu ovarien cryopréservé pendant l’enfance. Hum Reprod 2015 ; 9 : 2107-2109.
- Oktem O, et al : Fonction ovarienne et résultats reproductifs des patientes atteintes de lupus érythémateux disséminé et les stratégies pour préserver leur fertilité. Obstet Gynecol Surv 2015 ; 70(3) : 196-210.
- Tomao F, et al : Special issues in fertility preservation for gynecologic malignies. Crit Rev Oncol Hematol 2016 Jan ; 97 : 206-219.
- Baysal Ö, et al : La prise de décision en matière de préservation de la fertilité féminine équilibre la charge attendue du traitement de préservation de la fertilité et le désir de concevoir. Hum Reprod 2015 ; 7 : 1625-1634.
InFo ONKOLOGIE & HÄMATOLOGIE 2016 ; 4(1) : 30-33