L’utilisation des tests multigènes est actuellement limitée à la situation adjuvante du cancer du sein luminal HER2-négatif et permet des prédictions reproductibles du risque de récidive. Ces tests permettront de réduire le nombre de chimiothérapies dans un avenir proche. Cependant, des chimiothérapies adjuvantes inutiles peuvent déjà être évitées en appliquant systématiquement les critères actuels de St. Gallen ou les directives ESMO. Des études prospectives incluant OncotypeDX et MammaPrint seront disponibles dans les prochaines années, mais ne testent pas ces méthodes par rapport aux outils actuels comme on le souhaiterait. Les tests moléculaires doivent être utilisés pour l’autorisation ou la surveillance des médicaments. la prise en charge des coûts soit soumise aux mêmes critères et exigences que les médicaments. La prise en charge par les caisses d’assurance maladie oblige à une utilisation critique sans extrapolation à des situations non testées : Les femmes à faible risque ou présentant des contre-indications claires à la chimiothérapie doivent y renoncer.
Une méta-analyse basée sur les données de 6200 patientes atteintes d’un cancer du sein n’a pas pu montrer d’avantage de survie avec une chimiothérapie adjuvante à haute dose avec greffe de cellules souches autologues [1]. A l’Hôpital de l’Île, onze patientes ont été traitées de cette manière entre 1997 et 1999 dans le cadre de l’étude IBCSG-15-95. Dans l’éditorial de la méta-analyse, il est fait référence aux connaissances actuelles sur la biologie, qui conduiraient à des traitements efficaces et moins risqués. La phrase finale “We remember with gratitude those women who willingly enrolled onto the clinical trials that provided us these gains” montre que l’efficacité de la chimiothérapie a été surestimée et qu’un changement d’attitude a eu lieu depuis lors. Pour la méta-analyse, l’année de publication est surprenante : 2011. En effet, les données concernant environ 100 000 femmes atteintes d’un cancer du sein montrent qu’une chimiothérapie adjuvante réduit les rechutes de 8% sur dix ans, la mortalité par cancer du sein de 6,5% et la mortalité globale de 5% [2]. Dans la comparaison directe autorisée ici, le tamoxifène est plus efficace : le risque de récidive est réduit de 13,2% sur 15 ans, la mortalité par cancer du sein de 9,2% et la mortalité totale de 9,5%. L’effet le plus important est toutefois réservé aux patientes atteintes de tumeurs hormonosensibles [3].
Types de cancer du sein intrinsèques et marqueurs de substitution
Les profils d’expression génique ont permis d’identifier, il y a plus de dix ans, quatre groupes de cancers du sein présentant des évolutions cliniques et des réponses thérapeutiques différentes (“sous-types intrinsèques”) :
- Tumeurs à récepteurs hormonaux (RH) positifs de faible agressivité (Luminal A)
- Tumeurs HR-positives avec une plus grande agressivité (Luminal B)
- Tumeurs HER2-positives (HER2+)
- Carcinomes HR et HER2 négatifs avec ou sans caractéristiques des cellules basales (basal-like et normal-like, triple-négatif) [4].
Des analyses ultérieures ont montré que les quatre groupes simplifiaient la réalité. Le groupe le plus hétérogène est le type Luminal A avec une résistance relative à la chimiothérapie [5,6]. Il faut tout de suite préciser que ces méthodes utilisaient plusieurs milliers de gènes et qu’il ne faut pas les confondre avec les tests multigènes dont il est question ici. Les premières n’étant pas disponibles en routine, des définitions de substitution ont été recherchées (tableau 1).

Les sous-types intrinsèques de cancer du sein, basés sur la détermination des récepteurs des œstrogènes (ER) et de la progestérone (PR), de la prolifération (Ki67) et de HER2 (immunohistochimie ou FISH), ont été introduits dans le Consensus de St. Gall à partir de 2011 [7]. En raison de la valeur prédictive de la réponse aux traitements disponibles (hormonothérapie, chimiothérapie et thérapies ciblant HER2), ces sous-types constituent depuis lors la base des recommandations pour le traitement adjuvant ; auparavant, ces recommandations s’appuyaient principalement sur l’évaluation du pronostic à l’aide de facteurs non biologiques (taille de la tumeur, nombre de ganglions lymphatiques touchés).
Le casse-tête de la définition du substitut : les carcinomes luminal A et luminal B
Une patiente atteinte d’un cancer du sein souhaite savoir si elle bénéficiera ou non d’un traitement particulier. Contrairement aux cancers triple-négatifs et à la plupart des cancers HER2+, la question de la chimiothérapie dans le cancer du sein luminal est de savoir comment identifier les personnes atteintes qui peuvent bénéficier de ce traitement – en plus de l’hormonothérapie. La prolifération est un facteur prédictif et permet de distinguer les carcinomes luminal A-like des carcinomes luminal B-like (tableau 1). Cependant, la prolifération est une variable continue, ce qui implique une valeur limite dans le cadre d’une application clinique. Après avoir été de 14% pour définir le type de luminal B-like dans le Consensus de Saint-Gall en 2011 (c’est-à-dire Ki67 >14% = luminal B-like), cette valeur a été augmentée à 20% en 2013 et à 20-30% en 2015 avec 36% des voix [6]. Lors du vote de 2015, 20% des personnes présentes se sont abstenues et la même proportion du panel d’experts a dénié au Ki67 la légitimité de cette distinction [6].
Malgré les efforts internationaux, la détermination du Ki67 n’est pas encore standardisée. La reproductibilité n’a pas pu être améliorée, même après discussion entre 15 pathologistes suisses [8]. Une très bonne correspondance a cependant été obtenue dans les zones basses (<10%) et hautes (>30%). Ki67 colore les cellules en phase G1, S, G2 et M du cycle cellulaire, ce qui, outre les aspects techniques (définition de la positivité, sélection des parties tumorales), peut expliquer en outre les résultats discordants. Malgré la promotion intensive des tests multigènes commerciaux et l’attrait des techniques modernes, d’autres études dans ce domaine sont souhaitables.
Les tests multigènes ne sont pas comparables
Divers tests se sont engouffrés dans cette brèche à fort potentiel commercial. Ils sont mentionnés dans le Consensus de Saint-Gall depuis 2011 et ont déjà été intégrés dans diverses directives. Pour un aperçu, nous vous renvoyons à l’article du Dr. med. Patrizia Sager (InFo ONKOLOGIE & HÄMATOLOGIE 2/2015). Dans les modèles multivariés, les tests quantifient la positivité HR et la prolifération.
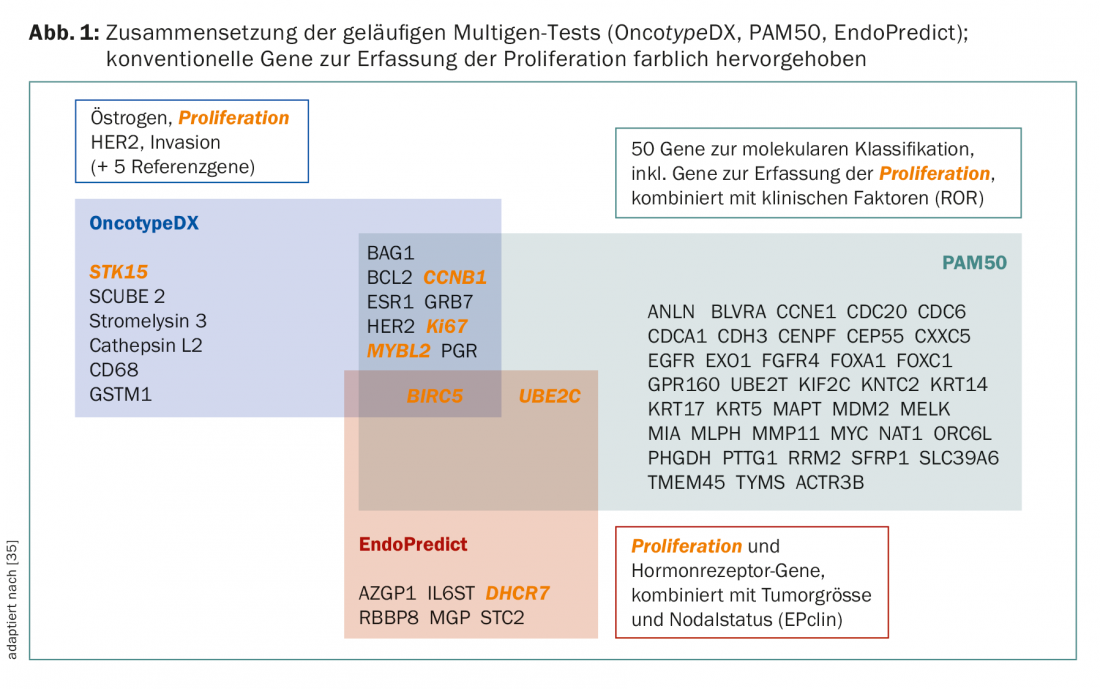
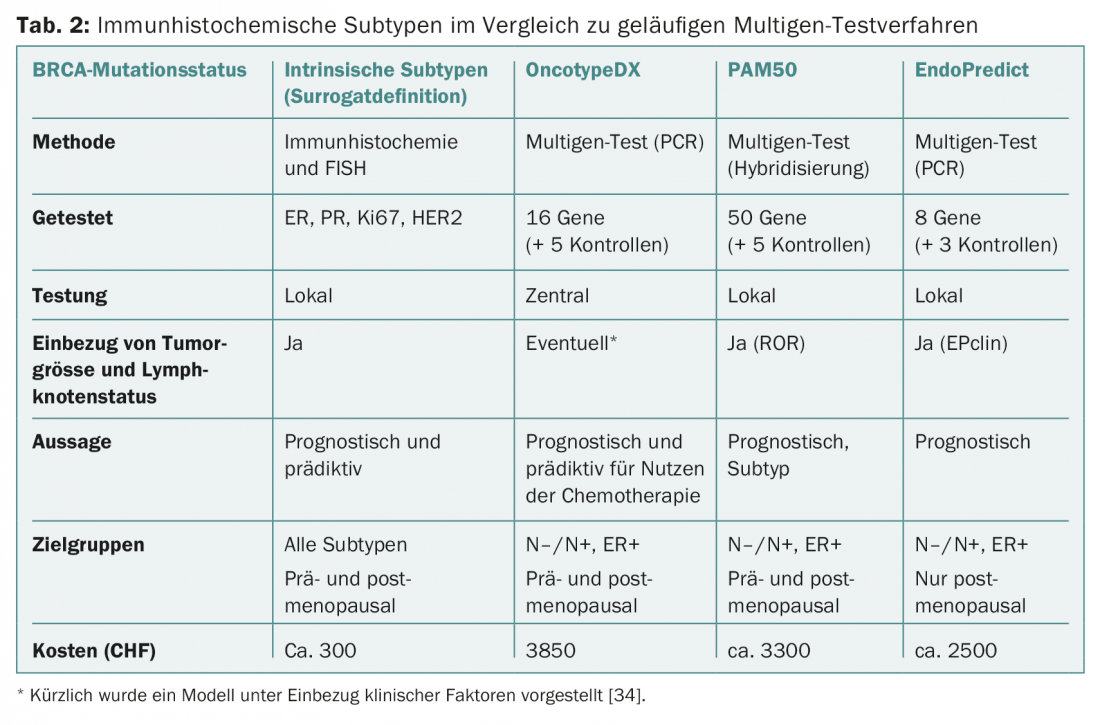
Même si les tests poursuivent en principe le même objectif, ils ne sont pas comparables sur le plan conceptuel. Il existe des différences dans les ensembles de gènes et les cas primaires pour le développement et la validation (Fig. 1 et Tab. 2). Par exemple, le PAM50 comprend des gènes pour les cancers ER+/- et reflète les types intrinsèques [9], tandis que l’OncotypeDX a été compilé pour prédire le bénéfice de la chimiothérapie dans les cancers ER+ [10]. MammaPrint mesure le risque de récidive chez les patientes non traitées [11,12]. Les facteurs cliniques influencent le résultat final de PAM50 (sous forme de PAM50 ROR) et d’EndoPredict (sous forme d’EPclin), ce qui dilue la valeur de la “biologie”.
En conséquence, les différents résultats des comparaisons directes (académiques !) ne sont pas inattendus [13–15]. Le risque déterminé par un test est également une variable continue, ce qui s’est avéré être une pierre d’achoppement pour l’immunohistochimie.
Tests multigènes : pronostiques et/ou prédictifs
Les marqueurs pronostiques prédisent, indépendamment du traitement, l’évolution de la maladie. Les marqueurs prédictifs indiquent si un traitement sera efficace ou non. Certains facteurs sont pronostiques et prédictifs ; dans le cas de HER2, la disponibilité de médicaments spécifiques a par la suite fait disparaître la valeur pronostique [16]. Le fait que les procédures pour le cancer du sein ER+/HER2- utilisent des informations supplémentaires telles que la taille de la tumeur et le degré de différenciation pour déterminer la probabilité de récidive est généralement accepté. Les tests de première génération (OncotypeDX, Mammaprint, Genomic Grade Index) peuvent prédire les rechutes dans les cinq premières années. Les méthodes plus récentes (PAM50, EndoPredict, Breast Cancer Index) obtiennent de meilleurs résultats pour la prédiction des récidives à cinq ans, ce qui est pertinent en raison des traitements hormonaux plus longs [17–19]. Les autres applications possibles des tests sont, outre le type intrinsèque, la prédiction du taux de réponse en cas de traitement néoadjuvant [20–22] et, en cas d’alternatives limitées, l’évaluation du risque en cas de lésions précancéreuses [23].
L’OncotypeDX entraîne – dans le cadre d’études non contrôlées pour la plupart – une diminution du nombre de chimiothérapies et fait que les médecins, actuellement effrayés, se sentent plus sûrs dans leurs décisions [24,25]. La “psychologie” de la possibilité d’utiliser l’OncotypeDX dans le choix des traitements adjuvants a fait partie de l’étude SAKK 26/10 ; elle montrera vraisemblablement la grande influence de l’OncotypeDX sur les décisions [25]. Récemment, il a été démontré que le test PAM50 permettait d’identifier les patientes nodalement positives pour lesquelles la chimiothérapie n’apporte aucun bénéfice [26].
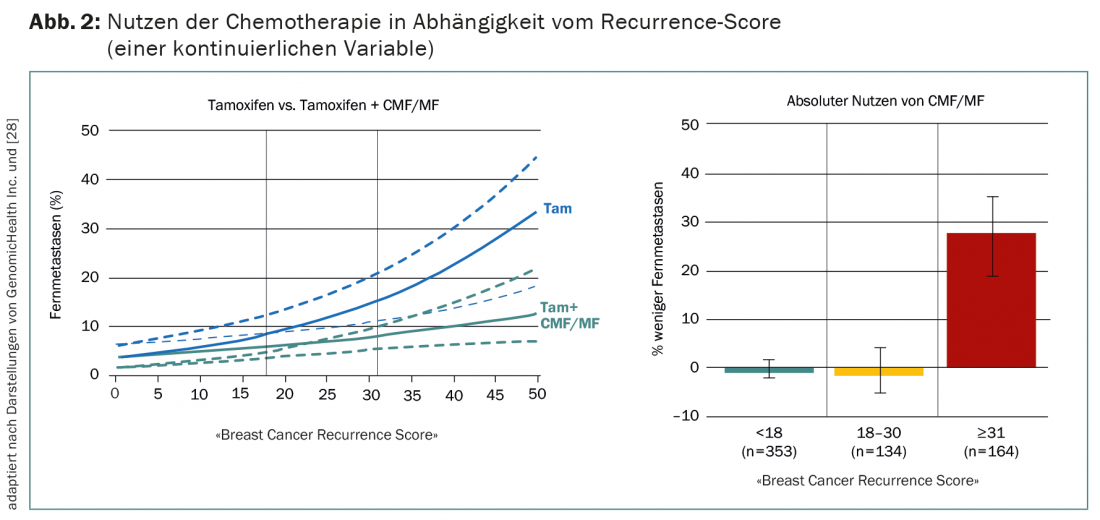
Actuellement, les preuves les plus convaincantes d’un test multigène dans le cancer du sein proviennent d’une analyse chez des patientes ER+ nodalement négatives. Celles-ci ont été randomisées pour recevoir du tamoxifène avec ou sans la chimiothérapie CMF/MF, rarement utilisée aujourd’hui, dans l’étude NSABP B20 [27]. L’OncotypeDX réalisé a posteriori chez 651 des 2299 patientes montre que la chimiothérapie n’apporte un bénéfice qu’aux personnes concernées ayant une forte probabilité de récidive (score de récidive >30) (Fig. 2) [28]. Sensu stricto, il ne s’agit donc pas d’une validation prospective, comme on l’a souvent prétendu.
Valeur ajoutée des tests multigènes ?
“Do I need chemotherapy” (ai-je besoin d’une chimiothérapie) ? C’est avec cette question rhétorique que les tests commerciaux font leur publicité, par exemple avec l’exemple de cas suivant sur leur site web : carcinome invasif-ductal de 1,8 cm chez une femme postménopausée, N0, G2, ER 90%, PR 40%, Ki67 15%. La probabilité de récidive, indiquée par le score de récidive, est faible (13) et le bénéfice supplémentaire d’une chimiothérapie est minime [28]. En appliquant les critères actuels de St. Gallen [6] ou les lignes directrices de l’ESMO [29], cette femme n’a pas besoin de chimiothérapie adjuvante en plus d’un inhibiteur de l’aromatase.
Trois grandes études prospectives sont actuellement en cours (Mindact, TailorX, RxPONDER), qui évaluent de manière randomisée l’hormonothérapie par rapport à la combinaison avec la chimiothérapie en fonction du résultat de l’OncotypeDX ou du MammaPrint (Fig. 3).
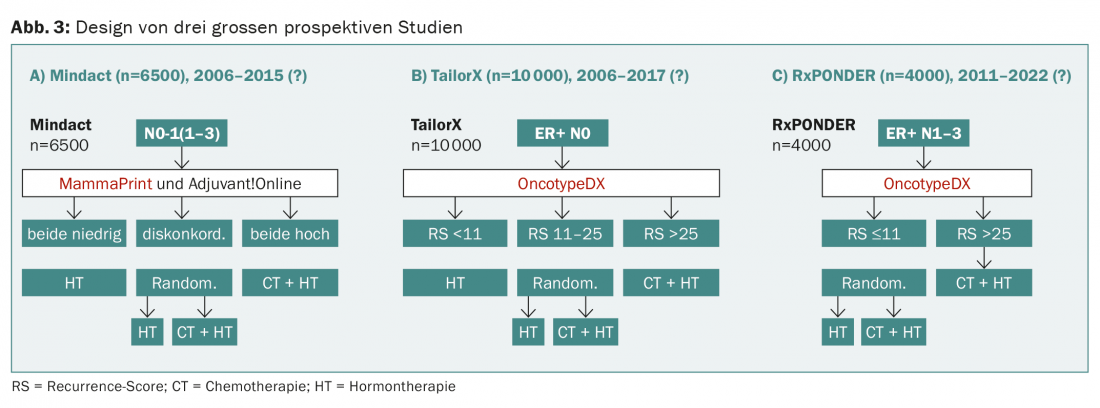
L’étude prospective WSG-planB compare notamment deux chimiothérapies pour un score de récidive >11. Le design de WSG-ADAPT est intéressant : en postopératoire, on suit une procédure similaire à celle de TailorX, mais on tient également compte de la réponse à une hormonothérapie de trois semaines. Cependant, aucune de ces études ne “teste” l’un des tests, comme l’exigerait la conception idéale d’une étude et comme c’est généralement le cas pour les médicaments (Fig. 4).
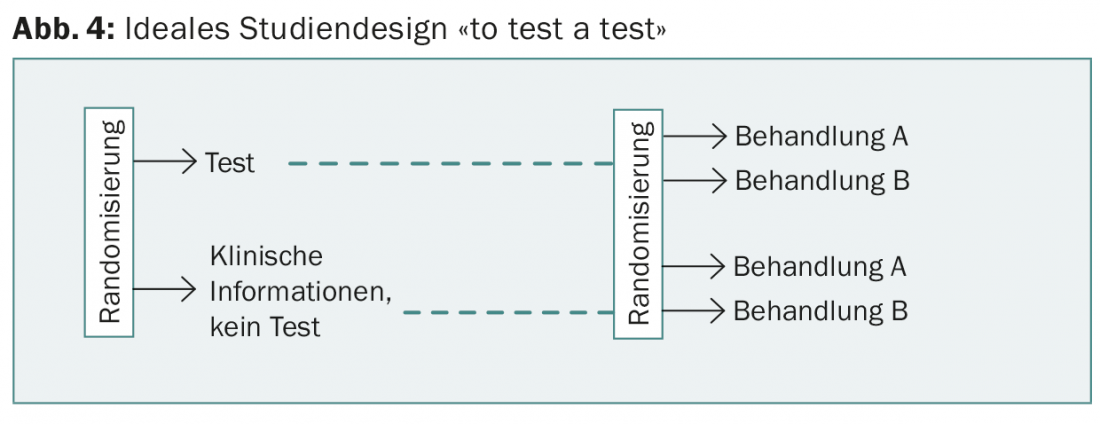
Cela serait pourtant nécessaire pour démontrer la valeur ajoutée des nouveaux tests par rapport aux informations existantes (y compris la meilleure détermination possible de Ki67) et pour justifier les coûts supplémentaires. Ces derniers sont pris en charge par les caisses d’assurance maladie depuis début 2015 et sont différents (tableau 2). Aucun test ne permet à ce jour de prédire le choix d’une chimiothérapie spécifique.
Il est compréhensible que les fournisseurs concurrents se présentent sous leur meilleur jour et se battent avec acharnement. Bien que non confirmé, le site Web du fabricant d’OncotypeDX, par exemple, affirme que le test peut également aider en cas de statut HER2 incertain [30,31]. Cela explique pourquoi le coût d’Herceptin® a été pris en compte dans les calculs qui attestent in fine de la rentabilité de ce test [32]. Comme le montrent les expériences faites avec d’autres produits concurrents en oncologie, en l’absence de comparaisons pionnières en Suisse, les différents produits s’établiront dans la vie quotidienne et conduiront ici aussi à un puzzle fédéral.
Tant que la reproductibilité n’est pas compromise, un test local est avantageux, car il permet une consultation entre les cliniciens et les pathologistes. C’est ce que montre le cas d’une patiente atteinte d’un carcinome mammaire multifocal, qui a été incluse dans l’étude SAKK 26/10 à l’Hôpital de l’Île. La prolifération des carcinomes de trois à 1 cm, déterminée par Ki67, était de 19%, 27% et 53%, respectivement. Le score de récidive de l’OncotypeDX, déterminé dans la lointaine Californie, était de 13%, ce qui n’a pas pu être remis en question en termes de représentativité. En outre, dans l’esprit de la médecine fondée sur les preuves, les extrapolations à des populations non testées, par exemple l’utilisation de l’EndoPredict chez les femmes préménopausées, ne sont pas autorisées.
Addendum : Les premiers résultats de l’étude TailorX [33], publiés après la soumission de ce manuscrit, restent conceptuellement sans influence sur les déclarations faites.
Littérature :
- Berry DA, et al : Chimiothérapie à haute dose avec support autologue de cellules souches en tant que traitement adjuvant dans le cancer du sein : revue de 15 essais randomisés. J Clin Oncol 2011 ; 29 : 3214-3223.
- Peto R, et al : Comparaisons entre différents régimes de polychimiothérapie pour le cancer du sein précoce : méta-analyses des résultats à long terme parmi 100,000 femmes dans 123 essais randomisés. Lancet 2012 ; 379 : 432-444.
- Davies C, et al : Pertinence des récepteurs hormonaux du cancer du sein et d’autres facteurs sur l’efficacité du tamoxifène adjuvant : méta-analyse au niveau patient d’essais randomisés. Lancet 2011 ; 378 : 771-784.
- Sotiriou C, et al : Classification et pronostic du cancer du sein sur la base des profils d’expression génétique d’une étude basée sur la population. Proc Natl Acad Sci USA 2003 ; 100 : 10393-10398.
- Ciriello G, et al : The molecular diversity of Luminal A breast tumors. Breast Cancer Res Treat 2013 ; 141 : 409-420.
- Coates AS, et al : Tailoring therapies-improving the management of early breast cancer : St Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2015. Ann Oncol 2015 ; 26 : 1533-1546.
- Goldhirsch A, et al : Strategies for sub-types – dealing with the diversity of breast cancer : highlights of the St. Gallen International Expert Consensus on the Primary Therapy of Early Breast Cancer 2011. Ann Oncol 2011 ; 22 : 1736-1747.
- Varga Z, et al : Quelle est la fiabilité de l’immunohistochimie Ki-67 dans les cancers du sein de grade 2 ? Une étude d’AQ du Groupe de travail suisse des pathologistes du sein et de la gynécologie. PLoS One 2012 ; 7 : e37379.
- Parker JS, et al : Supervised risk predictor of breast cancer based on intrinsic subtypes. J Clin Oncol 2009 ; 27 : 1160-1167.
- Paik S, et al : A multigene assay to predict recurrence of tamoxifen-treated, node-negative breast cancer. N Engl J Med 2004 ; 351 : 2817-2826.
- van de Vijver MJ, et al : A gene-expression signature as a predictor of survival in breast cancer. N Engl J Med 2002 ; 347 : 1999-2009.
- van ‘t Veer LJ, et al : Le profilage de l’expression génétique prédit l’issue clinique du cancer du sein. Nature 2002 ; 415 : 530-536.
- Dowsett M, et al : Comparaison du score de risque de récidive PAM50 avec l’oncotype DX et IHC4 pour prédire le risque de récidive à distance après un traitement endocrinien. J Clin Oncol 2013 ; 31 : 2783-2790.
- Fan C, et al : Concordance entre les prédicteurs basés sur l’expression des gènes pour le cancer du sein. N Engl J Med 2006 ; 355 : 560-569.
- Varga Z, et al : Comparaison des résultats des tests EndoPredict et Oncotype DX dans le cancer du sein invasif à récepteurs hormonaux positifs. PLoS One 2013 ; 8 : e58483.
- Buyse M, et al : Intégrer les biomarqueurs dans les essais cliniques. Expert Rev Mol Diagn 2011 ; 11 : 171-182.
- Goss PE, et al : A randomized trial of letrozole in postmenopausal women after five years of tamoxifen therapy for early-stage breast cancer. N Engl J Med 2003 ; 349 : 1793-1802.
- Davies C, et al : Effets à long terme de la poursuite du tamoxifène en adjuvant pendant 10 ans versus son arrêt à 5 ans après le diagnostic d’un cancer du sein avec récepteurs d’œstrogènes positifs : ATLAS, un essai randomisé. Lancet 2013 ; 381 : 805-816.
- Bianchini G, et al : Proliferation and estrogen signaling can distinguish patients at risk for early versus late relapse among estrogen receptor positive breast cancers. Breast Cancer Res 2013 ; 15 : R86.
- Pivot X, et al : A l’ère de la génomique, la taille de la tumeur doit-elle être reconsidérée comme un critère pour la chimiothérapie néoadjuvante ? Oncologist 2015 ; 20 : 344-350.
- Gluck S, et al : Le sous-typage moléculaire du cancer du sein au stade précoce identifie un groupe de patients qui ne bénéficient pas de la chimiothérapie néoadjuvante. Breast Cancer Res Treat 2013 ; 139 : 759-767.
- Esserman LJ, et al : La réponse à la chimiothérapie et la survie sans récidive dans le cancer du sein néoadjuvant dépendent des profils de biomarqueurs : résultats de l’I-SPY 1 TRIAL (CALGB 150007/150012 ; ACRIN 6657). Breast Cancer Res Treat 2012 ; 132 : 1049-1062.
- Rakovitch E, et al : A population-based validation study of the DCIS Score predicting recurrence risk in individuals treated by breast-conserving surgery alone. Breast Cancer Res Treat 2015 ; 152 : 389-398.
- Eiermann W, et al : The 21-gene recurrence score assay impacts adjuvant therapy recommendations for ER-positive, node-negative and node-positive early breast cancer resulting in a risk-adapted change in chemotherapy use. Ann Oncol 2013 ; 24 : 618-624.
- Augustovski F, et al : Impact décisionnel sur l’allocation de la chimiothérapie adjuvante dans le cancer du sein ganglionnaire précoce avec un test 21-gène : revue systématique et méta-analyse. Breast Cancer Res Treat 2015 ; 152 : 611-625.
- Gnant M, et al : Identifying clinically relevant pronostic subgroups of postmenopausal women with node-positive hormone receptor-positive early-stage breast cancer treated with endocrine therapy : a combined analysis of ABCSG-8 and ATAC using the PAM50 risk of recurrence score and intrinsic subtype. Ann Oncol 2015 ; 26 : 1685-1691.
- Fisher B, et al : Tamoxifène et chimiothérapie pour le cancer du sein avec ganglions lymphatiques négatifs et récepteurs d’œstrogènes positifs. J Natl Cancer Inst 1997 ; 89 : 1673-1682.
- Paik S, et al : Expression génétique et bénéfice de la chimiothérapie chez les femmes atteintes d’un cancer du sein à ganglions négatifs et récepteurs d’œstrogènes positifs. J Clin Oncol 2006 ; 24 : 3726-3734.
- Senkus E, et al : Cancer du sein primitif : Directives de pratique clinique de l’ESMO pour le diagnostic, le traitement et le suividagger. Ann Oncol 2015 ; 26 Suppl 5 : v8-v30.
- Dabbs DJ, et al : Taux élevé de faux négatifs de la réaction quantitative de polymérisation en chaîne par transcription inverse HER2 du test Oncotype DX : une étude indépendante d’assurance qualité. J Clin Oncol 2011 ; 29 : 4279-4285.
- Bhargava R, Dabbs DJ : Test Oncotype DX sur les cas non équivoques HER2-positifs : potentiel de nuisance. J Clin Oncol 2012 ; 30 : 570-571.
- Holt S, et al. : A decision impact, decision conflict and economic assessment of routine Oncotype DX testing of 146 women with node-negative or pNImi, ER-positive breast cancer in the U.K. Br J Cancer 2013 ; 108 : 2250-2258.
- Sparano JA, et al : Validation prospective d’un test d’expression de 21 gènes dans le cancer du sein. N Engl J Med 2015 Nov 19 ; 373(21) : 2005-2014.
- Klein ME, et al : Prediction of the Oncotype DX recurrence score : use of pathology-generated equations derived by linear regression analysis. Mod Pathol 2013 ; 26 : 658-664.
- Denkert C, et al : [Molecular pathology for breast cancer : Importance of the gene expression profile]. Pathologe 2015 ; 36 : 145-153.
InFo ONKOLOGIE & HÄMATOLOGIE 2016 ; 4(1) : 10-14