Environ 200 000 patients en Suisse vivent avec un diagnostic d’insuffisance cardiaque. Jusqu’à 10% d’entre eux développent des symptômes progressifs. A partir de quand parle-t-on d’insuffisance cardiaque sévère et que peut-on faire ?
En 2018, la Heart Failure Association of the European Society of Cardiology a publié un document de synthèse sur le thème de l’insuffisance cardiaque sévère [1]. Ce texte est en grande partie un résumé des recommandations qui y sont publiées.
En Suisse, 150 000 à 200 000 patients sont diagnostiqués comme souffrant d’insuffisance cardiaque [2]. Malgré les progrès réalisés ces dernières années dans le traitement de l’insuffisance cardiaque et l’apparition de nouveaux médicaments tels que le sacubitril/valsartan, environ 5 à 10% des patients atteints d’insuffisance cardiaque développeront des symptômes progressifs et souffriront d’une insuffisance cardiaque grave progressive [3–5]. Le nombre de patients souffrant d’insuffisance cardiaque sévère continuera d’augmenter avec l’amélioration de la survie et l’augmentation de l’incidence de l’insuffisance cardiaque. Il est essentiel que les médecins de premier recours et les cardiologues libéraux reconnaissent et diagnostiquent l’insuffisance cardiaque sévère et orientent les patients vers un centre tertiaire de l’insuffisance cardiaque au moment opportun. Ce n’est qu’ainsi que d’autres possibilités thérapeutiques, y compris la liste pour une transplantation cardiaque ou l’utilisation de systèmes d’assistance circulatoire mécanique (MCS), peuvent être planifiées à temps et mises en œuvre avec succès.
Définition de l’insuffisance cardiaque sévère et détermination du pronostic
Il existe plusieurs définitions de l’insuffisance cardiaque sévère dans la littérature [5–8]. En raison de son exhaustivité et de son applicabilité clinique, nous considérons que la définition récemment publiée par la Heart Failure Associaton (HFA)-ESC est très utile pour la pratique clinique quotidienne. Dans ce cas, tous les critères suivants doivent être remplis malgré un traitement optimal de l’insuffisance cardiaque
- Symptômes persistants sévères d’insuffisance cardiaque (NYHA classe III ou IV)
- Dysfonction cardiaque sévère définie par une réduction de la FEVG <30%, une défaillance ventriculaire droite isolée ou des anomalies valvulaires sévères non opérables ou des anomalies congénitales ou des valeurs BNP/NT-proBNP élevées (alternativement croissantes) persistantes et une dysfonction diastolique sévère ou des anomalies structurelles du VG selon la définition ESC de HFpEF et HFmrEF
- Épisodes de congestion pulmonaire ou systémique nécessitant un traitement intraveineux à haute dose de diurétiques (ou d’associations de diurétiques) ou épisodes de bas débit nécessitant des inotropes ou des médicaments vasoactifs ou arythmies malignes ayant entraîné au moins une présentation ou une hospitalisation non planifiée au cours des 12 derniers mois
- Limitation sévère de la capacité physique, idéalement objectivée par un test de marche de 6 minutes à moins de 300 mètres ou une spiroergométrie avec absorption maximale d’O2 de (pVO2 <12-14 mL/kg/min) avec une origine cardiaque présumée
De plus, l’insuffisance cardiaque avancée est caractérisée par des dysfonctionnements d’organes systémiques (insuffisance rénale, cachexie cardiaque, insuffisance hépatique) et/ou une hypertension pulmonaire. En ce sens, un syndrome cardio-rénal ou une perte de poids de 6% du poids corporel en 6 mois (définition de la cachexie cardiaque) doivent être considérés comme des indicateurs d’insuffisance cardiaque sévère. Une hypertension pulmonaire d’origine cardiaque doit être documentée précocement et considérée comme un signe d’insuffisance cardiaque avancée. Si elle est détectée trop tard, son ampleur risque de constituer une contre-indication à la transplantation cardiaque. La détérioration de la fonction cardiaque droite qui en résulte peut également rendre impossible la poursuite du traitement par un dispositif d’assistance ventriculaire gauche (DAVG).
Les maladies concomitantes sont très souvent associées à l’insuffisance cardiaque. Dans la définition de l’insuffisance cardiaque sévère, les critères 1 et 4 doivent être considérés comme remplis même s’il existe une dysfonction cardiaque selon le critère 2, mais qu’une grande partie de la limitation est expliquée par une comorbidité (par exemple, une maladie pulmonaire). Les comorbidités, comme par exemple le diabète, les maladies pulmonaires (BPCO, apnée du sommeil), l’insuffisance rénale, l’anémie, la carence en fer ou les maladies rhumatismales chroniques, influencent considérablement le pronostic de l’insuffisance cardiaque et doivent être traitées au mieux [9]. Les comorbidités doivent donc impérativement être prises en compte dans l’évaluation globale et le pronostic, car elles peuvent, d’une part, refléter la gravité de l’insuffisance cardiaque et, d’autre part, être considérées comme des contre-indications potentielles aux thérapies de remplacement cardiaque (transplantation cardiaque, systèmes d’assistance cardiaque). Le dysfonctionnement de l’organe terminal, en particulier, a un impact négatif sur le pronostic global. Des examens complémentaires pour prédire une éventuelle réversibilité d’une dysfonction endogène après la transplantation ou une assistance cardiaque mécanique (par exemple en cas d’insuffisance rénale) sont utiles, mais restent souvent indécis.
Une stratification régulière du risque est essentielle en cas d’insuffisance cardiaque sévère afin de ne pas manquer le moment optimal pour une admission dans un centre d’insuffisance cardiaque et de mettre en place des investigations, des traitements et des suivis plus poussés. La prédiction du pronostic et la stratification du risque qui en découle ne peuvent pas être effectuées sur la base d’un seul paramètre, mais nécessitent la prise en compte de différentes variables sensibles au pronostic. Plusieurs scores multivariables de ce type ont été validés cliniquement et sont largement utilisés. Le Heart Failure Survival Score (HFSS) et le Seattle Heart Failure Model (SHFM) comptent parmi les scores les plus utilisés dans la pratique clinique quotidienne [10,11]. D’autres scores sont le (MECKI) score (Metabolic Exercise test data combinded with Cardiac and Kidney indexes score) et le MAGGIC Score Meta-Analysis Global Group in Chronic Herat Failure [12–15].
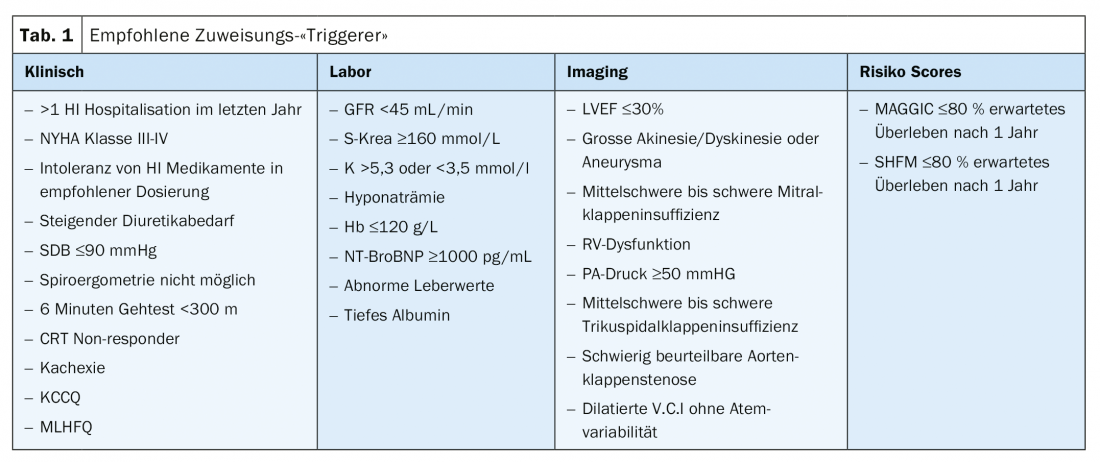
Bien que l’atteinte d’un certain score (par exemple HFSS) soit associée à une recommandation d’évaluation d’un traitement de remplacement cardiaque, il n’existe actuellement pas de seuil à partir duquel une orientation vers un centre de traitement de l’insuffisance cardiaque devrait être effectuée. Le tableau 1 présente les déclencheurs cliniques, de laboratoire, d’imagerie et de score de risque listés par la HFA-ESC qui devraient conduire à l’orientation vers un centre de traitement de l’insuffisance cardiaque. Trop souvent, les patients sont malheureusement envoyés trop tard. En général, si la définition de l’insuffisance cardiaque sévère est remplie, il faut prendre contact avec un centre.
Spiroergométrie et test de marche de 6 minutes
La spiroergométrie est un examen clé pour la stratification du risque chez les patients ambulatoires souffrant d’insuffisance cardiaque. En plus des informations pronostiques, des données objectives sur la performance globale, la limitation cardio-pulmonaire et la réserve cardio-vasculaire sont générées.
Une consommation maximale d’oxygène (pVO2) ≤12 ml/kg/min (≤14 ml/kg/min sans traitement bêtabloquant) est considérée comme une indication de listing pour une transplantation cardiaque ou une MCS selon les Guidelines [16]. Les femmes qui atteignent ≤50% de la consommation maximale d’oxygène pourraient également être évaluées pour une transplantation cardiaque si elles sont âgées de moins de 50 ans [16]. Si l’équivalent respiratoire pour le dioxyde de carbone (V E/VCO2) est supérieur à 35, cela indique un mauvais pronostic.
Le test de marche de 6 minutes est un test d’effort sous-maximal, contrairement à la spiroergométrie, qui est un test d’effort maximal. Les résultats des études concernant la corrélation avec la survie ne sont pas concordants [17–20]. Si la spiroergométrie n’est pas possible, le test de marche de 6 minutes est une alternative valable. Une distance de marche de <300 mètres identifie les patients présentant une intolérance sévère à la performance.
Stratégies de traitement pour les patients souffrant d’insuffisance cardiaque sévère
Il n’existe que deux stratégies de traitement à long terme de l’insuffisance cardiaque sévère, à moins d’opter pour une approche palliative. Il s’agit de la transplantation cardiaque ou d’un système d’assistance circulatoire mécanique (MCS). Des systèmes d’assistance circulatoire mécanique de courte durée et des médicaments vasoactifs par voie intraveineuse sont disponibles comme solutions de transition. Les diurétiques constituent le traitement de base de l’hyperhydratation.
Traitement de l’excès d’eau
Les diurétiques de l’anse constituent le traitement de base de l’hypervolémie. En cas d’insuffisance cardiaque sévère, il existe souvent une résistance aux diurétiques et une insuffisance rénale croissante. L’utilisation à long terme de diurétiques peut entraîner divers mécanismes d’adaptation rénale, tels qu’une hypertrophie et une hyperfonction au niveau du néphron distal, ainsi qu’une augmentation de la sécrétion de rénine. De plus, une augmentation des anions urémiques et une protéinurie peuvent réduire l’efficacité des diurétiques [21]. En pratique clinique quotidienne, un blocage néphronique séquentiel, une combinaison d’un diurétique de l’anse et d’un diurétique thiazidique (par exemple, la métolazone), est souvent utilisé pour briser la résistance aux diurétiques. Il existe toutefois peu de preuves à l’appui de cette approche.
L’ultrafiltration permet d’éliminer le liquide du sang à travers une membrane semi-perméable via un appareil de dialyse. En cas d’absence de réponse aux diurétiques per os, il est recommandé en premier lieu de passer à une administration par voie intraveineuse. Il convient de commencer par une dose plus élevée et de l’augmenter progressivement jusqu’à ce qu’une diurèse suffisante soit atteinte. Si elle n’est pas atteinte, l’étape suivante consiste à associer un diurétique à un blocage néphronique séquentiel et, seulement en cas d’échec de ces mesures, à envisager une ultrafiltration dans des cas sélectionnés [7,9].
Médicaments vasoactifs par voie intraveineuse
Ils jouent surtout un rôle dans la situation aiguë chez les patients présentant des signes de syndrome de bas débit et d’hypoperfusion. En outre, il est indiqué chez des patients sélectionnés en tant que traitement de transition avant l’implantation d’un MCS ou la réalisation d’une transplantation cardiaque. Bien que les inotropes puissent améliorer les paramètres hémodynamiques, la plupart des études ne montrent pas d’amélioration du résultat. Certaines études indiquent même une aggravation du pronostic [22–24]. C’est pourquoi l’utilisation à long terme d’inotropes doit être évitée. Dans certains cas, si aucune autre option thérapeutique n’est envisageable, un traitement séquentiel par inotropes peut être utilisé comme mesure palliative [25,26].
Systèmes d’assistance mécanique en circuit fermé : Systèmes à court terme
Les systèmes d’assistance circulatoire mécanique de courte durée sont utilisés dans la phase aiguë d’un choc cardiogénique. Ils permettent une fenêtre de temps pendant laquelle la fonction cardiaque peut se rétablir grâce à une décharge maximale. En outre, il est également possible d’attendre l’évolution de la récupération d’autres systèmes d’organes, comme la fonction neurologique après un arrêt cardiovasculaire. Toutefois, en l’absence d’amélioration de la fonction cardiaque, les systèmes à court terme peuvent constituer un “pont” vers l’implantation d’un dispositif d’assistance ventriculaire (DAV) à long terme ou vers une transplantation cardiaque, si cette option est choisie. Il existe différents systèmes d’assistance circulatoire mécanique qui peuvent être utilisés pendant une période limitée. La pompe à ballonnet intra-aortique (IABP) est implantée par voie percutanée à l’aide d’un cathéter. Un ballonnet est implanté dans l’aorte descendante et gonflé à chaque fois pendant la diastole. Cela augmente la pression diastolique dans la racine de l’aorte, ce qui entraîne une amélioration de la perfusion coronaire. Le dégonflement du ballon entraîne une réduction de la postcharge et diminue donc la consommation d’oxygène. Actuellement, l’IABP est surtout utilisée par certains centres pour le choc cardiogénique en cas de cardiopathie ischémique, bien que les preuves d’une amélioration de la mortalité n’aient pas été démontrées [1,27].
Une impella est une pompe intravasculaire axiale qui peut également être implantée par cathéter. Elle peut transporter jusqu’à 5 litres de sang par minute du ventricule gauche vers l’aorte ascendante, soulageant ainsi le ventricule gauche. L’hémodynamique est améliorée et la pression de remplissage est réduite ; en même temps, la pression de perfusion coronaire est augmentée.
Bien qu’aucune donnée claire n’ait pu être recueillie à ce jour concernant l’amélioration de la mortalité, une petite étude de registre a montré que l’utilisation d’un protocole standardisé avec un soutien hémodynamique précoce par Impella CP en cas de choc cardiogénique pourrait être associée à une amélioration du résultat et à une réduction de la mortalité [28].
L’oxygénation extracorporelle par membrane (ECMO) consiste à oxygéner le sang à travers une membrane dans une machine cœur-poumon spéciale située à l’extérieur du corps. En plus de l’assistance respiratoire complète, l’appareil ECMO comprend une pompe axiale, ce qui permet d’atteindre des débits allant jusqu’à 6 L/min. Une ECMO veino-artérielle périphérique peut être implantée par un cardiologue interventionnel à l’aide de la technique de Seldinger et maintenir la circulation en cas de cœur défaillant et soutenir l’oxygénation.
Les effets hémodynamiques de l’ECMO ne sont pas physiologiques. D’une part, la précharge du cœur est réduite en drainant le sang du côté veineux. D’autre part, l’éjection du sang oxygéné dans l’aorte à un débit de 4-6 L/min entraîne une augmentation de la postcharge du ventricule gauche, ce qui peut entraîner une augmentation du volume diastolique terminal du ventricule gauche et de la pression de remplissage, en fonction du dysfonctionnement cardiaque. Pour éviter un œdème pulmonaire dans cette situation, on peut par exemple implanter en plus une impella, pour soulager le ventricule gauche [29]. Comme l’Impella, l’ECMO peut être utilisée comme “pont vers la transplantation” ou comme “pont vers la décision” en cas de choc cardiogénique au stade final de l’insuffisance cardiaque sévère.
Gestion à long terme de l’insuffisance cardiaque sévère
Lorsque les symptômes de l’insuffisance cardiaque ne peuvent plus être contrôlés ou que les fonctions d’organes terminales sont menacées, des traitements avancés de l’insuffisance cardiaque sont indiqués. Une condition préalable est bien entendu que le traitement médicamenteux et le traitement par dispositif soient optimisés et épuisés conformément aux guidelines. En outre, les patients qui ont une indication de revascularisation doivent être revascularisés et les patients atteints de cardiopathies valvulaires doivent bénéficier d’un remplacement valvulaire, si cela est indiqué.
Transplantation cardiaque
Les patients souffrant d’insuffisance cardiaque sévère et réfractaire sans cause traitable sont potentiellement éligibles à une transplantation cardiaque si les alternatives de traitement conventionnel ont été épuisées. Le risque évalué lors de la stratification du risque doit indiquer une mortalité d’au moins >20% pour les 12 mois suivants [30]. De plus, il faut s’assurer que la transplantation cardiaque prolonge considérablement la survie du patient et améliore considérablement sa qualité de vie. Les candidats à une transplantation cardiaque doivent être motivés, émotionnellement stables et faire preuve d’une grande observance et d’une bonne adhésion au traitement. L’évaluation des comorbidités éventuelles est un élément important des examens préalables pour estimer le résultat d’une transplantation [16,31]. Les contre-indications à la transplantation cardiaque sont listées dans le tableau 2.
Le bilan pré-transplantation comprend une anamnèse complète de la maladie, un bilan physique, une spiro-ergométrie, un cathétérisme cardiaque gauche-droit, une évaluation de la maladie artérielle périphérique, une évaluation de la fragilité et du statut nutritionnel. En outre, les fonctions organiques (rein, foie, poumons) doivent être évaluées et un dépistage des tumeurs et des infections actives est effectué. Les scores pronostiques doivent être calculés et des examens complémentaires doivent être réalisés en fonction de la présence de co-morbidités [16]. De plus, une évaluation psychosociale complète est effectuée [32].

La première transplantation cardiaque a été réalisée en 1967 [33]. En Suisse, 50 transplantations cardiaques ont été réalisées en 2018 [35]. La médiane de survie est de 12,5 ans [34]. Les causes les plus fréquentes de mortalité à long terme sont l’échec du greffon, les infections et les défaillances multi-organes [34]. Le risque de défaillance aiguë létale du greffon est le plus élevé dans les 30 premiers jours suivant la transplantation. Les complications infectieuses mortelles sont les plus fréquentes au cours des 12 premiers mois en raison des doses élevées d’immunosuppresseurs, y compris les stéroïdes. Le risque d’une réaction de rejet cellulaire pertinente diminue considérablement après deux ans. Sur le long terme, la mortalité liée aux tumeurs, à l’insuffisance rénale et à la vasculopathie du greffon gagne en importance [34].
Support mécanique à long terme
Une pompe cardiaque mécanique (Ventricular Assist Device, VAD) est utilisée pour assister le ventricule gauche (LVAD), le ventricule droit (RVAD) ou les deux ventricules (BiVAD). Des études montrent une amélioration de la survie et de la qualité de vie chez les patients souffrant d’insuffisance cardiaque sévère réfractaire [9]. Un VAD peut être utilisé comme “pont vers la transplantation” pendant la période d’attente d’une transplantation. Si un patient n’est pas candidat à une transplantation, par exemple en raison de son âge, un VAD peut être utilisé comme traitement de destination. Une résistance vasculaire pulmonaire significativement élevée ou une insuffisance rénale sévère sont des contre-indications à la transplantation cardiaque mais pas à l’implantation d’un VAD. La résistance vasculaire pulmonaire et l’insuffisance rénale sévère peuvent toutes deux s’améliorer sous traitement par VAD [36,37]. Dans ces cas, la thérapie VAD est utilisée comme “passerelle vers la candidature à la transplantation”. Il en va de même pour les tumeurs potentiellement traitées de manière curative, pour lesquelles une absence de tumeur d’au moins 5 ans devrait être attestée avant une éventuelle transplantation cardiaque. Dans de rares cas (par exemple, myocardite fulminante), la thérapie VAD peut être utilisée comme un “pont vers la récupération”.
En l’absence de solution adéquate pour un traitement d’assistance ventriculaire droite ou biventriculaire à long terme, l’insuffisance ventriculaire droite sévère reste une contre-indication à l’implantation de l’appareillage [38].
Thérapie palliative
Parmi tous les patients souffrant d’insuffisance cardiaque sévère, peu sont éligibles à une transplantation cardiaque ou à un traitement par VAD. Si toutes les stratégies de traitement ont été épuisées au stade final de l’insuffisance cardiaque sévère, les objectifs du traitement passent de la prolongation de la vie au contrôle des symptômes et à l’optimisation de la qualité de vie [39]. Dans cette situation, le traitement conventionnel, purement interniste et cardiologique, est souvent insuffisant pour soulager les souffrances du patient et un traitement multidisciplinaire impliquant des spécialistes des soins palliatifs est recommandé. L’étude PAL-HF a montré qu’une approche palliative interdisciplinaire entraînait une amélioration de la qualité de vie et des symptômes d’anxiété et de dépression par rapport au traitement standard [40]. L’accès aux concepts de traitement palliatif devrait donc être à bas seuil pour tous les patients souffrant d’insuffisance cardiaque sévère. Il est également recommandé de rédiger rapidement des directives anticipées détaillées. Si ce n’est pas le cas, cela devrait être fait au plus tard avant les thérapies intensives. Les souhaits individuels du patient concernant les mesures de prolongation de la vie, y compris l’état d’activité d’un défibrillateur implanté, doivent être régulièrement discutés et adaptés à l’évolution attendue de la maladie et documentés en conséquence [41]. Dans la mesure du possible, la décision d’arrêter les traitements avancés de l’insuffisance cardiaque (DAI, traitement VAD, immunosuppression) doit être laissée au patient. S’il n’est pas en mesure de prendre cette décision, celle-ci doit être prise par la famille, les soignants ou un comité d’éthique de l’hôpital.
En résumé, l’identification d’une insuffisance cardiaque sévère et l’orientation précoce vers un centre tertiaire de traitement de l’insuffisance cardiaque sont des priorités absolues. Une stratification adéquate du risque, incluant les scores de risque établis, une spiroergométrie et un cathétérisme cardiaque droit, doit être effectuée à intervalles réguliers par le centre de l’insuffisance cardiaque. Les possibilités de traitement de l’insuffisance cardiaque sévère se sont considérablement améliorées, notamment grâce à des progrès technologiques considérables dans le domaine des systèmes d’assistance cardiaque à long terme (VAD). Les systèmes d’assistance cardiaque peuvent aujourd’hui être proposés aux patients âgés avec de bons résultats thérapeutiques. La transplantation cardiaque reste le traitement de référence. Celle-ci reste toutefois une rareté en raison du manque général d’organes. Le rattachement à une équipe de soins palliatifs doit être précoce et peut améliorer considérablement la qualité de vie des patients concernés et de leurs proches.
Messages Take-Home
- Reconnaître une insuffisance cardiaque sévère
- Orientation précoce vers un centre tertiaire de l’insuffisance cardiaque afin de mettre en place des évaluations, des traitements et des suivis plus approfondis.
- Lien précoce avec une équipe de soins palliatifs
Littérature :
- Crespo-Leiro MG, et al : “Advanced heart failure : a position statement of the Heart Failure Association of the European Society of Cardiology, Eur J Heart Fail, 20(11) : 1505-1535, Nov. 2018, doi : 10.1002/ejhf.1236.
- Fondation Suisse de Cardiologie : “Le défi de l’insuffisance cardiaque” [Online]. Disponible sur : www.swissheart.ch/de/forschung/medizinische-fortschritte/herzinsuffizienz.html
- Xanthakis V, et al : Prevalence, Neurohormonal Correlates, and Prognosis of Heart Failure Stages in the Community, JACC Heart Fail, 4(10) : 808-815, Jun. 2016, doi : 10.1016/j.cardfail.2016.03.003.
- Bjork JB, Alton KK, Georgiopoulou VV, et al. : Defining Advanced Heart Failure : A Systematic Review of Criteria Used in Clinical Trials, J Card Fail, 22(7) : 569-577, Jul. 2016, doi : 10.1016/j.cardfail.2016.03.003.
- Fang JC, et al. : Insuffisance cardiaque avancée (stade D) : une déclaration du comité des lignes directrices de la Heart Failure Society of America, J Card Fail 21(6) : 519-534, Jun. 2015, doi : 10.1016/j.cardfail.2015.04.013.
- Metra M, et al : Insuffisance cardiaque chronique avancée : une déclaration de position du groupe d’étude sur l’insuffisance cardiaque avancée de l’Association de l’insuffisance cardiaque de la Société européenne de cardiologie, Eur J Heart Fail 9(6-7) : 684-694, 2007, doi : 10.1016/j.ejheart.2007.04.003.
- Yancy CW, et al : 2013 ACCF/AHA guideline for the management of heart failure : executive summary : a report of the American College of Cardiology Foundation/American Heart Association Task Force on practice guidelines, Circulation 128(16), 1810-1852, Oct. 2013, doi : 10.1161/CIR.0b013e31829e8807.
- Hunt SA, et al : 2009 Focused update incorporated into the ACC/AHA 2005 Guidelines for the Diagnosis and Management of Heart Failure in Adults A Report of the American College of Cardiology Foundation/American Heart Association Task Force on Practice Guidelines Developed in Collaboration With the International Society for Heart and Lung Transplantation, J Am Coll Cardiol 53(15) : e1-e90, Apr. 2009, doi : 10.1016/j.jacc.2008.11.013.
- Ponikowski P, et al : 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure : The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Développé avec la contribution spéciale, Eur J Heart Fail 18(8) : 891-975, Aug. 2016, doi : 10.1002/ejhf.592.
- Aaronson KD, Schwartz JS, Chen TM, et al. : Development and prospective validation of a clinical index to predict survival in ambulatory patients referred for cardiac transplant evaluation, Circulation, 95(12) : 2660-2667, Jun. 1997, doi : 10.1161/01.cir.95.12.2660.
- Levy WC, et al. : The Seattle Heart Failure Model : prediction of survival in heart failure, Circulation 113(11) : 1424-1433, Mar. 2006, doi : 10.1161/CIRCULATIONAHA.105.584102.
- Agostoni P, et al. : Metabolic exercise test data combined with cardiac and kidney indexes, the MECKI score : a multiparametric approach to heart failure prognosis, Int J Cardiol 167(6) : 2710-2718, Sep. 2013, doi : 10.1016/j.ijcard.2012.06.113.
- Agostoni P, et al : Multiparametric prognostic scores in chronic heart failure with reduced ejection fraction : a long-term comparison, Eur. J Heart Fail 20(4) : 700-710, avr. 2018, doi : 10.1002/ejhf.989.
- Corra U, et al : The metabolic exercise test data combined with Cardiac And Kidney Indexes (MECKI) score and prognosis in heart failure. A validation study, Int J Cardiol 203 : 1067-1072, Jan. 2016, doi : 10.1016/j.ijcard.2015.11.075.
- Pocock SJ, et al. : Predicting survival in heart failure : a risk score based on 39 372 patients from 30 studies, Eur Heart J 34(19) : 1404-1413, May 2013, doi : 10.1093/eurheartj/ehs337.
- Mehra MR, et al. : The 2016 International Society for Heart Lung Transplantation listing criteria for heart transplantation : A 10-year update, J. Heart Lung Transplant 35(1) : 1-23, Jan. 2016, doi : 10.1016/j.healun.2015.10.023.
- Alahdab MT, Mansour IN, Napan S, Stamos TD : Six minute walk test predicts long-term all-cause mortality and heart failure rehospitalization in African-American patients hospitalized with acute decompensated heart failure, J Card Fail 15(2) : 130-135, Mar. 2009, doi : 10.1016/j.cardfail.2008.10.006.
- Guazzi M, Dickstein K, Vicenzi M, Arena R : Six-minute walk test and cardiopulmonary exercise testing in patients with chronic heart failure : a comparative analysis on clinical and prognostic insights, Circ Heart Fail 2(6) : 549-555, Nov. 2009, doi : 10.1161/CIRCHEARTFAILURE.109.881326.
- Hulsmann M, et al. : Prediction of outcome by neurohumoral activation, the six-minute walk test and the Minnesota Living with Heart Failure Questionnaire in an outpatient cohort with congestive heart failure, Eur Heart J 23(11) : 886-891, Jun. 2002, doi : 10.1053/euhj.2001.3115.
- Wolsk E, et al. : Resting and exercise haemodynamics in relation to six-minute walk test in patients with heart failure and preserved ejection fraction, Eur J Heart Fail 20(4) : 715-722, Apr. 2018, doi : 10.1002/ejhf.976.
- Costanzo MR, et al. : Extracorporeal Ultrafiltration for Fluid Overload in Heart Failure : Current Status and Prospects for Further Research, J Am Coll Cardiol 69(19) : 2428-2445, May 2017, doi : 10.1016/j.jacc.2017.03.528.
- Cuffe MS, et al. : Short-term intravenous milrinone for acute exacerbation of chronic heart failure : a randomized controlled trial, JAMA 287(12) : 1541-1547, Mar. 2002, doi : 10.1001/jama.287.12.1541.
- O’Connor CM, et al : Continuous intravenous dobutamine is associated with an increased risk of death in patients with advanced heart failure : insights from the Flolan International Randomized Survival Trial (FIRST), Am Heart J 138(1) Pt 1 : 78-86, Jul. 1999, doi : 10.1016/s0002-8703(99)70250-4.
- Packer M, et al. : Effect of levosimendan on the short-term clinical course of patients with acutely decompensated heart failure, JACC Heart Fail 1(2) : 103-111, avr. 2013, doi : 10.1016/j.jchf.2012.12.004.
- Comín-Colet J, et al. : Efficacité et sécurité de l’administration intermittente intraveineuse en dehors du patient du levosimendan chez les patients atteints d’insuffisance cardiaque avancée : l’essai randomisé multicentrique LION-HEART, Eur J Heart Fail 20(7) : 1128-1136, Jul. 2018, doi : 10.1002/ejhf.1145.
- Altenberger J, et al. : Efficacité et sécurité des perfusions pulsées de levosimendan chez les patients outpatient with advanced heart failure (LevoRep) study : a multicentre randomized trial, Eur J Heart Fail 16(8) : 898-906, Aug. 2014, doi : 10.1002/ejhf.118.
- Unverzagt S, et al. : Intra-aortic balloon pump counterpulsation (IABP) for myocardial infarction complicated by cardiogenic shock, Cochrane database Syst Rev 3 : CD007398-CD007398, Mar. 2015, doi : 10.1002/14651858.CD007398.pub3.
- Costanzo MR, et al. : Ultrafiltration versus intravenous diuretics for patients hospitalized for acute decompensated heart failure, J Am Coll Cardiol 49(6) : 675-683, Feb. 2007, doi : 10.1016/j.jacc.2006.07.073.
- Pappalardo F, et al. : Concomitant implantation of Impella® on top of veno-arterial extracorporeal membrane oxygenation may improve survival of patients with cardiogenic shock, Eur J Heart Fail 19(3) : 404-412, Mar. 2017, doi : 10.1002/ejhf.668.
- Ammirati E, et al. : Indications actuelles pour la transplantation cardiaque et le dispositif d’assistance ventriculaire gauche : un point de vue pratique, Eur J Intern Med 25(5) : 422-429, Jun. 2014, doi : 10.1016/j.ejim.2014.02.006.
- Lund LH, et al : The Registry of the International Society for Heart and Lung Transplantation : Thirty-third Adult Heart Transplantation Report-2016 ; Focus Theme : Primary Diagnostic Indications for Transplant, J Heart Lung Transplant 35(10) : 1158-1169, Oct. 2016, doi : 10.1016/j.healun.2016.08.017.
- Lund LH, et al : The registry of the International Society for Heart and Lung Transplantation : thirty-first official adult heart transplant report–2014 ; focus theme : retransplantation, J Heart Lung Transplant 33(10) : 996-1008, Oct. 2014, doi : 10.1016/j.healun.2014.08.003.
- Barnard CN : L’opération. Une transplantation cardiaque humaine : un rapport intérimaire d’une opération réussie réalisée à l’hôpital Groote Schuur, Cape Town, S Afr Med J 41(48) : 1271-1274, Dec. 1967.
- Chambers DC, et al : The International Thoracic Organ Transplant Registry of the International Society for Heart and Lung Transplantation : Thirty-sixth adult lung and heart-lung transplantation Report-2019 ; Focus theme : Donor and recipient size match, J Heart Lung Transplant 38(10) : 1042-1055, Oct. 2019, doi : 10.1016/j.healun.2019.08.001.
- Office fédéral de la santé publique, OFSP : Chiffres sur le don et la transplantation d’organes en Suisse. [Online]. Disponible sur : www.bag.admin.ch/bag/de/home/zahlen-und-statistiken/zahlen-fakten-zu-transplantationsmedizin/zahlen-fakten-zur-spende-und-transplantation-von-organen.html#-1057919152.
- Hasin T, et al. : Changes in renal function after implantation of continuous-flow left ventricular assist devices, J Am Coll Cardiol 59(1) : 26-36, Jan. 2012, doi : 10.1016/j.jacc.2011.09.038.
- Mikus E, et al. : Reversibility of fixed pulmonary hypertension in left ventricular assist device support recipients, Eur J Cardiothorac Surg 40(4) : 971-977, Oct. 2011, doi : 10.1016/j.ejcts.2011.01.019.
- Harjola VP, et al : Contemporary management of acute right ventricular failure : a statement from the Heart Failure Association and the Working Group on Pulmonary Circulation and Right Ventricular Function of the European Society of Cardiology, Eur J Heart Fail 18(3) : 226-241, Mar. 2016, doi : 10.1002/ejhf.478.
- Whellan DJ, et al : End-of-life care in patients with heart failure, J Card Fail 20(2) : 121-134, Feb. 2014, doi : 10.1016/j.cardfail.2013.12.003.
- Rogers JG, et al. : Palliative Care in Heart Failure : The PAL-HF Randomized, Controlled Clinical Trial, J Am Coll Cardiol, vol. 70, no. 3, pp. 331-341, Jul. 2017, doi : 10.1016/j.jacc.2017.05.030.
- Bayoumi E, Sheikh F, Groninger H : Palliative care in cardiac transplantation : an evolving model, Heart Fail Rev 22(5) : 605-610, Sep. 2017, doi : 10.1007/s10741-017-9613-8.
CARDIOVASC 2020 ; 19(1) : 6-11