L’insuffisance cardiaque aiguë est une situation qui met la vie en danger et qui nécessite une action rapide et planifiée. Comment s’effectue la clarification ? Quelles sont les mesures thérapeutiques disponibles ? Un regard sur la stabilisation initiale à l’hôpital.
L’insuffisance cardiaque aiguë (IAH) est définie par l’apparition ou l’aggravation rapide de symptômes (souvent dyspnée et orthopnée) et/ou de signes cliniques.
Signes d’insuffisance cardiaque (en particulier congestion). Il s’agit d’une situation médicale mettant en jeu le pronostic vital, qui nécessite une évaluation et un traitement urgents, et souvent une hospitalisation [1].
Environ 80% des patients atteints d’IAH présentent une insuffisance cardiaque chronique préexistante. Plus de 50% ont une insuffisance cardiaque avec fraction d’éjection ventriculaire gauche préservée (“heart failure with preserved ejection fraction”, HFpEF) [2]. Chez plus de la moitié des patients, un déclencheur peut être identifié. La maladie coronarienne et la fibrillation auriculaire sont les maladies cardiaques sous-jacentes les plus courantes, et le diabète est une comorbidité très fréquente. La plupart des patients sont hypertendus ou normotendus à l’admission. Seuls 5 à 7% des IAH sont hypotoniques (pression systolique <90 mmHg), ce qui est associé à un pronostic défavorable. Cela est particulièrement vrai en cas d’hypoperfusion concomitante (périphérie froide) [3].
Diagnostic et évaluation pronostique initiale
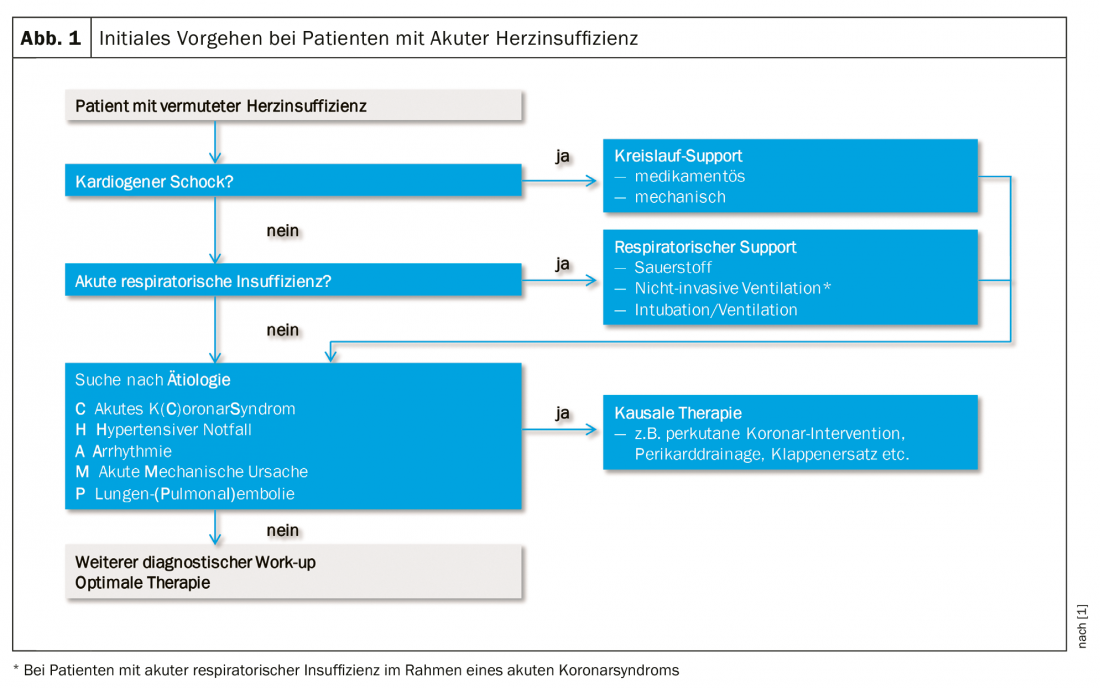
Le travail de diagnostic doit commencer le plus tôt possible (idéalement dans la phase préhospitalière, en particulier l’ECG), afin qu’un traitement causal puisse être mis en place rapidement. Le bénéfice d’un diagnostic et d’un traitement précoces a été très bien démontré pour l’IAH dans le contexte du syndrome coronarien aigu. Dans la gestion de l’IAH, le diagnostic et le traitement vont de pair, en recherchant systématiquement les conditions et les mécanismes qui mettent la vie en danger et en les traitant le plus rapidement possible. (Fig. 1). Une partie du travail immédiat consiste également à rechercher d’autres causes de dyspnée aiguë, principalement une pneumonie, une anémie sévère et une insuffisance rénale aiguë. Le diagnostic initial d’une suspicion d’IAH comprend, outre l’évaluation clinique du profil hémodynamique, les éléments diagnostiques suivants :
BNP ou NT-proBNP : un IAH peut être exclu pour des valeurs <100 ng/l ou <300 ng/l. Des valeurs élevées sont proportionnelles à l’ampleur du stress myocardique. Il faut savoir que plus les peptides natriurétiques sont élevés, plus le pronostic est défavorable.
ECG à 12 dérivations : des valeurs normales à l’ECG rendent l’IAH improbable. L’ECG peut en outre donner des indications sur le mécanisme de l’insuffisance cardiaque (infarctus aigu, bradycardie, tachycardie).
Radiographie du thorax : elle permet de déterminer s’il y a une congestion veineuse pulmonaire, des épanchements pleuraux, un œdème interstitiel ou alvéolaire ou une cardiomégalie. Il sert également à rechercher les causes non cardiaques de la dyspnée aiguë, comme la pneumonie ou le pneumothorax.
Divers paramètres de laboratoire : Les marqueurs tels que l’hémoglobine, la TSH, la CRP, la créatinine et les transaminases permettent d’étudier les mécanismes et les co-facteurs ainsi que les effets de l’IAH. La troponine cardiaque est également un paramètre, mais elle doit être considérée comme un marqueur quantitatif non spécifique de l’atteinte myocardique et pas toujours comme une indication d’infarctus aigu.
Echocardiographie : elle doit être réalisée dans les 24 à 48 heures chez tous les patients IAH si la pathologie cardiaque n’est pas ou insuffisamment connue. En revanche, les patients en choc cardiogénique ont besoin d’une échocardiographie immédiate, notamment en ce qui concerne les problèmes mécaniques à traiter en urgence, tels que les complications mécaniques de l’infarctus et l’insuffisance valvulaire aiguë sévère.
Le profil hémodynamique comme point de départ
Si un traitement causal est possible (notamment en cas de syndrome coronarien aigu, d’urgence hypertensive, de tachycardie ou de bradycardie, d’embolie pulmonaire aiguë et de complication mécanique de l’infarctus), il doit être administré le plus tôt possible. Dans le cas contraire, un traitement de soutien général sera mis en place en fonction du profil clinique et hémodynamique [1,4]. Ces mesures de soutien sont établies sur la base de l’expérience clinique, mais n’ont pas d’effet prouvé sur le pronostic [5]. Il n’existe toujours pas de médicament dont l’administration en phase aiguë réduirait la mortalité à court ou à long terme. L’objectif de ces mesures est une amélioration rapide des symptômes et une stabilisation clinique, de sorte que le traitement de l’insuffisance cardiaque chronique puisse être établi. Les formes de traitement de l’IAH peuvent être divisées en mesures aiguës, mesures pendant l’hospitalisation et mesures avant la sortie. Cet article se concentre sur le diagnostic et les mesures initiales de stabilisation pendant l’hospitalisation. Selon le degré de gravité, le traitement initial est effectué dans le service des urgences/service normal ou dans le service des urgences/unité de soins intensifs, avec un monitoring invasif si nécessaire.
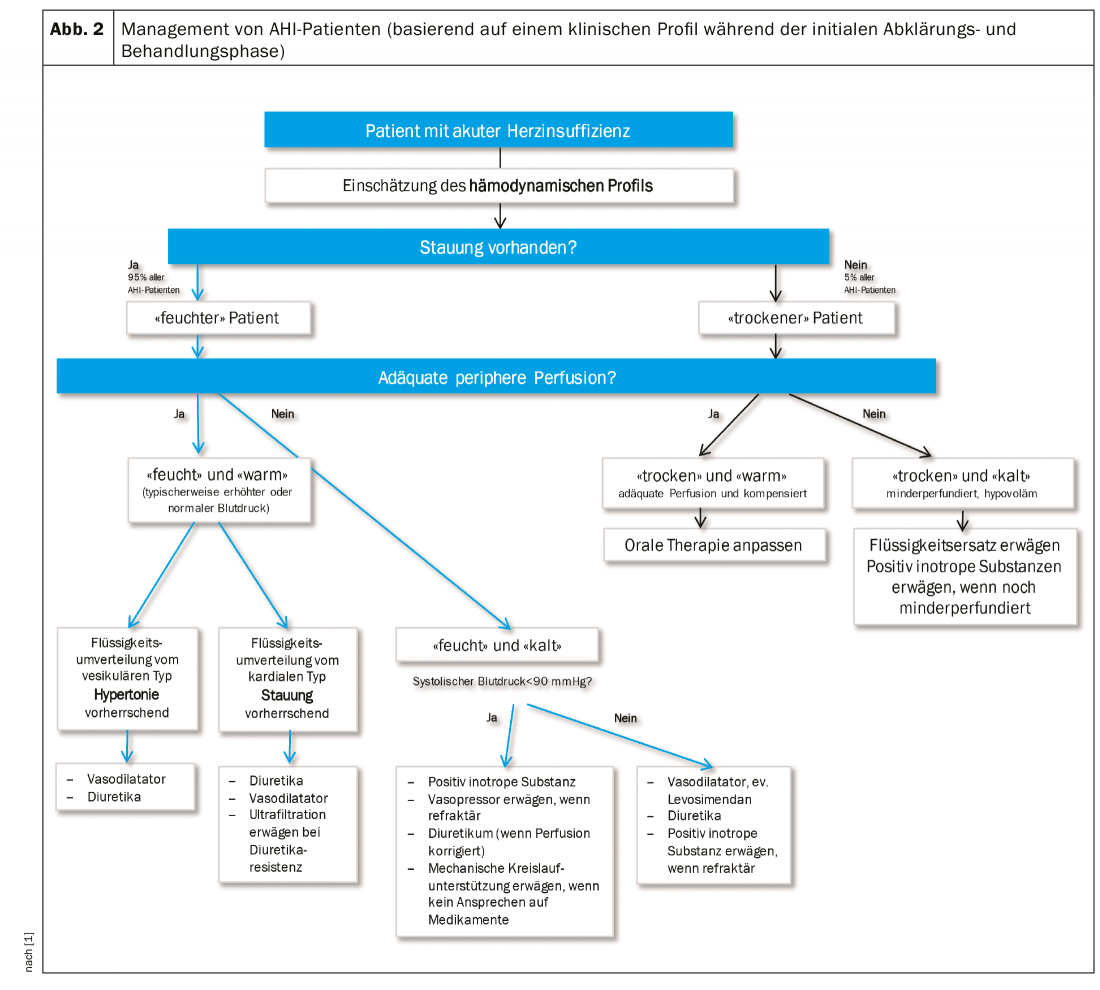
Sur la base de l’état d’hydratation (“wet” ou “dry”) et de la perfusion tissulaire (“warm” ou “cold”, souvent synonyme de normotonique vs. hypotonique), il est possible de distinguer quatre profils hémodynamiques qui indiquent l’orientation générale du traitement (fig.2).
Mesures générales
L’administration d’oxygène doit être limitée aux patients présentant une hypoxémie (SpO2 <90%). Une ventilation non invasive (CPAP/BiPAP) doit être envisagée en cas de dyspnée ou d’hypoxémie prononcée (fréquence respiratoire >25/min, SpO2 <90%) et doit être commencée le plus tôt possible afin d’éviter l’intubation. Si une intubation ou une électrocardioversion s’avère nécessaire, la prudence est de mise en cas de sédation au propofol (risque d’hypotension, de cardiodépression). La sédation au midazolam pose moins de problèmes, car les effets secondaires cardiaques sont moins nombreux.
Thérapie médicamenteuse
En cas d’aggravation aiguë d’une insuffisance cardiaque chronique préexistante, le traitement médicamenteux préexistant par inhibiteur de l’ECA, antagoniste des récepteurs de l’angiotensine ou sacubitril-valsartan, bêtabloquant et antagoniste des récepteurs des minéralocorticoïdes doit en principe être poursuivi. En cas d’hypotension (pression artérielle systolique<85 mmHg), une réduction de la dose ou une interruption temporaire du traitement de l’insuffisance cardiaque par voie orale doit être effectuée. L’aperçu suivant du traitement médicamenteux de l’insuffisance cardiaque se veut un schéma qui doit être adapté à la situation individuelle des patients souffrant d’insuffisance cardiaque.
Nitrates/vasodilatateurs : Tous les vasodilatateurs ont une double action de réduction du tonus veineux (précharge du cœur) et du tonus artériel (réduction de la postcharge). Les vasodilatateurs sont contre-indiqués en cas de pression artérielle systolique <90 mmHg. Une utilisation très prudente est en outre indiquée en cas de sténose significative des valves mitrale et aortique. L’administration continue de nitrates peut entraîner le développement d’une tolérance.
L’administration perorale de nitroglycérine se fait initialement en deux bouffées de nitroglycérine de 0,4 mg ou une gélule de 0,8 mg. Des répétitions après 5 à 10 minutes sont autorisées, mais la pression artérielle doit être contrôlée. Au cours de l’évolution, il est possible de passer à une application transdermique (5-10 mg).
Les vasodilatateurs intraveineux (nitroglycérine, dinitrate d’isosorbide, nitroprussiate ou nesiritide) réduisent très efficacement la dyspnée sous monitoring dans les unités de soins intermédiaires ou intensifs dans la pratique, bien qu’il n’existe aucune preuve scientifique à ce jour [6].
Diurétiques : Dans les directives actuelles, le diurétique est le médicament de premier choix pour le traitement de l’IAH [7]. Mais cela ne s’applique qu’aux patients présentant une surcharge volumique, en premier lieu au patient “chaud et humide” et au patient “froid et humide”, si la pression artérielle systolique >est de 90 mmHg. Si c’est d’abord un dérapage hypertensif qui a entraîné une décompensation cardiaque gauche, le diurétique doit, si possible, être abandonné au profit du nitrate.
L’approche initiale du traitement de la surcharge volumique consiste en une combinaison de diurétiques et de vasodilatateurs, si la pression artérielle le permet (>90 mmHg). Une surveillance étroite de l’état d’hydratation par le contrôle de la clinique (c’est-à-dire le remplissage des veines du cou, la congestion pulmonaire, l’œdème périphérique, le poids corporel) et du laboratoire (potassium et créatinine sériques) est nécessaire [6]. L’encadré présente un résumé des lignes directrices de dosage.

Inotropes/vasopresseurs : les médicaments présentant une vasoconstriction périphérique prononcée, tels que la noradrénaline ou la dopamine à des doses plus élevées (>5 µg) peuvent être envisagés pour une utilisation à court terme dans la situation aiguë, en cas de perfusion tissulaire insuffisante malgré un état de remplissage adéquat, afin d’alimenter les organes vitaux. Mais cela se fait au prix d’une augmentation de la postcharge et d’un risque accru d’arythmie. Comme alternative, le lévosimendan peut être utilisé pour les valeurs de pression systolique >85 mmHg. Pour plus de détails sur la posologie, consultez la directive européenne sur l’IAH [1].
Bêta-bloquant/Digoxine : en cas d’aggravation aiguë d’une insuffisance cardiaque chronique préexistante avec un traitement bêtabloquant établi, le bêtabloquant ne doit pas être complètement arrêté, si possible, mais sa dose doit être temporairement réduite. Pour le traitement de l’insuffisance cardiaque aiguë, la réutilisation d’un bêtabloquant n’est indiquée que dans des cas exceptionnels, par exemple en cas d’obstruction dynamique intraventriculaire. L’administration d’un bêtabloquant pour contrôler la fréquence cardiaque (en particulier par voie intraveineuse) sans connaître la fonction du VG peut provoquer un choc cardiogénique. Toutefois, en cas de fibrillation auriculaire tachycardique et de fonction systolique du VG préservée à l’échocardiographie, le bêtabloquant peut être administré pour contrôler la fréquence. La digoxine est également une option pour le contrôle de la fréquence en cas de fibrillation auriculaire, même si la FEVG est limitée.
Prophylaxie thromboembolique, anticoagulation, inhibition de l’agrégation plaquettaire : une prophylaxie thromboembolique, en premier lieu avec une héparine de bas poids moléculaire, est clairement recommandée pour réduire le risque de thrombose/embolie pulmonaire. En cas de fibrillation/flutter auriculaire et de syndrome coronarien aigu, les directives existantes en matière d’anticoagulation et de traitement antithrombotique s’appliquent.
Antiarythmiques/cardioversion : en cas d’IAH principalement due à une tachycardie, on peut utiliser – outre une cardioversion électrique – comme médicaments antiarythmiques l’amiodarone, la digoxine et (si l’on sait que la fonction VG est préservée) les bêtabloquants. Si une fibrillation auriculaire tachycardique est mal tolérée sur le plan hémodynamique, il peut être nécessaire de la convertir immédiatement (électroconversion). Il est également possible d’effectuer une saturation avec de l’amiodarone en vue d’une électroconversion réussie et d’un effet durable pendant un à trois jours. Les antiarythmiques de classe IB/C sont contre-indiqués en cas de dysfonctionnement du VG [8,11].
Opiacés, anxiolytiques et sédatifs : les opiacés peuvent être envisagés pour une utilisation prudente chez les patients anxieux présentant une agitation sévère et une dyspnée. Toutefois, une éventuelle hypopnée doit être détectée précocement par une surveillance adéquate. L’utilisation prudente de benzodiazépines (diazépam, lorazépam) est une alternative aux opiacés chez les patients agités.
Autres options thérapeutiques
Procédures de remplacement rénal : L’implication précoce des néphrologues est importante pour les patients dont la fonction rénale se détériore dans le cadre de l’IAH. Le recours à une procédure de remplacement rénal, défini de manière interdisciplinaire, est limité aux patients IAH “chauds et humides” qui ne répondent pas ou pas suffisamment à un traitement diurétique. Les critères suivants sont mentionnés dans les directives européennes actuelles : Oligurie sans réponse adéquate aux doses les plus élevées de diurétiques, potassium sérique >6,5 mmol/l, urée sérique >25 mmol/l, créatinine sérique >300 µmol/l et pH <7,2 [1].
Options de traitement mécanique : L’approche dépend de la situation clinique et de la cause postulée de l’IAH. En cas d’ischémie sévère avec choc cardiogénique, le vaisseau responsable de l’ischémie aiguë est traité en premier lieu par intervention coronarienne percutanée. Des résultats récents montrent que la prise en charge immédiate de tous les vaisseaux coronaires n’améliore pas le résultat [9]. L’utilisation de dispositifs d’assistance circulatoire (pompe à ballonnet intra-aortique, dispositifs d’assistance ventriculaire) doit être discutée et définie au sein de l’équipe de cardiologie, avec la participation des urgentistes et des médecins de soins intensifs.
L’indication conventionnelle de la pompe à ballonnet intra-aortique (PIA) est avant la correction chirurgicale de problèmes mécaniques aigus spécifiques (en cas d’insuffisance valvulaire mitrale aiguë sévère, éventuellement en cas de rupture du septum ventriculaire) et en cas de NSTEMI avec maladie des trois vaisseaux la plus sévère, en vue d’une prise en charge urgente par la chirurgie cardiaque. Pour les autres causes de choc cardiogénique, il n’existe pas de bonnes preuves scientifiques du bénéfice de l’IABP. Les dispositifs d’assistance ventriculaire et d’autres formes d’assistance mécanique sont utilisés soit comme “bridge-to-decision”, soit à plus long terme chez des patients sélectionnés [1]. L’avis interdisciplinaire de l’ensemble de l’équipe de cardiologie ou d’endocardite doit être sollicité rapidement afin de déterminer le moment adéquat pour une intervention chirurgicale cardiaque en cas d’endocardite. La mise en place d’une VA-ECMO chez les patients en état de choc cardiogénique, en particulier chez les patients atteints d’insuffisance cardiaque. après réanimation avec un “no-flow time” relativement court, devrait également être discutée tôt et de manière interdisciplinaire, avec la participation des urgentistes et des réanimateurs.
Ponction de la plèvre et de l’ascite : une ponction pleurale peut entraîner une diminution rapide de la dyspnée. La ponction d’ascite peut contribuer, via une diminution de la pression intra-abdominale, à une amélioration de la pression transrénale et indirectement à une amélioration de la fonction rénale [10].
Messages Take-Home
- L’insuffisance cardiaque aiguë est la première manifestation d’une maladie cardiaque dans environ 20% des cas. Le plus souvent, elle est l’expression d’une aggravation aiguë d’une insuffisance cardiaque chronique.
- Il s’agit d’une situation qui met la vie en danger et qui nécessite une action rapide et structurée.
- Les mesures thérapeutiques s’orientent sur le profil hémodynamique, en évaluant d’une part la perfusion (“warm” vs. “cold”) et d’autre part l’état de congestion (“wet” vs. “dry”).
- Chez les patients présentant une dyspnée aiguë et une suspicion d’insuffisance cardiaque aiguë, la mesure des peptides natriurétiques aide au diagnostic différentiel. De plus, elle donne des informations pronostiques (recommandation de classe IA).
Littérature :
- Ponikowski P, Voors AA, Anker S, et al : 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. Eur Heart J 2016 ; 37 : 2129-2200.
- Maeder MT, Buser M, Rickli H, et al. : Insuffisance cardiaque avec fonction ventriculaire gauche préservée (HFpEF). Therapeutische Umschau 2018 ; 75 : 161-169.
- Ambrosy AP, Fornarow GC, Butler J, et al : The global health and economic burden of hospitalizations for heart failure : lessons learned from hospitalized heart failure registries. J Am Coll Cardiol 2014 ; 63 : 1123-1133.
- Nohria A, Tsang SW, Fang JC, et al : L’évaluation clinique identifie les profils hémodynamiques qui prédisent les résultats chez les patients admis pour une insuffisance cardiaque. J Am Coll Cardiol 2003 ; 41 : 1797-1804.
- Cheema B, Ambrosy AP, Kaplan RM, et al : Lessons learned in acute heart failure. Eur J Heart Failure 2018 ; 20 : 630-641.
- Wakai A, McCabe A, Kidney R, et al : Nitrates for acute heart failure syndromes. Cochrane Database Syst Rev 2013 ; 8 : CD005151.
- Felker GM, Lee KL, Bull DA, et al : Stratégies diurétiques chez les patients souffrant d’insuffisance cardiaque aiguë décompensée. N Engl J Med 2011 ; 364 : 797-805.
- Lignes directrices ERC pour la réanimation 2015. Resuscitation 2015 ; 95 : 1-80.
- Thiele H, Akin I, Sandri M, et al : one-year outcomes after PCI strategies in cardiogenic shock. N Engl J Med 2018 ; doi : 10.1056/NEJMoa1808788 (Epub ahead of print).
- Mullens W, Abrahams Z, Francis GS, et al : Prompt reduction in intra-abdominal pressure following large-volume mechanical fluid removal improves renal insufficiency in refractory decompensated heart failure. J Card Fail 2008 ; 14 : 508-514.
PRATIQUE DU MÉDECIN DE FAMILLE 2019 ; 14(8) : 9-13