Les embolies pulmonaires aiguës sont la troisième cause de décès par maladie cardiovasculaire. Le dosage des D-dimères est très sensible pour exclure une embolie pulmonaire aiguë. L’angiographie par scanner permet aujourd’hui de poser le diagnostic. Après une stratification des risques, le choix de la stratégie de traitement est effectué. Les patients à haut risque nécessitent un traitement agressif, tandis que les patients à faible risque peuvent éventuellement être traités en ambulatoire. La durée de l’anticoagulation dépend de la présence de facteurs provocateurs, du risque de saignement et de la détection éventuelle d’une coagulation activée persistante après l’arrêt de l’anticoagulation. Parmi les nouveaux anticoagulants, le rivaroxaban est autorisé en Suisse comme traitement préventif des récidives.
Parmi les maladies cardiovasculaires, les embolies pulmonaires sont la troisième cause de décès après l’infarctus du myocarde et l’accident vasculaire cérébral. Dans les études de registre, on constate une mortalité à 90 jours comprise entre 8,6 et 17% [1, 2]. Les facteurs de risque de mortalité élevée sont l’âge >70 ans, une maladie tumorale, une insuffisance cardiaque, une broncho-pneumopathie chronique obstructive (BPCO), une hypertension artérielle, une tachypnée et une hypokinésie ventriculaire droite à l’échocardiographie.
Chez 2 à 4 % des patients, une hypertension pulmonaire thromboembolique chronique est observée après une embolie pulmonaire aiguë. Cette maladie est définie comme une pression artérielle pulmonaire moyenne supérieure à 25 mmHg, qui persiste pendant plus de 6 mois après le diagnostic d’une embolie pulmonaire aiguë [3].
Diagnostic
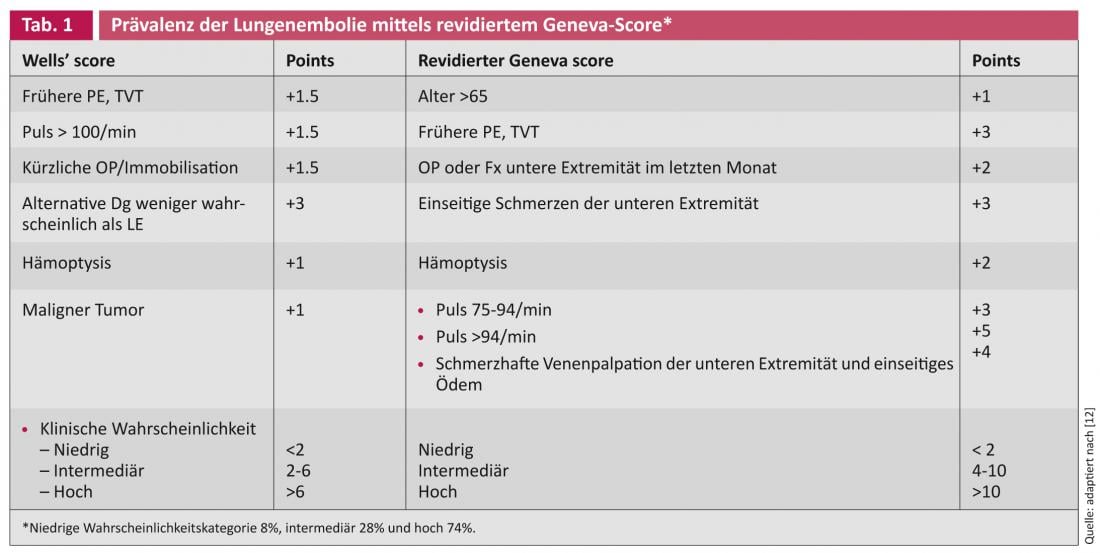
Les patients suspectés d’embolie pulmonaire aiguë doivent être classés en niveaux de suspicion élevés (60-80%), moyens (20-30%) ou faibles (5-10%) en fonction de la situation clinique. Si la probabilité est faible, un test de D-dimères normalisé suffit à l’exclure. Les patients dont la probabilité est moyenne ou élevée ont besoin d’un traitement anticoagulant jusqu’à l’obtention des résultats. Pour évaluer la probabilité, il faut connaître les antécédents médicaux, les symptômes, la saturation en oxygène et l’ECG. Elle peut être effectuée de manière empirique ou au moyen de scores – les plus connus sont le score de Wells et le score révisé de Geneva [4].
D-Dimer
Les D-dimères sont un produit de dégradation de la fibrine réticulée et sont élevés, entre autres, en cas d’accident thromboembolique veineux aigu. Analysé par ELISA quantitatif ou par des tests turbidimétriques automatisés, le dosage des D-dimères est très sensible (>95%) pour exclure une embolie pulmonaire aiguë. Chez les patients présentant une faible probabilité clinique et des D-dimères négatifs, le risque à 3 mois d’un événement thromboembolique est très faible, à environ 0,1%. Cependant, la spécificité des D-dimères n’est pas très élevée, en particulier pour les patients à forte probabilité clinique, les patients adressés pour d’autres raisons, >65 ans et les femmes enceintes. Des seuils de D-dimères adaptés à l’âge pourraient augmenter la pertinence, mais des validations prospectives sont encore nécessaires.
Par exemple, une étude internationale a montré une meilleure discrimination par les D-dimères chez les patients de plus de 50 ans et à faible probabilité clinique avec un seuil de (âge du patient x10) µg/l contre 500 µg/l fixe [5].
Angiographie par scanner
L’angiographie TDM multidétecteur est plus sensible que l’angiographie TDM “monodétecteur” et a supplanté la scintigraphie pulmonaire de ventilation et de perfusion dans la majorité des cas. Le risque d’irradiation doit être pris en compte, en particulier chez les femmes enceintes ; chez ces patients, les avantages de l’angiographie par scanner par rapport à la scintigraphie pulmonaire restent controversés.
Angiographie conventionnelle
Les angiographies pulmonaires conventionnelles restent le gold standard pour le diagnostic de l’embolie pulmonaire. En raison de son caractère invasif, cette méthode ne doit être utilisée que chez les patients pour lesquels une suspicion de haut niveau n’a pas pu être confirmée ou pour lesquels un traitement endovasculaire est prévu.
Traitement
Chez les patients présentant une embolie pulmonaire aiguë, une évaluation du pronostic doit être effectuée ; le “Pulmonary Embolism Severity Index” ou sa version simplifiée permet de le faire sur la base de la clinique [6].
Pour le traitement des embolies pulmonaires aiguës, les points suivants doivent être pris en compte :
– Patients à haut risque :
- environ 5% de tous les patients symptomatiques
- Mortalité de 15% en phase aiguë
- doivent être traités de manière agressive par thrombolyse, chirurgie ou par cathéter [7].
– Patients à faible risque :
- majorité de tous les patients
- Mortalité en phase aiguë d’environ 1%.
- Peuvent éventuellement être traités en hospitalisation courte ou même en ambulatoire
– Risque d’intermédiation :
- Touche environ 30% des patients symptomatiques
- Traitement en milieu hospitalier
- Bénéfice incertain concernant la thrombolyse
L’échocardiographie, les mesures de la troponine ou du peptide natriurétique pro-cérébral (pro-BNP) peuvent permettre d’affiner la stratification du risque, mais leur rentabilité n’est pas encore établie.
Une étude multicentrique menée en Suisse, en France, en Belgique et aux États-Unis n’a pas montré de différence significative en termes de récidive et de taux de saignement par rapport au traitement hospitalier chez des patients présentant une embolie pulmonaire aiguë symptomatique, à faible risque de mortalité (pulmonary embolism severity index risk class I or II) et traités en ambulatoire par énoxaparine par voie sous-cutanée pendant au moins 5 jours, suivie par des antagonistes de la vitamine K [8].

En phase aiguë, il existe l’héparine non fractionnée, les héparines de bas poids moléculaire (HBPM), le fondaparinux et, plus récemment, le rivaroxaban.
Les héparines agissent en se liant à l’anticoagulant naturel antithrombine, ce qui entraîne une inactivation massivement accélérée de la thrombine par l’antithrombine. En raison des grandes différences individuelles dans la liaison de l’héparine aux protéines plasmatiques, la posologie doit être surveillée et adaptée au moyen de tests de coagulation. Cela peut se faire par le biais de l’aPTT, du temps de thrombine, de l’activité anti-FXa.
Le principal avantage de la NMH administrée par voie sous-cutanée est le dosage fixe adapté au poids, dans la plupart des cas sans nécessité de monitoring. Le mécanisme d’action est le même que celui de l’héparine non fractionnée, mais avec un effet plus important également sur le FXa. L’équivalence clinique de l’héparine non fractionnée et de l’HNM a été démontrée dans une étude [9]. Le fondaparinux, un pentasaccharide synthétique, est équivalent à l’héparine non fractionnée et à l’HNM à la dose de 7,5 mg/j chez les patients souffrant d’embolie pulmonaire.
L’HNM et le fondaparinux sont principalement éliminés par voie rénale, la prudence est donc de mise en cas d’insuffisance rénale avec une clairance <30 ml/min. Dans une telle situation, les alternatives sont la réduction des doses, des intervalles plus longs, la mesure de l’activité anti-FXa ou l’utilisation d’héparine non fractionnée . Les patients atteints d’une tumeur maligne doivent être traités par NMH pendant au moins 3 mois. Lors du passage à un antagoniste de la vitamine K, le chevauchement avec l’HNM ou l’héparine non fractionnée doit durer au moins 5 jours et être interrompu lorsque l’INR atteint 2,0.
Tous les anticoagulants peuvent provoquer des saignements. Les saignements importants associés aux antagonistes de la vitamine K augmentent avec l’âge. Aujourd’hui, des scores cliniques sont validés pour évaluer le risque de saignement (score RIETE, score HEMORR2HAGES).
Lors du choix de la durée de l’anticoagulation, le risque de récidive thromboembolique doit être mis en balance avec le risque de saignement sous anticoagulation. Les 8e ACCP consensus guidelines recommandent généralement un traitement d’au moins 3 mois. Cela est particulièrement vrai pour les patients ayant subi un événement provoqué et chez qui le facteur provocateur a été éliminé entre-temps. Chez les patients présentant des événements idiopathiques, un traitement prolongé peut être discuté si l’évaluation du rapport bénéfice/risque est positive. En cas de tumeur maligne, l’anticoagulation doit être poursuivie jusqu’à ce que la tumeur soit contrôlée ou guérie. Au cours des dernières années, une approche individualisée a été adoptée. Ainsi, une étude mesurant les D-dimères 4 semaines après l’arrêt de l’anticoagulation a montré qu’une stratification du risque était possible ; risque faible si les D-dimères sont normaux, aucun traitement supplémentaire n’est nécessaire, ou risque élevé (15% de récidives après 18 mois) si les D-dimères sont élevés, avec la recommandation de reprendre l’anticoagulation pendant 12 mois supplémentaires [10].
Plusieurs nouveaux anticoagulants sont en cours de développement ou déjà autorisés. Ces inhibiteurs directs de la FXa (rivaroxaban, apixaban) ou de la thrombine (dabigatran), indépendants de l’antithrombine, peuvent remplacer les héparines et les antagonistes de la vitamine K chez de nombreux patients. Ces médicaments sont administrés à dose fixe et ne nécessitent généralement pas de surveillance de la coagulation. L’étude Einstein-PE a montré que le rivaroxaban à la posologie standard (2×15 mg pendant 3 semaines suivis de 20 mg 1x/d) n’était pas inférieur à l’énoxaparine suivie d’antagonistes de la vitamine K pendant 3, 6 ou 12 mois. A taux de récidive égal, les saignements ont été significativement moins importants [11]. Toutefois, seul le rivaroxaban est autorisé en Suisse à ce jour, et uniquement pour la prophylaxie des récidives d’embolie pulmonaire.
Conclusion pour la pratique
- En cas de suspicion d’embolie pulmonaire aiguë, une évaluation clinique de la probabilité permet de poursuivre les investigations.
- Les D-dimères ont une sensibilité élevée et une valeur prédictive négative et peuvent exclure une embolie pulmonaire aiguë en cas de faible probabilité clinique.
- Pour le traitement, les patients sont répartis en groupes de risque ; les patients à haut risque doivent être traités rapidement de manière agressive, les patients à faible risque peuvent éventuellement être traités en ambulatoire.
- Le traitement fait appel à des héparines (non fractionnées ou NMH) suivies d’antagonistes de la vitamine K ; aucune de ces nouvelles substances n’est actuellement autorisée en Suisse pour le traitement aigu de l’embolie pulmonaire, mais la prévention des récidives peut être assurée par le rivaroxaban.
Dr. med. Thomas Lehmann
Prof. Dr. med. Wolfgang Korte
Littérature :
- Goldhaber SZ, et al : Acute pulmonary embolism : clinical outcomes in the International Cooperative Pulmonary Embolism Registry (ICOPER). Lancet 1999;353:1386-1389.
- Laporte S, et al : Clinical predictors for fatal pulmonary embolism in 15 520 patients with venous thromboembolism : findings from the Registro Informatizado de la Enfermedad TromboEmbolica venosa (RIETE) Registry. Circulation 2008;117:1711–1716.
- Piazza G, Goldhaber SZ : Hypertension pulmonaire thromboembolique chronique. N Engl J Med 2011;364:351-360.
- Ceriani E, et al : Clinical prediction rules for pulmonary embolism : a systematic review and meta-analysis. J Thromb Haemost 2010;8:957-970.
- Douma RA, et al : Potential of an age adjusted D-Dimer cut-off value to improve the exclusion of pulmonary embolism in older patients : a retrospective analysis of three large cohort. BMJ 2010;340:c1475.
- Torbicki A, et al : Guidelines on the diagnosis and management of acute pulmonary embolism : the Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC). Eur Heart J 2008;29:2276-2315.
- Kucher N, et al : Embolie pulmonaire massive. Circulation 2006;113:577-582.
- Aujesky D, et al : Outpatient versus inpatient treatment for patients with acute pulmonary embolism : an international, open-label, randomised, non-inferiority trial. The Lancet 2011;378:41-48.
- Simonneau G, et al : A comparison of low-molecular-weight heparin with unfractionated heparin for acute pulmonary embolism. N Engl J Med 1997;337:663-669.
- Palareti G, et al : Test des D-dimères pour déterminer la durée du traitement anticoagulant. N Engl J Med 2006;355:1780-1789.
- Büller HR, et al : Oral rivaroxaban for the treatment of symptomatic pulmonary embolism. N Engl J Med 2012;366:1287-97.
- Le Gal G, et al : Prediction of pulmonary embolism in the emergency department : the revised Geneva score. Ann Intern Med. 2006;144:165-171.











