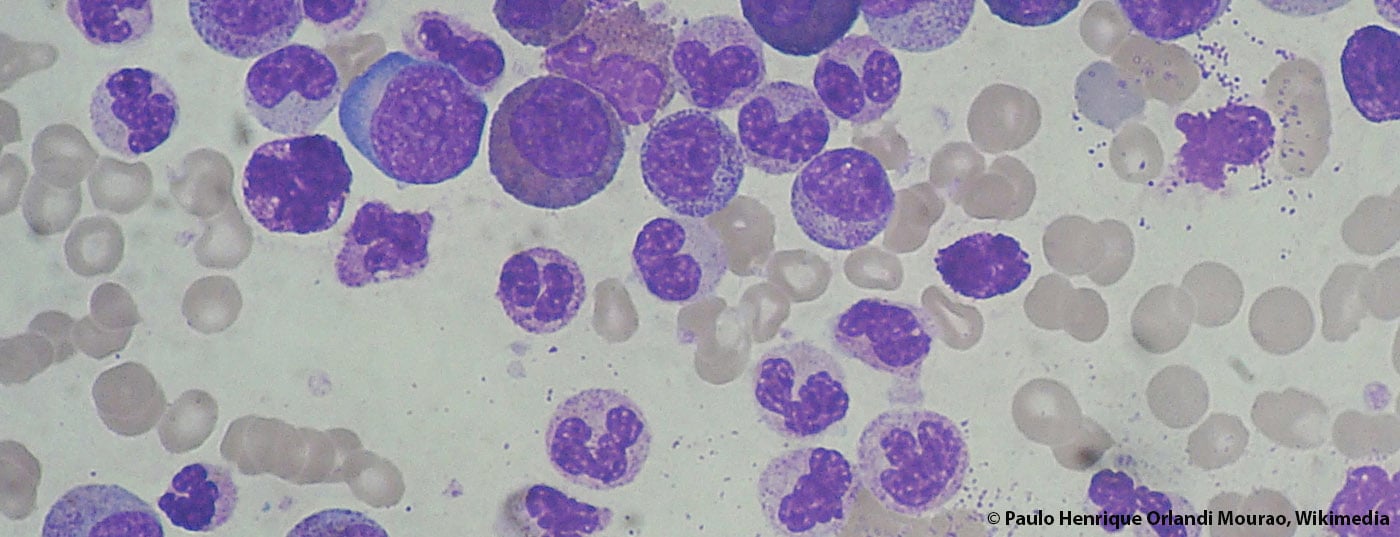
Dans le domaine de la leucémie myéloïde chronique (LMC), les choses ont beaucoup évolué ces dernières années. Les taux de réponse et de survie ont fortement augmenté, on parle même de guérison pour certains patients. Un supplément des Annals of Hematology sur la LMC vient d’être publié et offre un large aperçu de l’état du diagnostic et du traitement en 2015.
Selon différents registres européens, l’incidence de la leucémie myéloïde chronique (LMC) est restée stable ces dernières années. Le taux annuel est de 0,7-1,0/100’000. En moyenne, l’âge au premier diagnostic est de 57 à 60 ans. Les données de prévalence exactes ne sont pas connues – on estime que les chiffres se situent autour de 10-12/100 000 habitants, mais on observe une augmentation constante dans ce domaine en raison de la forte amélioration des taux de survie. Cela représente un défi majeur pour les systèmes de santé, car les coûts des traitements par inhibiteurs de tyrosine kinase (ITK) sont élevés. A cet égard, il est intéressant de voir comment le marché des génériques va évoluer. Le brevet de l’imatinib expire l’année prochaine.
Le traitement s’est considérablement amélioré
Le champ thérapeutique dans le domaine de la LMC évolue rapidement. Les taux de survie ont fortement augmenté ces dernières années et l’objectif du traitement se déplace de plus en plus de la palliation vers la guérison. Les patients qui répondent aux ITK ont désormais une survie globale presque aussi bonne que celle de la population saine. Dans certains cas, la réponse est telle qu’il est possible d’arrêter le traitement. Il est donc d’autant plus important de développer des concepts et des études pour la rémission sans traitement.
Quel choix a-t-on aujourd’hui en première, deuxième et troisième ligne ?
Il est indéniable que l’imatinib a constitué une révolution dans le traitement de la LMC. Toutefois, la question de savoir si la dose habituelle de 400 mg convient à tous les patients pour obtenir un résultat optimal fait actuellement l’objet de discussions. Plusieurs études ont donc examiné le bénéfice potentiel d’un traitement par imatinib modifié ou l’utilisation d’un ITK de deuxième génération en première ligne. Certaines approches encore expérimentales avec un traitement par imatinib à haute dose (800 mg) ou à dose adaptée, ou encore l’association avec l’interféron, ont montré une meilleure réponse cytogénétique et moléculaire qu’avec la variante standard – mais sans bénéfice à ce jour en termes de survie sans progression (PFS) ou de survie globale (OS). De plus, le dasatinib et le nilotinib ont été approuvés en première ligne, ce qui a élargi les possibilités de traitement de la LMC nouvellement diagnostiquée. Ces deux agents induisent une réponse moléculaire très rapide et persistante.
Les ITK de deuxième génération, le dasatinib, le nilotinib ainsi que le bosutinib, sont très probablement efficaces en deuxième ligne également. Leur efficacité est globalement comparable, c’est pourquoi les médecins doivent avant tout tenir compte du profil de mutation de BCR-ABL1 et de l’histoire de la maladie dans la décision thérapeutique : En l’absence de mutation ou en présence d’une mutation qui répond bien à ces agents, la décision doit être prise en fonction de l’historique de la maladie. En revanche, si l’on est en présence de l’une des rares mutations de BCR-ABL1 qui ne répondent bien à aucun des agents, il convient de choisir l’ITK qui a montré une activité clinique contre la mutation spécifique. Chez les patients présentant des mutations T315I ou après l’échec du nilotinib ou du dasatinib, l’ITK de troisième génération ponatinib est une option, bien que son dosage optimal soit encore à l’étude.
Dans l’ensemble, il a été démontré que l’évaluation de la réponse moléculaire et cytogénétique permettait de stratifier le risque pronostique des patients dès trois mois sous traitement. La réponse précoce aux ITK est donc liée de manière décisive au résultat à long terme. Cela a été démontré dans plusieurs études, tant pour l’imatinib que pour les ITK de deuxième génération et également pour le traitement de deuxième ligne. Si un patient sous un TKI donné présente un échec précoce du traitement, on peut supposer que l’issue est défavorable, ce qui rend d’autant plus important un changement de traitement en temps utile.
Examiner toutes les options de traitement
Dans tous les cas, les avantages et les inconvénients d’un traitement par ICT à long terme doivent être comparés à ceux de la transplantation de cellules souches allogéniques (TCSH). En effet, bien que cela reste une option en tant que traitement de deuxième et troisième ligne dans la première phase chronique de la LMC, le taux de transplantation a considérablement baissé depuis l’introduction des ITK (les taux ont moins baissé pour l’indication en tant que traitement de sauvetage dans la maladie avancée).
Certains auteurs de ce numéro des Annals of Hematology critiquent la prise en compte primaire du risque de maladie (défini comme l’échec du traitement par ITK) dans la décision de transplantation : ils proposent une approche plus équilibrée qui, outre le risque de maladie, prend en compte le risque de transplantation et les aspects économiques. La TCSH devrait être intégrée à l’algorithme thérapeutique dès le diagnostic initial. Très tôt après le premier échec du traitement par ITK, une TCSH doit être évaluée dans la mesure où les patients concernés présentent un risque élevé de maladie, mais un risque faible de transplantation. Inversement, la TCSH doit être utilisée de manière restrictive chez les patients dont la maladie est très avancée et qui présentent un risque élevé de transplantation, et éventuellement uniquement dans le cadre d’un essai.
Effets secondaires sous TKI
D’une part, la plupart des patients tirent un bénéfice considérable des ITK, mais d’autre part, en raison de la survie à long terme désormais atteinte, les effets secondaires font l’objet d’une attention accrue. Les personnes qui doivent être traitées toute leur vie avec de telles substances actives ne s’intéressent pas seulement à l’efficacité, mais aussi à la tolérance.
Dans l’ensemble, les ITK ont un profil de sécurité relativement bon dans la pratique clinique, car si de nombreux effets secondaires légers à modérés surviennent, ils sont généralement limités au début du traitement et sont facilement contrôlables par la suite, voire disparaissent spontanément. Actuellement, des questions restent toutefois en suspens concernant la sécurité à long terme – notamment en ce qui concerne les nouvelles générations d’ITK. Par exemple, il a été récemment démontré que ces nouveaux agents exercent dans certains cas des effets négatifs et irréversibles sur des organes tels que le cœur et les poumons, en particulier en cas de comorbidité. Le choix de l’ITK approprié nécessite donc un examen précis des paramètres de la maladie, du patient et de la substance active.
Source : Annals of Hematology 2015 ; 94(2).
InFo ONKOLOGIE & HÄMATOLOGIE 2015 ; 3(5) : 22-24