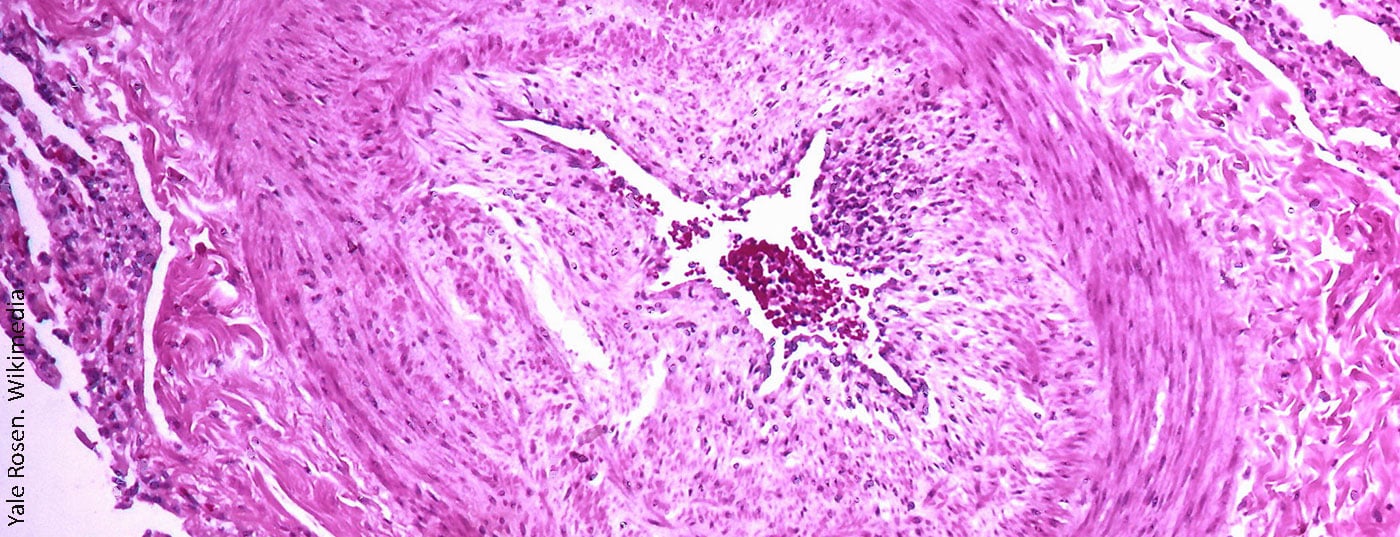
L’hypertension pulmonaire thromboembolique chronique (HTPC) est une sous-catégorie des hypertensions pulmonaires (HTP). Le diagnostic est très rare dans l’ensemble, mais l’HCTPE est souvent méconnue et donc sous-diagnostiquée, ce qui explique que le nombre de cas non diagnostiqués soit probablement plus élevé.
L’hypertension pulmonaire thromboembolique chronique (HTPC) est une sous-classe d’hypertension pulmonaire (HTP), la classe 4 selon la classification ESC/ERC [1]. Le diagnostic d’HTPC peut être posé en présence d’une HTP pré-capillaire symptomatique (mPAP minimum 20-25 mmHg et pression d’occlusion capillaire pulmonaire ≤15 mmHg) associée à des troubles de la perfusion dans les poumons après un minimum de 3 mois d’anticoagulation fiable [2] pour une différenciation avec l’embolie pulmonaire aiguë (EP). Le diagnostic est très rare dans l’ensemble, bien que l’HCTPE soit souvent méconnue et donc sous-diagnostiquée, ce qui signifie que le nombre de cas non diagnostiqués est probablement plus élevé.
Cet article présente le diagnostic et le traitement de l’HTPC dans le but de sensibiliser davantage les médecins généralistes, mais aussi les collègues spécialisés, à cette maladie, car il existe un traitement curatif pour ces patients, contrairement à toutes les autres formes d’HTP.
Incidence, facteurs de risque et pathogenèse
L’incidence annuelle de l’HTCC aux États-Unis, en Europe et au Japon est d’environ 3 à 5 cas pour 100 000 habitants [2]. L’incidence cumulée de l’HTCC au cours des deux premières années après une LE aiguë varie de 0,1 à 9,1% [2–10], une large fourchette ; pour la Suisse, une étude a même indiqué 0,79% [11]. Pour compliquer les choses, plus de 25% des nouveaux cas diagnostiqués n’ont pas d’antécédents de LE aiguë [12]. Outre les événements thromboemboliques, il existe d’autres facteurs de risque connus, tels que des troubles auto-immuns et hématologiques [13], la présence d’un shunt ventriculo-atrial ou d’électrodes de stimulation infectées, un antécédent de splénectomie, un groupe sanguin non 0, la présence d’anticorps anti-lupus/anti-phospholipides, un traitement substitutif de l’hormone thyroïdienne et un antécédent de tumeur [14], qui sont en outre de mauvais pronostic.
La physiopathologie exacte de l’HTCC est complexe et reste incertaine, et il existe probablement plusieurs mécanismes causaux, tels que la persistance de thrombus organisés et de cicatrices dans les artères pulmonaires proximales (artères principales, lobaires et segmentaires) et/ou une microangiopathie [15]. Plusieurs processus ont été associés à une dissolution incomplète du thrombus [16]: inflammatoire [17–19], facteurs génétiques [20–22], anomalies de la fibrinolyse [23–27] et bien d’autres [28].
Tableau clinique et description de cas
Le tableau clinique comprend toujours une dyspnée d’effort, le symptôme principal [29,30]. Les autres symptômes sont une fatigue dans environ 30% des cas, des douleurs thoraciques dans 15% des cas, un épisode de syncope dans environ 14% des cas et une hémoptysie dans 5% des cas [12,31,32]. Tous ces symptômes ne sont pas rares, en particulier chez les patients âgés présentant des comorbidités supplémentaires telles qu’une broncho-pneumopathie chronique obstructive, un déconditionnement et une obésité souvent associée [33,34]. Pour compliquer les choses, environ la moitié des patients atteints de LE aiguë font état d’une détresse respiratoire persistante, même des années après l’événement, ce que l’on appelle le “syndrome post-PE”. Malgré tout, ces patients devraient faire l’objet d’une évaluation diagnostique plus approfondie afin d’exclure une CTEPH.
L’examen clinique met en évidence des œdèmes progressifs des membres inférieurs et d’autres signes de congestion (veines du cou, hypertrophie du foie) [33]. En outre, l’auscultation peut révéler une accentuation de la composante pulmonaire du deuxième son cardiaque.
Diagnostic
Malheureusement, il n’existe à ce jour aucun biomarqueur permettant de différencier clairement l’HTPC des autres formes d’HTP. Certains marqueurs inflammatoires circulants (par exemple la CRP, les interleukines -6, -8 et -10) ont été étudiés [17,18,35], mais aucun de ces tests n’a encore été utilisé de manière systématique. L’ECG montre des signes de stress cardiaque droit, par exemple un type droit, un bloc de branche droit (in)complet ou des négativations de l’onde T dans les dérivations de la paroi antérieure V1-V4 (“right ventricular strain pattern”). Sur la radiographie du thorax, il n’y a que des signes non spécifiques de stress cardiaque droit avec un ventricule droit et une oreillette hypertrophiés par exemple.
Dans la suite du diagnostic, l’échocardiographie transthoracique (ETT) est généralement utilisée en premier, ce qui est également mentionné dans la conférence de consensus de 2016 comme la première mesure diagnostique dans l’algorithme de diagnostic (Fig. 1). Elle constitue également un bon test de dépistage initial pour distinguer le syndrome post-PE. L’hypertension pulmonaire est définie dans l’ETT par l’expression de la vitesse de régurgitation tricuspide [36], à partir de laquelle la sPAP peut être mesurée. Sur la base de la mesure Doppler de la vitesse de régurgitation (Vmax) à travers la valve tricuspide, l’équation de Bernoulli simplifiée (∆P=4×Vmax2) permet d’estimer le gradient de pression entre le ventricule droit et l’oreillette droite. La pression de l’oreillette droite est généralement approchée par la largeur et la variabilité respiratoire de la veine cave inférieure. Les autres signes sont la taille et la dilatation du ventricule droit et des oreillettes, un “D-shaping” du septum et le mouvement du plan tricuspide (“tricupsid annulat plane systlic excursion”, TAPSE). Une écho normale n’exclut cependant pas une CTEPH.
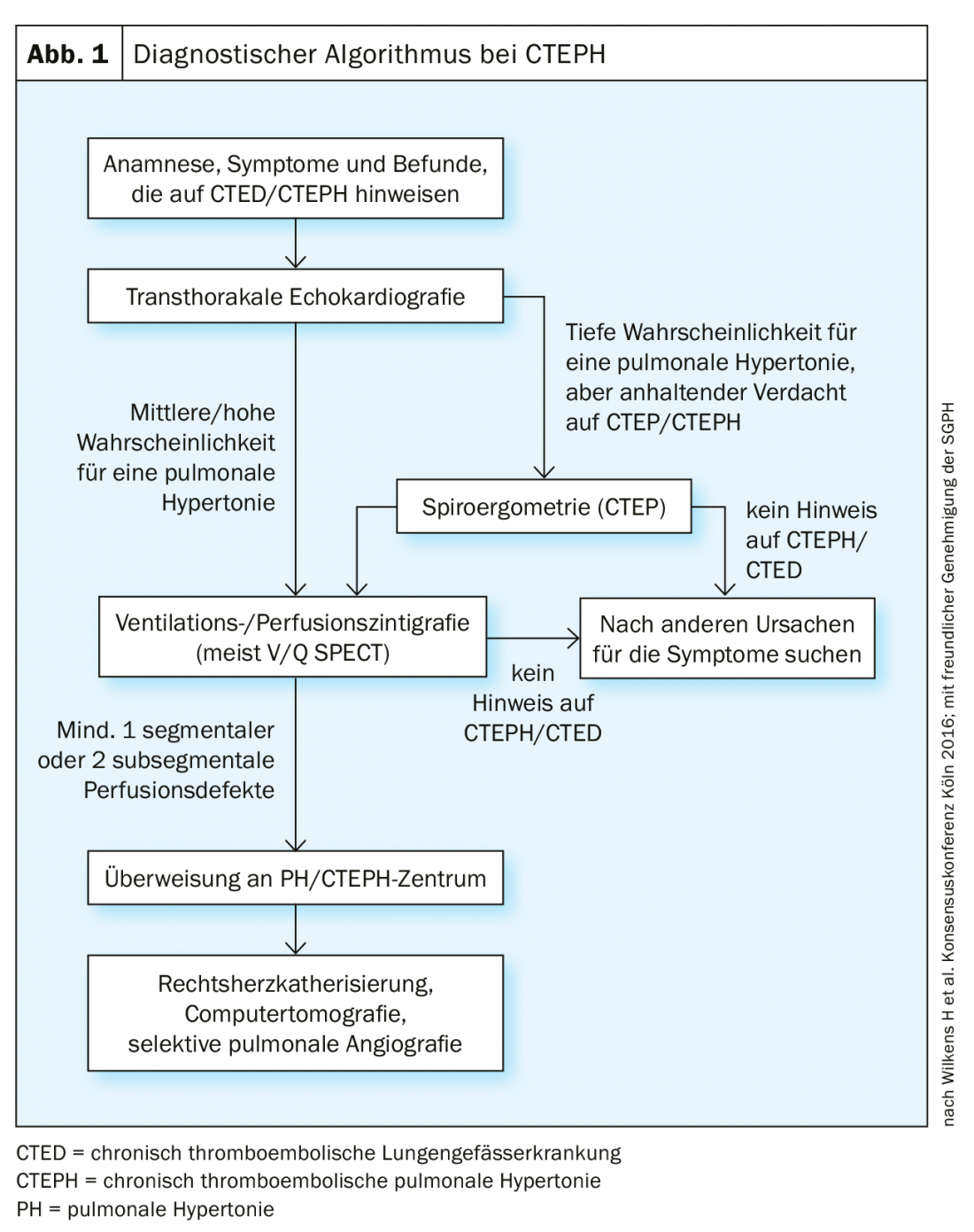
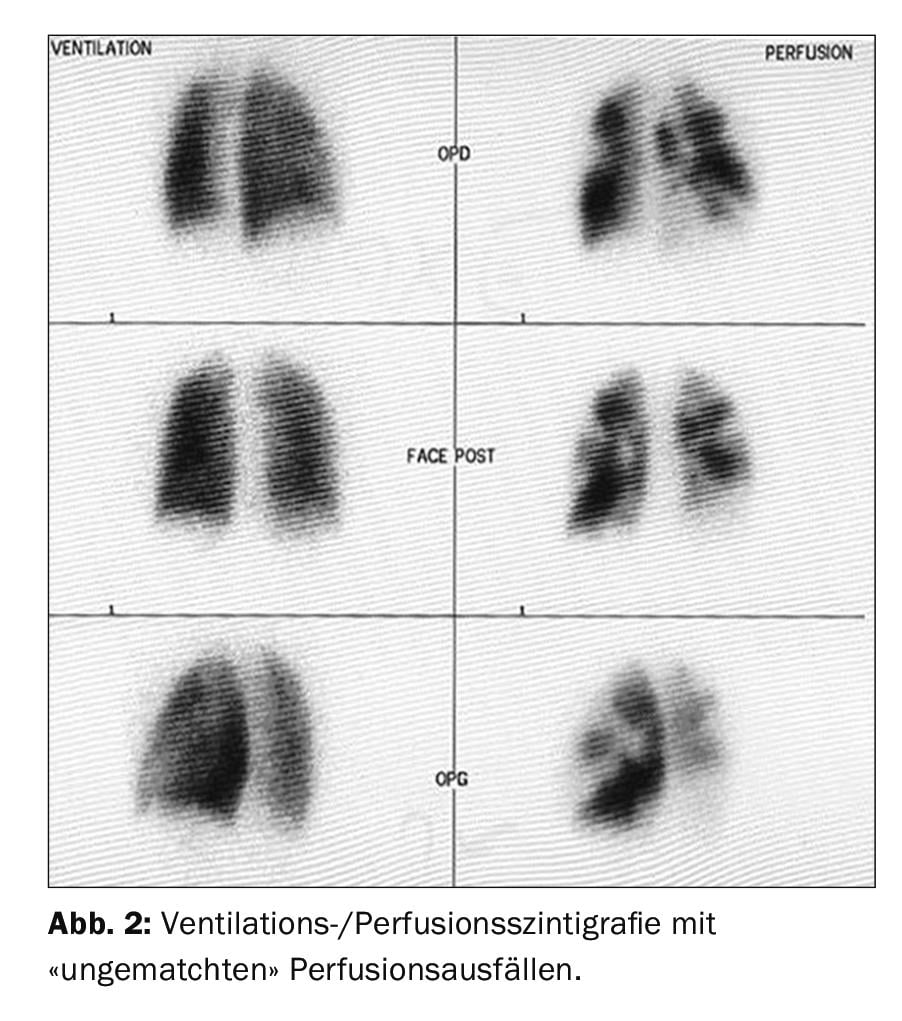
La première méthode de dépistage par imagerie est la scintigraphie de ventilation/perfusion (figure 2), qui, si elle est normale (c’est-à-dire sans déficit de perfusion “non matché”), permet d’exclure une HTPC avec une sensibilité de 90-100% et une spécificité de 94-100% [37,38]. Les nouvelles techniques “à double énergie” combinant la TEMP et le scanner présentent l’avantage de visualiser simultanément le parenchyme pulmonaire et les déficits de perfusion [39,40], mais ne sont pas disponibles dans tous les hôpitaux.
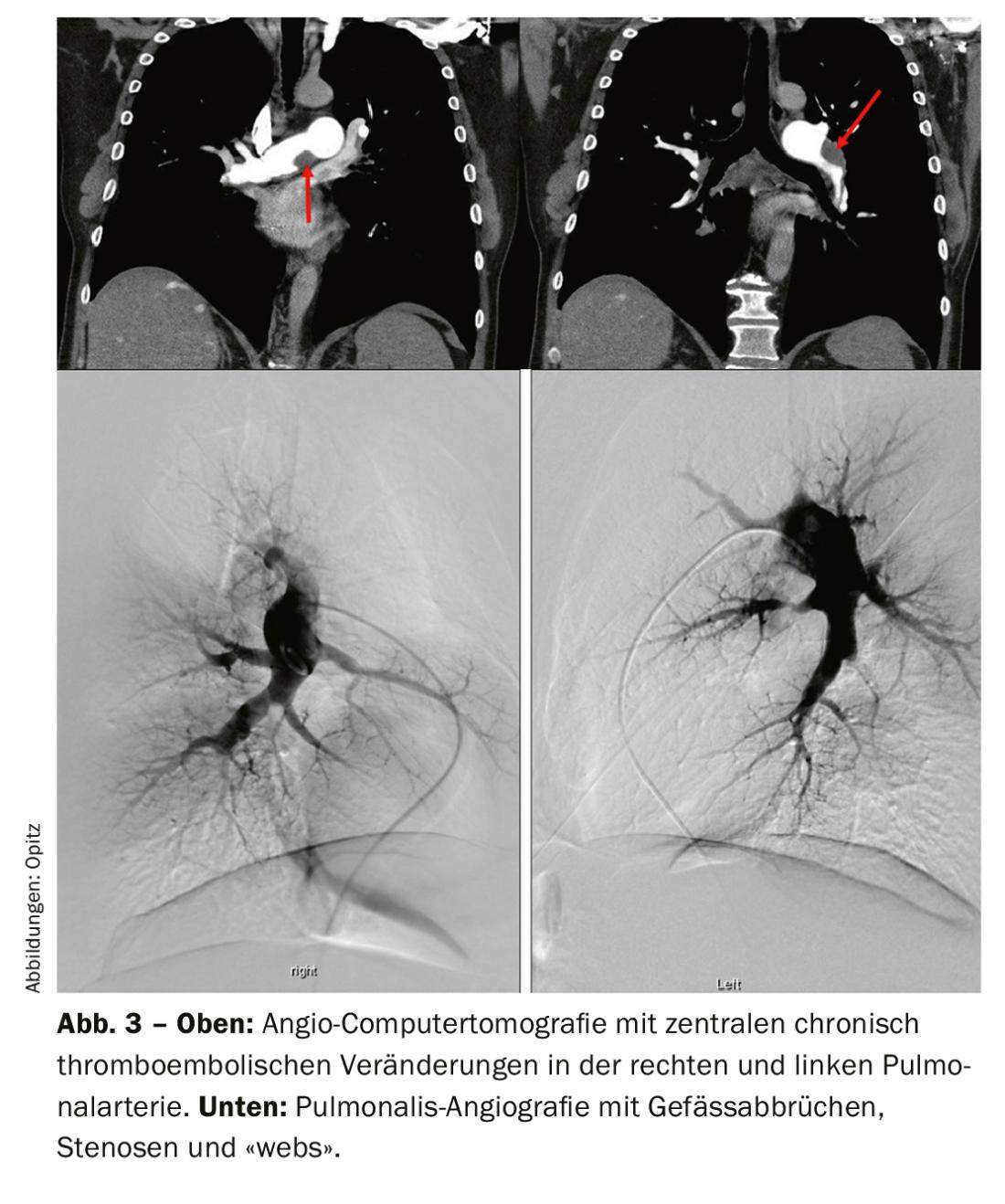
L’angiographie pulmonaire par tomodensitométrie (CTPA) présente de nombreux avantages pour le diagnostic et l’évaluation de l’opérabilité de l’HTPC. Elle a notamment une sensibilité et une spécificité pour la détection des changements thromboemboliques au niveau lobaire (97-100% et 95-100% respectivement), un peu moins au niveau segmentaire plus périphérique (86-100 et 93-99% respectivement) [33,41–43]. Les signes classiques sont des thrombus excentrés (Fig. 3 ci-dessus), appelés “webs”, et des “pouch-lesions” occlusifs, ainsi que des collatérales marquées provenant des artères intercostales par exemple. Tous ces signes sont également visibles sur une angiographie pulmonaire (Fig. 3 ci-dessous), qui présente en même temps l’avantage d’une mesure invasive de la pression PA. Le scanner permet toutefois d’identifier d’autres diagnostics différentiels (DD) et de détecter des signes de “perfusion en mosaïque” dans le parenchyme pulmonaire, ainsi que des infarctus le cas échéant. Un autre avantage est la représentation de l’accessibilité des modifications thromboemboliques chroniques dans l’identification de la manière dont une couche de préparation se présente de manière proximale et si elle est accessible pour une endartériectomie pulmonaire. Pour pouvoir les interpréter, il faut des reconstructions dans le plan sagittal et aussi coronaire à côté de la coupe axiale, et le scanner doit être conduit avec une épaisseur de coupe de 1 mm. L’imagerie par résonance magnétique (IRM) ne joue jusqu’à présent aucun rôle dans le diagnostic de l’HCTD dans une application standardisée ; l’enregistrement simultané de la fonction ventriculaire droite représente toutefois un avantage et, à l’avenir, l’IRM jouera probablement un rôle croissant pour le dépistage, mais aussi, le cas échéant, pour le suivi des patients atteints d’HCTD après une opération ou un autre traitement.
La confirmation hémodynamique du diagnostic de CTEPH se fait par cathétérisme cardiaque droit : La pression artérielle pulmonaire moyenne (PAPm) doit être ≥20-25 mmgHg [1] et précapillaire (“wedge pressure”/pression d’occlusion capillaire pulmonaire ≤15 mmHg). L’enregistrement du débit cardiaque par thermodilution ou par la méthode directe de Fick est une condition préalable au calcul correct de la résistance vasculaire pulmonaire (RVP), un facteur important en termes de pronostic et de risque opératoire [44].
La spiro-ergométrie est un autre examen fonctionnel permettant d’identifier l’HCCT : Elle montre les signes typiques du déséquilibre ventilation-perfusion avec des équivalents respiratoires élevés au seuil anaérobie, un gradient alvéo-artériel de pO2 élevé, un gradient capillaire-endtidal-CO2 positif, une hypoxémie à l’effort et une capacité d’exercice clairement diminuée [45–48].
Il est particulièrement important qu’en cas de suspicion de CTEPH, le patient soit impérativement adressé à un centre spécialisé pour la poursuite du diagnostic interdisciplinaire et l’allocation du traitement.
Un cas classique est décrit ci-dessous, avec l’histoire complète du patient :
Un patient de 50 ans ayant des antécédents d’embolies pulmonaires et d’accidents thromboemboliques multiples se présente avec un essoufflement NYHA III-IV. Lors du test de marche de 6 minutes, le patient a atteint 270 mètres à Borg 2 (tab. 1).
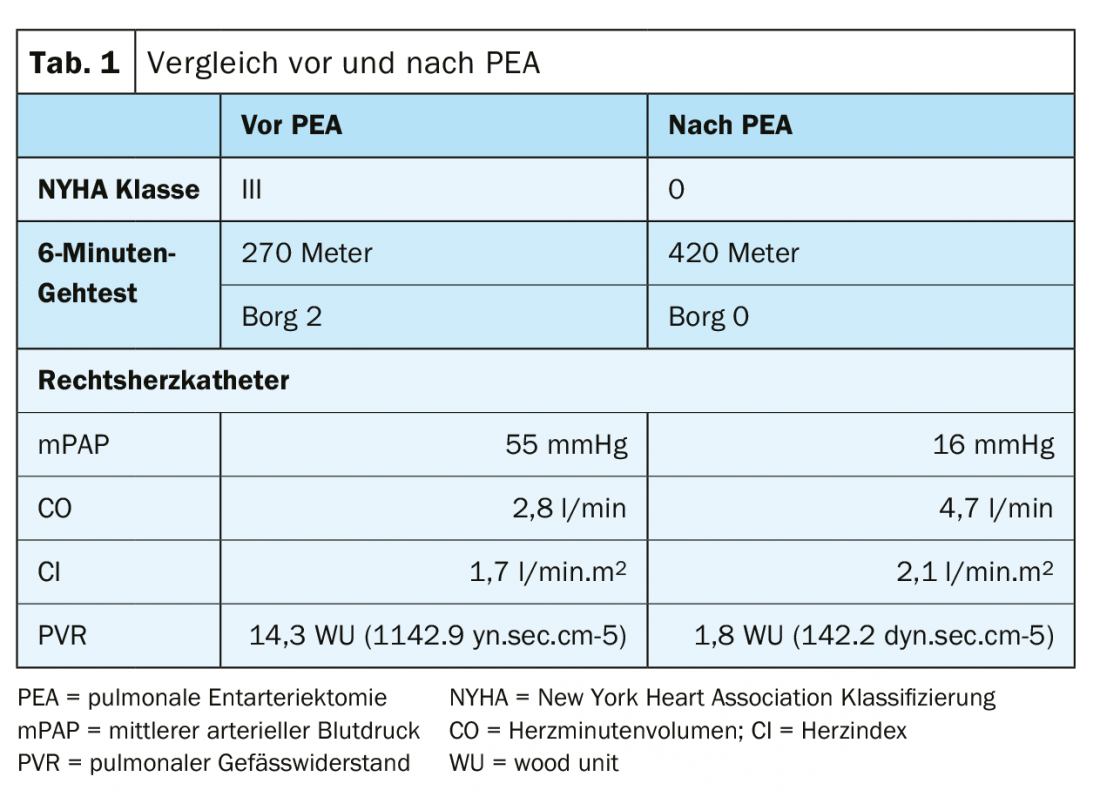
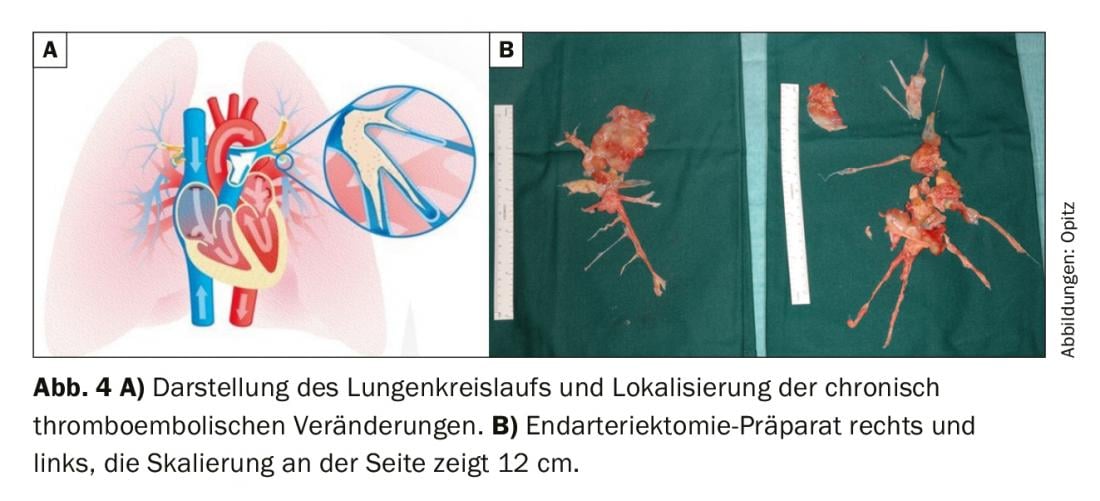
La scintigraphie de ventilation/perfusion a montré des défauts de perfusion bilatéraux “non appariés” (Fig. 2). L’échocardiographie transthoracique montre une augmentation de la pression artérielle pulmonaire systolique (sPAP) ainsi qu’un ventricule droit dilaté. Le scanner montre des lésions centrales (fig. 3 en haut) qui ont été retirées jusqu’en périphérie lors de l’endartériectomie pulmonaire (fig. 4B). En postopératoire, le patient s’est rapidement rétabli et a présenté une hémodynamique normale et une NYHA 0 lors du contrôle à 1 an (tab. 1).
Prévisions
Une fois le diagnostic posé, le traitement doit être discuté sans délai, car en l’absence de traitement, une mPAP de >50 mmgHg entraîne une mortalité à 2 ans de >80% et une mPAP de >30 mmgHg est associée à une mortalité à 3 ans de 90% [49].
Depuis 2015, l’hôpital universitaire de Zurich (USZ) propose un programme interdisciplinaire de CTEPH qui offre toute la gamme de traitements, de la chirurgie à l’angioplastie et au traitement médicamenteux. Une à deux fois par mois, la Société Suisse d’Hypertension Pulmonaire propose aux médecins référents un comité national CTEPH qui peut être contacté pour la présentation et la discussion de cas (CTEPH@usz.ch, CTEPH@sgph.ch).
Thérapie
Traitement chirurgical : selon les directives actuelles de l’ERS/ESC, une endartériectomie pulmonaire (EPA) est recommandée comme traitement de première intention chez les patients présentant une HTPC accessible par voie chirurgicale [1]. (Fig. 4A). L’AEP consiste à ouvrir les artères pulmonaires de manière séquentielle (toujours des deux côtés) sur une machine cœur-poumon et en hypothermie profonde (20°C) et à retirer le matériel thromboembolique chronique au cours d’arrêts circulatoires de 20 minutes, ce qui est techniquement possible jusque loin en périphérie. (Fig. 4B). Dans tous les cas, la décision d’opérer et la sélection des patients doivent être prises par une équipe interdisciplinaire de spécialistes, comprenant des spécialistes de l’HTP, des radiologues et des chirurgiens PEA. [50]. Les facteurs déterminants pour une PEA sont : la sévérité des symptômes, l’étendue de l’HTP, la fonction du ventricule droit, le profil de comorbidité du patient et le matériel chirurgicalement accessible. Ce dernier point en particulier est une évaluation exigeante, car il est bien connu que l’imagerie sous-estime presque toujours l’étendue du matériel thromboembolique chronique. Les patients atteints de maladie segmentaire et sous-segmentaire peuvent également bénéficier d’une PEA avec d’excellents résultats à court et à long terme dans des centres expérimentés [51,52]. Les recommandations émises lors du World Symposium on PH indiquent qu’une “seconde opinion” doit être obtenue auprès d’un centre d’expertise chirurgicale CTEPH lorsqu’un patient a été jugé inopérable dans un centre non CTEPH [50]. La sévérité de l’HTP et la limitation de la dysfonction cardiaque droite ne sont pas non plus des contre-indications en soi à l’AEP et les patients symptomatiques doivent se voir proposer un traitement chirurgical [53]. L’âge ne constitue pas non plus une contre-indication absolue, puisque les données montrent que les patients >70 ans en bénéficient autant que les patients plus jeunes [54]. La mortalité liée à l’intervention n’est cependant pas négligeable et est estimée dans la littérature entre 2,4 et 13,2%, ce dernier chiffre provenant de périodes chronologiques antérieures [55].
Si l’opération est réussie, la qualité et l’espérance de vie (taux de survie de >90% après 1 an >70%, après 6 à 10 ans [31,55,56]) des patients peuvent être améliorées de manière significative : La dyspnée, le test de marche de 6 minutes ainsi qu’une augmentation de l’absorption d’oxygène, une amélioration de l’équivalent respiratoire pour leCO2 et une diminution des besoins en oxygène ont été démontrés [57,58]. Une augmentation de l’espérance de vie à moyen et long terme a été rapportée.
Angioplastie pulmonaire par ballonnet (BPA)
Si la chirurgie n’est pas envisageable, l’APP interventionnelle permet de traiter les altérations chroniques segmentaires ou sous-segmentaires périphériques en plusieurs séances. Des améliorations convaincantes peuvent être obtenues au niveau de l’hémodynamique, du test de marche de 6 minutes et de la classe NYHA/OMS. Actuellement, il manque encore des données à long terme [59].
Traitement médicamenteux : les patients présentant une HTPC distale non accessible à la chirurgie et une hypertension pulmonaire résiduelle après une APE peuvent être traités par des médicaments [50,60]. Des médicaments similaires à ceux utilisés dans l’HTAP sont utilisés [61–64]. Indépendamment du traitement antihypertenseur, qui agit en particulier sur la composante distale de l’HTCC, tout patient souffrant d’une HTCC doit être anticoagulé à vie, indépendamment des autres traitements. Les décisions thérapeutiques ne devraient être prises qu’après une OAC d’au moins 3 mois [1,65]. Actuellement, les patients continuent à être traités par des antagonistes de la vitamine K. En raison de leur efficacité comparable et de leur bon profil de sécurité, les NOAK (nouveaux anticoagulants oraux) sont également de plus en plus utilisés, notamment en cas de problèmes de détermination de la dose et dans les cas où l’INR (International Normalized Ratio) se situe souvent en dehors de la fourchette cible de 2,5-3,5 [65,66].
Messages Take-Home
- L’hypertension pulmonaire thromboembolique chronique (HTPC) est définie comme une hypertension pulmonaire symptomatique avec des troubles de perfusion pulmonaire persistants malgré une anticoagulation adéquate pendant au moins 3 mois.
- Les patients souffrant d’une CTEPH doivent être adressés à un centre spécialisé dans la CTEPH pour confirmer le diagnostic par un cathétérisme cardiaque droit suivi d’un traitement.
- La Société Suisse d’Hypertension Pulmonaire propose aux médecins référents un conseil national CTEPH qui peut être contacté pour la présentation et la discussion de cas (CTEPH@usz.ch, CTEPH@sgph.ch).
- La capacité fonctionnelle, la résistance physique et même l’espérance de vie des patients peuvent être augmentées par une endartériectomie pulmonaire. Pour cette raison, une PEA devrait être évaluée dans tous les cas.
- Un traitement médicamenteux et/ou une angioplastie par ballonnet peuvent aider les patients souffrant d’une HTPC inopérable ou d’une hypertension pulmonaire résiduelle postopératoire.
- L’HTPC nécessite impérativement un traitement anticoagulant oral à vie.
|
Équipe CTEPH de l’Hôpital universitaire de Zurich : |
Littérature :
- Galie N, Humbert M, Vachiery JL, et al. : 2015 ESC/ERS Guidelines for the diagnosis and treatment of pulmonary hypertension : The Joint Task Force for the Diagnosis and Treatment of Pulmonary Hypertension of the European Society of Cardiology (ESC) and the European Respiratory Society (ERS) : Endorsed by : Association for European Paediatric and Congenital Cardiology (AEPC), International Society for Heart and Lung Transplantation (ISHLT). The European respiratory journal. 2015;46(4) : 903-975.
- Gall H, Hoeper MM, Richter MJ, et al : An epidemiological analysis of the burden of chronic thromboembolic pulmonary hypertension in the USA, Europe and Japan. European respiratory review : an official journal of the European Respiratory Society. 2017;26(143).
- Korkmaz A, Ozlu T, Ozsu S, et al : Long-term outcomes in acute pulmonary thromboembolism : the incidence of chronic thromboembolic pulmonary hypertension and associated risk factors. Clin Appl Thromb Hemost. 2012;18(3) : 281-288.
- Otero R, Oribe M, Ballaz A, et al. : Évaluation échocardiographique de la pression artérielle pulmonaire dans le suivi des patients atteints d’embolie pulmonaire. Recherche sur les thromboses. 2011;127(4) : 303-308.
- Poli D, Grifoni E, Antonucci E, et al : Incidence des thromboembolismes veineux récurrents et de l’hypertension pulmonaire thromboembolique chronique chez les patients ayant subi un premier épisode d’embolie pulmonaire. J Thromb Thrombolysis. 2010;30(3) : 294-299.
- Surie S, Gibson NS, Gerdes VE, et al : Active search for chronic thromboembolic pulmonary hypertension does not appear indicated after acute pulmonary embolism. Recherche sur les thromboses. 2010;125(5) : e202-205.
- Dentali F, Donadini M, Gianni M, et al : Incidence de l’hypertension pulmonaire chronique chez les patients ayant déjà souffert d’embolie pulmonaire. Recherche sur les thromboses. 2009;124(3) : 256-258.
- Marti D, Gomez V, Escobar C, et al : Incidence de l’hypertension pulmonaire thromboembolique chronique symptomatique et asymptomatique. Arch Bronconeumol. 2010;46(12) : 628-633.
- Klok FA, van Kralingen KW, van Dijk AP, et al : Prospective cardiopulmonary screening program to detect chronic thromboembolic pulmonary hypertension in patients after acute pulmonary embolism. Haematologica. 2010;95(6) : 970-975.
- Noble S, Pasi J : Épidémiologie et physiopathologie de la thrombose associée au cancer. Br J Cancer. 2010;102 Suppl 1 : S2-9.
- Coquoz N, Weilenmann D, Stolz D, et al : Enquête observationnelle multicentrique pour la détection de l’HCTPE suite à un embolisme pulmonaire. The European respiratory journal. 2018;51(4).
- Pepke-Zaba J, Delcroix M, Lang I, et al : Chronic thromboembolic pulmonary hypertension (CTEPH) : results from an international prospective registry. Circulation. 2011;124(18) : 1973-1981.
- Blauwet LA, Edwards WD, Tazelaar HD, McGregor CG : Surgical pathology of pulmonary thromboendarterectomy : a study of 54 cas from 1990 to 2001. Hum Pathol. 2003;34(12) : 1290-1298.
- Bonderman D, Wilkens H, Wakounig S, et al : Risk factors for chronic thromboembolic pulmonary hypertension. The European respiratory journal. 2009;33(2) : 325-331.
- Kim NH : Group 4 Pulmonary Hypertension : Chronic Thromboembolic Pulmonary Hypertension : Epidemiology, Pathophysiology, and Treatment. Cardiol Clin. 2016;34(3) : 435-441.
- Simonneau G, Torbicki A, Dorfmuller P, Kim N : The pathophysiology of chronic thromboembolic pulmonary hypertension. European respiratory review : un journal officiel de la Société européenne de pneumologie. 2017 ; 26 (143).
- Quarck R, Nawrot T, Meyns B, Delcroix M : C-reactive protein : a new predictor of adverse outcome in pulmonary arterial hypertension. Journal de l’American College of Cardiology. 2009;53(14) : 1211-1218.
- Zabini D, Heinemann A, Foris V, et al : Comprehensive analysis of inflammatory markers in chronic thromboembolic pulmonary hypertension patients. The European respiratory journal. 2014;44(4) : 951-962.
- Reesink HJ, Meijer RC, Lutter R, et al : Hemodynamic and clinical correlates of endothelin-1 in chronic thromboembolic pulmonary hypertension. Circ J. 2006;70(8) : 1058-1063.
- Wolf M, Boyer-Neumann C, Parent F, et al : Thrombotic risk factors in pulmonary hypertension. The European respiratory journal. 2000;15(2) : 395-399.
- Bonderman D, Turecek PL, Jakowitsch J, et al : Haute prévalence de l’élévation du facteur de clotting VIII dans l’hypertension pulmonaire thromboembolique chronique. Thromb Haemost. 2003;90(3) : 372-376.
- Gu S, Su P, Yan J, et al : Comparaison des profils d’expression des gènes et des voies de transmission associées dans l’hypertension pulmonaire thromboembolique chronique. Int J Mol Med. 2014;33(2) : 277-300.
- Lang IM, Dorfmuller P, Vonk Noordegraaf A : The Pathobiology of Chronic Thromboembolic Pulmonary Hypertension. Ann Am Thorac Soc. 2016;13 Suppl 3 : S215-221.
- Le Gal G, Delahousse B, Lacut K, et al : polymorphismes du fibrinogène Aalpha-Thr312Ala et du facteur XIII-A Val34Leu dans la thromboembolie veineuse idiopathique. Recherche sur les thromboses. 2007;121(3) : 333-338.
- Suntharalingam J, Goldsmith K, van Marion V, et al : Le polymorphisme du fibrinogène Aalpha Thr312Ala est associé à l’hypertension pulmonaire thromboembolique chronique. The European respiratory journal. 2008;31(4) : 736-741.
- Marsh JJ, Chiles PG, Liang NC, Morris TA : Les dysfibrinogénémies associées à l’hypertension pulmonaire thromboembolique chronique présentent une structure de fibrine désorganisée. Recherche sur les thromboses. 2013;132(6) : 729-734.
- Morris TA, Marsh JJ, Chiles PG, et al : Haute prévalence de dysfibrinogénémie chez les patients atteints d’hypertension pulmonaire thromboembolique chronique. Le sang. 2009;114(9) : 1929-1936.
- Opitz I, Kirschner MB : Recherche moléculaire dans l’hypertension pulmonaire thromboembolique chronique. Int J Mol Sci. 2019;20(3).
- Mayer E, Jenkins D, Lindner J, et al : Surgical management and outcome of patients with chronic thromboembolic pulmonary hypertension : results from an international prospective registry. J Thorac Cardiovasc Surg. 2011;141(3) : 702-710.
- Held M, Grun M, Holl R, et al : Chronic thromboembolic pulmonary hypertension : Time delay from onset of symtoms to diagnosis and clinical condition at diagnosis. Dtsch Med Wochenschr. 2014;139(33) : 1647-1652.
- Hoeper MM, Madani MM, Nakanishi N, et al : Hypertension pulmonaire thromboembolique chronique. Lancet Respir Med. 2014;2(7) : 573-582.
- Lang IM, Simonneau G, Pepke-Zaba JW, et al : Factors associated with diagnosis and operability of chronic thromboembolic pulmonary hypertension. Une étude cas-témoins. Thromb Haemost. 2013;110(1) : 83-91.
- Gopalan D, Delcroix M, Held M. Diagnostic de l’hypertension pulmonaire thromboembolique chronique. European respiratory review : un journal officiel de la Société européenne de pneumologie. 2017 ; 26 (143).
- Fedullo P, Kerr KM, Kim NH, Auger WR : Hypertension pulmonaire thromboembolique chronique. American journal of respiratory and critical care medicine. 2011;183(12):1605–1613.
- Quarck R, Wynants M, Verbeken E, et al. : Contribution de l’inflammation et de l’angiogenèse déficiente à la pathobiologie de l’hypertension pulmonaire thromboembolique chronique. The European respiratory journal. 2015;46(2) : 431-443.
- Rehman MB, Garcia R, Christiaens L, et al. : Power of resting echocardiographic measurements to classify pulmonary hypertension patients according to European society of cardiology exercise testing risk stratification cut-offs. International journal of cardiology. 2018;257 : 291-297.
- Leblanc M, Leveillee F, Turcotte E : Évaluation prospective de la valeur prédictive négative de la SPECT V/Q utilisant le 99mTc-Technegas. Nucl Med Commun. 2007;28(8) : 667-672.
- Gruning T, Drake BE, Farrell SL, Nokes T. Three-year clinical experience with VQ SPECT for diagnosis pulmonary embolism : diagnostic performance. Clin Imaging. 2014;38(6) : 831-835.
- Gutte H, Mortensen J, Jensen CV, et al : Détection de l’embolie pulmonaire avec la combinaison ventilation-perfusion SPECT et la tomodensitométrie à faible dose : comparaison tête-bêche avec l’angiographie par tomodensitométrie multidétecteurs. J Nucl Med. 2009;50(12) : 1987-1992.
- Simanek M, Koranda P : Les avantages de l’imagerie pulmonaire hybride personnalisée SPECT/CT. Am J Nucl Med Mol Imaging. 2016;6(4) : 215-222.
- Ley S, Ley-Zaporozhan J, Pitton MB, et al : Performance diagnostique des techniques d’imagerie de pointe pour l’évaluation morphologique des anomalies vasculaires chez les patients atteints d’hypertension pulmonaire thromboembolique chronique (HTPC). Eur Radiol. 2012;22(3) : 607-616.
- Reichelt A, Hoeper MM, Galanski M, Keberle M : Hypertension pulmonaire thromboembolique chronique : évaluation par scanner à 64 détecteurs versus angiographie numérique par soustraction. Eur J Radiol. 2009;71(1) : 49-54.
- Sugiura T, Tanabe N, Matsuura Y, et al. : Role of 320-slice CT imaging in the diagnosis workup of patients with chronic thromboembolic pulmonary hypertension. Chest. 2013;143(4) : 1070-1077.
- Jenkins D, Mayer E, Screaton N, Madani M : State-of-the-art chronic thromboembolic pulmonary hypertension diagnosis and management. European respiratory review : un journal officiel de la Société européenne de pneumologie. 2012;21(123) : 32-39.
- Scheidl SJ, Englisch C, Kovacs G, et al. : Diagnostic de l’HTCC versus l’HTAP en utilisant des gradients capillaires à finaux de dioxyde de carbone. The European respiratory journal. 2012;39(1) : 119-124.
- Held M, Meintz S, Baron S, et al : Surgical cure of central sleep apnea ? American journal of respiratory and critical care medicine. 2013;188(3) : 395-396.
- Held M, Grun M, Holl R, et al : Cardiopulmonary exercise testing to detect chronic thromboembolic pulmonary hypertension in patients with normal echocardiography. Respiration. 2014;87(5) : 379-387.
- Held M, Linke M, Jany B : Echocardiographie et cathétérisme cardiaque droit dans l’hypertension pulmonaire. Dtsch Med Wochenschr. 2014;139(30) : 1511-1517.
- Lewczuk J, Piszko P, Jagas J, et al : Prognostic factors in medically treated patients with chronic pulmonary embolism. Chest. 2001;119(3) : 818-823.
- Kim NH, Delcroix M, Jenkins DP, et al : Hypertension pulmonaire thromboembolique chronique. Journal de l’American College of Cardiology. 2013;62(25 Suppl) : D92-99.
- Madani MM, Auger WR, Pretorius V, et al : Endartérectomie pulmonaire : changements récents dans l’expérience d’une seule institution de plus de 2 700 patients. Les Annales de la chirurgie thoracique. 2012;94(1) : 97-103 ; discussion
- D’Armini AM, Morsolini M, Mattiucci G, et al : Endartériectomie pulmonaire pour hypertension pulmonaire thromboembolique chronique distale. J Thorac Cardiovasc Surg. 2014;148(3) : 1005-1011 ; 12 e1-2 ; discussion 11-2.
- Madani MM : Traitement chirurgical de l’hypertension pulmonaire thromboembolique chronique : thromboendartériectomie pulmonaire. Methodist Debakey Cardiovasc J. 2016;12(4) : 213-218.
- Berman M, Hardman G, Sharples L, et al. : Pulmonary endarterectomy : outcomes in patients aged >70. European journal of cardio-thoracic surgery : official journal of the European Association for Cardio-thoracic Surgery. 2012;41(6) : e154-160.
- Cannon JE, Su L, Kiely DG, et al : Dynamic Risk Stratification of Patient Long-Term Outcome After Pulmonary Endarterectomy : Results From the United Kingdom National Cohort. Circulation. 2016;133(18) : 1761-1771.
- Archibald CJ, Auger WR, Fedullo PF, et al : Long-term outcome after pulmonary thromboendarterectomy. American journal of respiratory and critical care medicine. 1999;160(2) : 523-528.
- Rahnavardi M, Yan TD, Cao C, et al : Pulmonary thromboendarterectomy for chronic thromboembolic pulmonary hypertension : a systematic review. Annals of thoracic and cardiovascular surgery : official journal of the Association of Thoracic and Cardiovascular Surgeons of Asia. 2011;17(5) : 435-445.
- Condliffe R, Kiely DG, Gibbs JS, et al : Improved outcomes in medically and surgically treated chronic thromboembolic pulmonary hypertension. American journal of respiratory and critical care medicine. 2008;177(10) : 1122-1127.
- Mahmud E, Behnamfar O, Ang L, et al : Balloon Pulmonary Angioplasty for Chronic Thromboembolic Pulmonary Hypertension. Interv Cardiol Clin. 2018;7(1) : 103-117.
- Mayer E : Traitement chirurgical et post-opératoire de l’hypertension pulmonaire thromboembolique chronique. European respiratory review : un journal officiel de la Société européenne de pneumologie. 2010;19(115) : 64-67.
- Moser KM, Bloor CM : Lésions vasculaires pulmonaires survenant chez les patients atteints d’hypertension pulmonaire thromboembolique majeure chronique. Chest. 1993;103(3) : 685-692.
- Ghofrani HA, D’Armini AM, Grimminger F, et al : Riociguat for the treatment of chronic thromboembolic pulmonary hypertension. The New England journal of medicine. 2013;369(4) : 319-329.
- Simonneau G, D’Armini AM, Ghofrani HA, et al : Predictors of long-term outcomes in patients treated with riociguat for chronic thromboembolic pulmonary hypertension : data from the CHEST-2 open-label, randomised, long-term extension trial. Lancet Respir Med. 2016;4(5) : 372-380.
- Ghofrani HA, Simonneau G, D’Armini AM, et al : Macitentan for the treatment of inoperable chronic thromboembolic pulmonary hypertension (MERIT-1) : results from the multicentre, phase 2, randomised, double-blind, placebo-controlled study. Lancet Respir Med. 2017;5(10) : 785-794.
- Konstantinides SV, Torbicki A, Agnelli G, et al : 2014 ESC guidelines on the diagnosis and management of acute pulmonary embolism. Eur Heart J. 2014;35(43) : 3033-3069, 69a-69k.
- Konstantinides SV, Torbicki A, Agnelli G, et al. : Corrigendum to : 2014 ESC Guidelines on the diagnosis and management of acute pulmonary embolism. Eur Heart J. 2015;36(39) : 2642.
InFo PNEUMOLOGIE & ALLERGOLOGIE 2020 ; 2(2) : 12-15