Un examen microbiologique rapide avec un diagnostic sensible et spécifique est important en raison de l’augmentation de la résistance aux antibiotiques, en particulier pour les gonocoques. Cet article de synthèse fournit des connaissances sur les aspects épidémiologiques et diagnostiques des infections à Chlamydia trachomatis et Neisseria gonorrhoeae.
En Suisse et dans d’autres pays européens, on a constaté ces dernières années une augmentation rapide des maladies sexuellement transmissibles. Un examen microbiologique rapide avec un diagnostic sensible et spécifique est important en raison de l’augmentation de la résistance aux antibiotiques, en particulier pour les gonocoques. Cet article de synthèse vise à fournir des connaissances sur les aspects épidémiologiques et diagnostiques des infections à Chlamydia trachomatis et Neisseria gonorrhoeae.
Épidémiologie
Les chiffres des infections à Chlamydia trachomatis, Neisseria gonorrhoeae et Treponema pallidum ont considérablement augmenté en termes absolus et relatifs ces dernières années en Suisse et dans de nombreux pays européens [1,2]. En Suisse, ces trois agents bactériens et virus sexuellement transmissibles, tels que le VIH et le virus de l’hépatite B, doivent être déclarés par le laboratoire qui les a diagnostiqués, conformément à la loi. La déclaration obligatoire de ces maladies permet une surveillance épidémiologique (www.bag.admin.ch) et l’identification des facteurs et des populations à risque.
Dans les cantons de Bâle-Ville, Zurich, Genève et Vaud, l’augmentation des maladies sexuellement transmissibles est significative, alors que des chiffres plus bas ont été documentés dans les zones rurales [1]. Si l’on peut supposer que le développement important des diagnostics moléculaires au cours des dernières années et la plus grande couverture diagnostique dans les centres urbains expliquent en partie cette augmentation, il est également très probable que les comportements sexuels imprudents soient en partie responsables, même si les études approfondies sur ce sujet sont rares. On peut postuler que la possibilité d’une prophylaxie pré-exposition spécifique au VIH a considérablement réduit la crainte d’une infection par le VIH. On accepte ainsi un risque sexuellement plus élevé pour d’autres infections. Une prophylaxie contre les chlamydiae et les gonocoques est donc discutée pour certaines populations à risque d’infections bactériennes récidivantes [3,4]. Cependant, les études randomisées dans ce domaine, y compris dans le contexte de la résistance aux antibiotiques, font encore défaut.
Neisseria gonorrhoeae : en 2015, 1895 infections confirmées à N. gonorrhoeae ont été rapportées en Suisse, soit environ 23% de plus que les 1545 déclarations de l’année précédente (fig. 1A, www.bag.admin.ch). La majorité des cas ont touché des hommes (environ 80%). Cependant, on constate une nette augmentation pour les deux sexes depuis 2000. En 2015, l’incidence en Suisse était de 9 pour 100 000 habitants chez les femmes et de 37 pour 100 000 habitants chez les hommes [5]. La plupart des cas se produisent dans les centres urbains. La plus grande proportion de femmes se trouvait dans la tranche d’âge des 15-24 ans, tandis que chez les hommes, c’est surtout la tranche d’âge des 25-34 ans qui est concernée. Une augmentation particulièrement forte a été observée dans le groupe des hommes ayant des relations sexuelles avec d’autres hommes (HSH). On estime que seuls 3% de la population sexuellement active sont des HSH, mais ils présentent en moyenne 38% des infections à la gonorrhée selon les études de l’OFSP [5].
Chlamydia trachomatis : En 2015, 10 157 infections confirmées à C. trachomatis ont été rapportées en Suisse, soit environ 5% de plus que les 9677 déclarations de l’année précédente (fig. 1B, www.bag.admin.ch). Dans l’ensemble, le nombre de cas a plus que doublé au cours des dix dernières années. En 2015, l’incidence en Suisse était de 161 pour 100 000 habitants chez les femmes et de 80 pour 100 000 habitants chez les hommes [6]. Il s’agit peut-être en partie d’une pseudo-augmentation, car le pourcentage de tests positifs sur l’ensemble des tests effectués est resté relativement stable [7]. Il est certain que davantage d’infections asymptomatiques sont diagnostiquées, ce qui est lié à la disponibilité de diagnostics moléculaires sensibles et à un dépistage plus fréquent. Environ 70% des infections touchent les femmes, dont la moitié ont entre 15 et 24 ans. Chez 70 à 90% des femmes, l’infection est asymptomatique.

Diagnostic du N. gonorrhoeae – Prélèvement d’échantillons
Un prélèvement d’échantillon correct est essentiel pour la détection culturelle de N. gonorrhoeae. Les gonocoques ont tendance à s’autolyser et sont sensibles à la déshydratation et aux substances toxiques contenues dans certains lubrifiants [8].
Les milieux de prélèvement et de transport de choix sont aujourd’hui les milieux de transport liquides universels qui permettent à la fois la culture bactérienne et les analyses de diagnostic moléculaire (PCR) (par ex. eSwab de Copan). Ces milieux de transport contiennent de nouveaux écouvillons avec des fibres de nylon en flocons qui augmentent le rendement de l’échantillonnage par rapport aux écouvillons traditionnels [9–11]. Cependant, comme il existe des laboratoires de diagnostic qui exigent des récipients de transport différents pour la PCR des gonocoques et la culture, nous vous recommandons de consulter le laboratoire d’analyse concerné avant de procéder au prélèvement.
Le lieu de prélèvement doit être choisi en fonction de l’anamnèse sexuelle [12]. Chez les hommes, les prélèvements urétraux et les urines de premier jet sont les matériaux d’analyse de choix. Les deux échantillons doivent être prélevés au moins une heure après la dernière miction. Le matériel d’examen de choix chez les femmes doit être un frottis cervical. Les échantillons d’urine chez les femmes ne doivent généralement pas être utilisés, car ils sont moins sensibles que les frottis cervicaux [13]. Chez les jeunes filles pré-pubères, les infections à gonocoques sont à rechercher par voie vaginale et non cervicale [14]. Dans ce groupe d’âge, il va de soi que les filles et les garçons doivent consulter un pédiatre.
Les écouvillons rectaux doivent être obtenus à l’aide d’un rectoscope. Il faut éviter d’utiliser des lubrifiants, car certains d’entre eux contiennent des substances toxiques pour N. gonorrhoeae, ce qui diminue la sensibilité de la détection par culture. La technique de prélèvement doit couvrir la plus grande surface d’écouvillonnage possible [15]. Une étude a montré qu’en cas d’infection oropharyngée, une surface aussi large que possible avec une pression supplémentaire lors du frottis doublait presque le taux de détection [15]. Pour des instructions détaillées sur la meilleure façon de prélever des échantillons pour le diagnostic de la gonorrhée, veuillez vous référer aux recommandations de la Commission fédérale pour la santé sexuelle et de la Société suisse d’infectiologie [13]. Si une culture de gonocoques est souhaitée, le prélèvement doit être effectué avant l’administration de l’antibiotique. Le transport des échantillons au laboratoire doit être aussi rapide que possible et la culture doit être effectuée de préférence dans les vingt-quatre heures [16]. L’échantillon peut être expédié dans le milieu de transport à température ambiante.
Microscopie
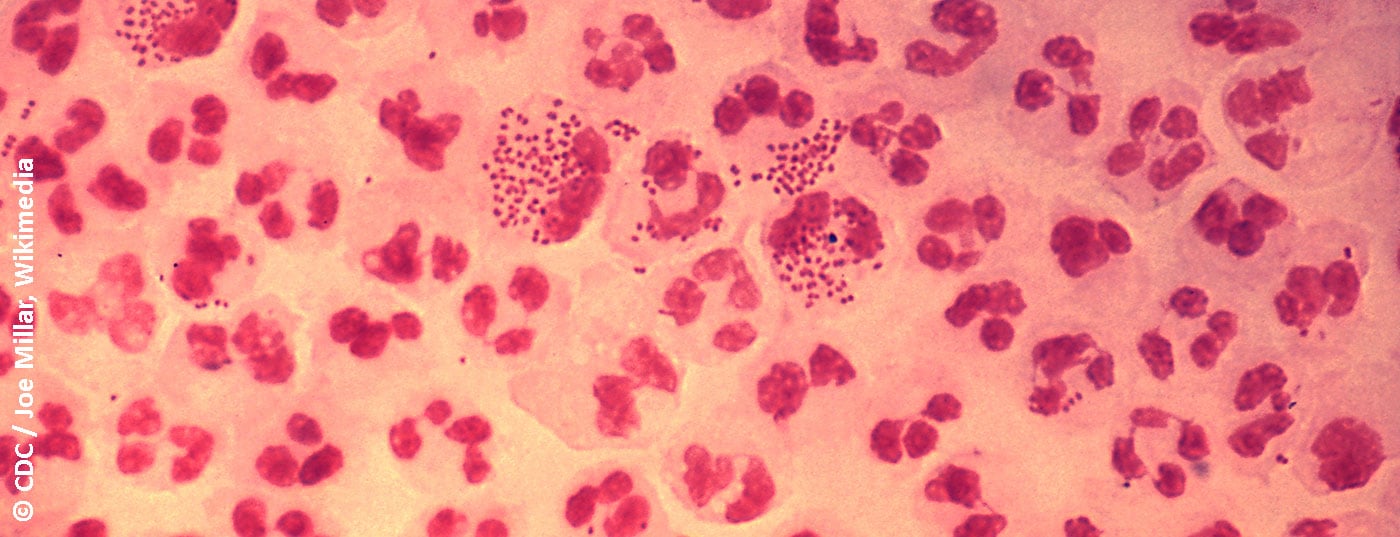
Chez les hommes symptomatiques, la détection est possible avec une préparation de Gram obtenue à partir d’un écouvillon urétral. La mise en évidence de diplocoques à Gram négatif, en forme de semoule ou de grain de café, dans les leucocytes polynucléaires est déterminante pour la gonorrhée [17]. La sensibilité et la spécificité de cet examen sont de >90% [14]. Chez les femmes, la sensibilité de l’analyse microscopique d’un frottis cervical est plus faible, de 50 à 70%, mais la spécificité est de >90% [14]. Bien entendu, la fiabilité de la microscopie dépend de la qualité de l’échantillon et de l’expérience de l’examinateur [14]. La microscopie n’est pas utile pour diagnostiquer une infection oropharyngée, car les Neisseria spp. apathogènes, qui font partie de la flore orale, ne permettent pas de faire une distinction fiable avec les N. gonorrhoeae pathogènes.
Procédés de biologie moléculaire
Il existe aujourd’hui plusieurs systèmes commerciaux qui permettent de détecter N. gonorrhoeae et C. trachomatis à partir du même échantillon par amplification de l’ADN (PCR) – ce que l’on appelle les PCR duplex. La sensibilité et la spécificité de ces systèmes sont excellentes, avec >95% [18–21], et c’est pourquoi ils sont aujourd’hui la norme pour la détection des infections à N. gonorrhoeae et C. trachomatis [22].
Depuis peu, il existe également des PCR multiplex qui permettent une clarification plus large avec d’autres pathogènes comme Mycoplasma hominis, M. genitalium, Ureaplasma urealyticum, et U. parvum [23,24]. Les tests moléculaires utilisant des systèmes (semi-)automatiques sont moins coûteux que les méthodes de culture et permettent un débit élevé d’échantillons cliniques, surtout pour un dépistage rapide. Le délai entre l’arrivée de l’échantillon au laboratoire et le résultat (appelé délai de réponse) est généralement de quelques heures seulement et les résultats sont souvent disponibles le jour même, en fonction de l’heure de réception de l’échantillon. Les méthodes PCR ne doivent pas être utilisées pour documenter le succès du traitement à court terme, car l’ADN de N. gonorrhoeae peut être déterminé par des méthodes de détection sensibles quelques semaines après un traitement réussi [14]. Les réinfections ou les isolats résistants peuvent également être responsables [25]. Dans ce cas, il convient d’enregistrer à nouveau les antécédents médicaux et de procéder à une détection culturelle avec test de résistance aux antibiotiques.
Autres méthodes de détection
Les tests au point d’intervention (POC) pour la détection de l’estérase leucocytaire et les tests immunochromatographiques présentent une faible sensibilité pour les infections à N. gonorrohoeae, avec seulement 23-85% et 60-94% respectivement [26]. Pour le moment, les méthodes basées sur la PCR sont donc clairement supérieures.
Culture bactérienne
La détection par culture de gonocoques viables est nécessaire pour détecter un éventuel échec du traitement et pour recueillir des données fiables sur l’état et l’évolution de la résistance. Les gonocoques sont généralement cultivés sur des milieux sélectifs. Les milieux contiennent des antibiotiques et des antifongiques afin d’inhiber la flore bactérienne et fongique associée. Un milieu typique, également utilisé dans notre laboratoire, est la gélose Martin-Lewis à base de sang de cuisine. Les plaques inoculées sont contrôlées quotidiennement pour vérifier la croissance et incubées pendant 48 heures à 36°C dans une atmosphère à 5% de CO2. Les gonocoques se développent le premier ou le deuxième jour sous forme de petites colonies lisses et grises. Une détection culturelle de bactéries vivantes prend donc généralement entre deux et trois jours, contrairement à une PCR, mais offre davantage de possibilités de diagnostic.
L’identification précise des colonies suspectes sur la plaque de culture se faisait auparavant en testant différentes réactions biochimiques, ce qui prenait plusieurs heures pour établir un profil biochimique. Aujourd’hui, l’identification d’un isolat bactérien est réalisée en quelques minutes par spectrométrie de masse Matrix Assisted Laser Desorption Ionization – Time of Flight (MALDI-TOF). La spectrométrie de masse MALDI-TOF est devenue le standard d’identification pour une large variété de bactéries et de champignons dans les laboratoires de microbiologie [27]. Le facteur limitant le temps reste cependant la culture des bactéries sur une plaque de gélose.
Situation de la résistance
L’Organisation mondiale de la santé (OMS) a récemment dressé une liste de germes résistants pour lesquels de nouveaux antibiotiques efficaces devraient être développés de toute urgence – les N. gonorrhoeae résistants aux céphalosporines et aux fluoroquinolones en font partie (www.who.int). Un test de résistance après une détection culturelle de N. gonorrhoeae est important [13,28]. Malgré l’urgence, la surveillance de la résistance aux antibiotiques n’est pas standardisée ni suffisamment établie dans de nombreux pays [29]. Les antibiotiques suivants sont généralement testés pour N. gonorrhoeae : Cefixime, Ceftriaxone, Fluoroquinolones (par ex. Ciprofloxacine) et Azithromycine. Le test de résistance nécessite deux jours supplémentaires après l’identification.
Le traitement de N. gonorrhoeae est rendu difficile par le développement de la résistance aux antibiotiques. Alors que la pénicilline était encore considérée comme le traitement de choix dans les années 1970, l’augmentation des pénicillinases à médiation plasmidique (enzymes clivant la pénicilline) et de la résistance chromosomique à la pénicilline a mis fin au traitement par la pénicilline [30]. De même, le développement de la résistance plasmidique et chromosomique à la tétracycline a conduit à l’utilisation de céphalosporines à large spectre dans les années 1980, puis à l’utilisation de fluoroquinolones [30]. Dans les années 1990, on a observé une augmentation des isolats résistants aux fluoroquinolones, initialement en Asie du Sud-Est, suivie d’une propagation rapide à de nombreux pays. L’augmentation globale des isolats résistants à la céfixime se poursuit et est préoccupante, car cet antibiotique est actuellement recommandé pour le traitement en dose unique par voie orale [30]. Un autre problème est l’augmentation de la résistance à la ceftriaxone. En raison de l’augmentation des N. gonorrhoeae multirésistants, certaines directives recommandent déjà une combinaison de ceftriaxone intramusculaire et d’azithromycine orale comme traitement de première intention [30].
Pour des détails actuels sur le traitement de la gonorrhée, nous vous renvoyons aux “Recommandations de la Commission fédérale pour la santé sexuelle et de la Société suisse d’infectiologie” [13].
Diagnostic de C. trachomatis – Prélèvement d’échantillons
Les chlamydiae sont des bactéries intracellulaires obligatoires, il est donc important que l’échantillon contienne le plus de cellules possible. Ceci est obtenu en frottant l’écouvillon lors du prélèvement de l’échantillon [31].
Les sites habituels de prélèvement pour les infections génitales symptomatiques à C. trachomatis sont l’endocol chez la femme et l’urètre chez l’homme. Des prélèvements moins invasifs, tels qu’un frottis vaginal chez la femme et un prélèvement d’urine en milieu de jet ou de méat urétral chez l’homme, sont également possibles aujourd’hui, ce qui augmente l’acceptation du test par le patient. La sensibilité et la spécificité de la détection de C. trachomatis par PCR dans des échantillons collectés de manière non invasive sont comparables à celles des échantillons prélevés directement sur le col de l’utérus ou l’urètre [32]. Les échantillons d’urine de femmes sont généralement moins adaptés à la détection de C. trachomatis par PCR, car ils présentent une sensibilité sous-optimale [29]. Les frottis vaginaux auto-prélevés sont décrits comme des échantillons précis et acceptables dans les recommandations de laboratoire du CDC [33]. Pour la détection de la chlamydia par PCR, le matériel doit être traité au plus tard après 48 heures [31]. L’échantillon peut être transporté à température ambiante. Pour des instructions détaillées sur la meilleure façon de prélever un échantillon, nous vous renvoyons aux “Recommandations de la Commission fédérale pour la santé sexuelle et de la Société suisse d’infectiologie” [28].
L’infection par C. trachomatis des sérotypes L1, L2 et L3 est associée à une pathogénicité accrue et conduit à un tableau clinique appelé lymphogranulome vénérien (LGV). Les infections à LGV surviennent principalement dans les populations à risque comme les HSH. La détection se fait dans les écouvillons rectaux ou urétraux, le pus ou le matériel de ponction des ganglions lymphatiques atteints.
Procédés de biologie moléculaire
La méthode de choix pour détecter la chlamydia est aujourd’hui la méthode d’amplification de l’ADN (PCR). La détection peut se faire simultanément pour C. trachomatis et N. gonorrhoeae avec une excellente sensibilité et spécificité (voir ci-dessus). L’importance d’un diagnostic fiable et d’une surveillance épidémiologique peut être illustrée par l’exemple suivant : Les C. trachomatis ont 4 à 8 copies d’un plasmide de 7500 nucléotides. Ce plasmide est donc une cible très attrayante pour une méthode de détection par PCR, car les copies multiples permettent d’obtenir une sensibilité diagnostique accrue. Entre novembre 2005 et août 2006, une baisse inattendue de l’incidence de C. trachomatis a été observée dans une région spécifique de Suède [34]. La réduction de 25% des cas diagnostiqués a d’abord été interprétée comme le succès des mesures de prévention. Mais en fait, cela était dû à une modification génétique avec une délétion de 377 paires de bases dans ledit plasmide [34]. En conséquence, les tests PCR commerciaux fréquemment utilisés n’ont plus détecté les chlamydiae dans l’échantillon. Cette variante dite “suédoise” ou “scandinave” de C. trachomatis est présente en Suède et se retrouve désormais dans d’autres pays scandinaves [35]. Jusqu’à présent, seuls des cas isolés ont été signalés dans d’autres pays. Les fabricants de diagnostics PCR ont rapidement réagi en adaptant et en améliorant les méthodes de détection en conséquence. Les chlamydiae associées au LGV peuvent être déterminées par PCR pour la détection des sérotypes spécifiques du LGV [36,37]. En cas d’évolution plus grave de la maladie, par exemple avec des ganglions lymphatiques hypertrophiés, la LGV doit être recherchée – en particulier chez les HSH – et traitée en conséquence [38]. Comme pour N. gonorhoeae, l’ADN des bactéries non viables peut rester détectable pendant une longue période en cas d’infection par C. trachomatis – la PCR ne devrait donc pas être répétée dans les trois semaines [39].
Autres méthodes de détection
La détection sérologique des anticorps ou un test ELISA de l’antigène Chlamydia avec une réaction d’immunofluorescence ne sont plus guère utilisés en routine.
Situation de la résistance
Comme la chlamydia ne peut être cultivée que dans des cultures cellulaires complexes et que cela ne se fait que dans des laboratoires spécialisés, on ne procède généralement pas non plus à un test de résistance. Le traitement de choix est celui des antibiotiques ayant une efficacité intracellulaire, comme la doxycycline et l’azithromycine. Le développement d’une résistance n’a pas encore été démontré chez C. trachomatis [28]. Pour les directives de traitement de l’infection à C. trachomatis, nous vous renvoyons aux “Recommandations de la Commission fédérale pour la santé sexuelle et de la Société suisse d’infectiologie” [28].
Résumé
Les maladies sexuellement transmissibles telles que N. gonorrhoeae et C. trachomatis connaissent actuellement une renaissance – cette augmentation s’explique en partie par la disponibilité et la sensibilité des diagnostics moléculaires modernes – mais pas exclusivement. C’est précisément à une époque où la résistance aux antibiotiques de N. gonorrhoeae et des chlamydiae particulièrement virulentes (lymphogranulome vénérien) augmente qu’il convient d’établir un diagnostic rapide et fiable. Outre le diagnostic moléculaire, un test de résistance aux antibiotiques basé sur la culture est également recommandé pour N. gonorrhoeae.
Messages Take-Home
- Les maladies sexuellement transmissibles telles que N. gonorrhoeae et C. trachomatis connaissent actuellement une renaissance. Cette augmentation ne s’explique pas exclusivement par la disponibilité et la sensibilité des diagnostics moléculaires modernes.
- La résistance croissante de N. gonorrhoeae aux antibiotiques et la détection de chlamydiae particulièrement virulente (lymphogranulome vénérien) exigent un diagnostic rapide et fiable.
- Outre le diagnostic moléculaire, un test de résistance aux antibiotiques basé sur la culture est également recommandé pour N. gonorrhoeae.
Littérature :
- Office fédéral de la santé publique DÖG. VIH, syphilis, gonorrhée et chlamydiose en Suisse en 2015 : un aperçu épidémiologique. Bulletin de l’OFSP 2016 ; 46 : 12-13.
- (ECDC) ECfDPaC. Les infections sexuellement transmissibles en Europe en 2013. Rapport de surveillance de l’ECDC 2015 : 1-124.
- Dubourg G, Raoult D : Les enjeux de la prophylaxie pré-exposition pour les infections sexuellement transmissibles bactériennes. Microbiologie clinique et infection : la publication officielle de la Société européenne de microbiologie clinique et des maladies infectieuses 2016 ; 22 (9) : 753-756.
- Unemo M, Bradshaw CS, et al : Sexually transmitted infections : challenges ahead. Lancet Infect Dis 2017 ; 17 (8) : e235-e279.
- Office fédéral de la santé publique DÖG : La gonorrhée en Suisse en 2015. Bulletin de l’OFSP 2016 ; 46 : 27-30.
- Office fédéral de la santé publique DÖG : La chlamydiose en Suisse en 2015. Bulletin de l’OFSP 2016 ; 46 : 32-33.
- Schmutz C, Burki D, et al. : Testing for Chlamydia trachomatis : time trends in positivity rates in the canton of Basel-Stadt, Switzerland. Epidemiol Infect 2013 ; 141 (9) : 1953-1964.
- Vogel U, Forsch M : Coques aérobies et anaérobies facultatifs gran négatifs. In : Neumeister M, Geiss HK et al. (éd.) Diagnostic microbiologique. Stuttgart, New York : Thieme ; 2009.
- Coorevits L, Vanscheeuwijck C, et al. : Evaluation du FLOQSwab de Copan pour la détection moléculaire de Chlamydia trachomatis par Abbott RealTime CT PCR. Acta clinica
- Belgica 2015 ; 70 (6) : 398-402.
- Jun JK, Lim MC, et al. Comparaison des prélèvements vaginaux DRY et WET avec des échantillons cervicaux dans les tests Roche Cobas 4800 HPV et Abbott RealTime High Risk HPV. J Clin Virol 2016 ; 79 : 80-84.
- Tan TY, Ng LS, et al. : Evaluation de la récupération bactérienne et de la viabilité de trois systèmes de transport de coton différents. Pathology 2014 ; 46 (3) : 230-233.
- den Heijer CDJ, Hoebe C, et al. : A comprehensive overview of urogenital, anorectal and oropharyngeal Neisseria gonorrhoeae testing and diagnoses among different STI care providers : a cross-sectional study. BMC Infect Dis 2017 ; 17 (1) : 290.
- Toutous Trellu L, Oertle D, et al : Gonorrhée : nouvelles recommandations sur le diagnostic et le traitement. Swiss Medical Forum 2014 ; 14 (20) : 407-409.
- Ng LK, Martin IE : Le diagnostic en laboratoire de Neisseria gonorrhoeae. The Canadian journal of infectious diseases & medical microbiology = Journal canadien des maladies infectieuses et de la microbiologie médicale / AMMI Canada 2005 ; 16 (1) : 15-25.
- Mitchell M, Rane V, et al : La technique d’échantillonnage est importante pour une isolation optimale de la gonorrhée pharyngée. Sex Transm Infect 2013 ; 89 (7) : 557-560.
- Wind CM, de Vries HJ, et al. : Successful Combination of Nucleic Acid Amplification Test Diagnostics and Targeted Deferred Neisseria gonorrhoeae Culture. Journal of clinical microbiology 2015 ; 53 (6) : 1884-1890.
- Spence JM, Wright L, Clark VL : Maintenance en laboratoire de Neisseria gonorrhoeae. Current protocols in microbiology 2008 ; Chapter 4 : Unit 4A 1.
- Perry MD, Jones RN, Corden SA : Est-il nécessaire de procéder à un test de confirmation sur les échantillons positifs au test Roche cobas 4800 CT/NG Neisseria gonorrhoeae ? Comparaison du test Roche cobas 4800 CT/NG avec un test duplex opa/pap pour la détection des N gonorrhoeae. Sex Transm Infect 2014 ; 90 (4) : 303-308.
- Ursi D, Crucitti T, Smet H, Ieven M : Evaluation du test Bio-Rad Dx CT/NG/MG(R) pour la détection simultanée de Chlamydia trachomatis, Neisseria gonorrhoeae et Mycoplasma genitalium dans l’urine. European journal of clinical microbiology & infectious diseases : official publication of the European Society of Clinical Microbiology 2016 ; 35 (7) : 1159-1163.
- Wong KC, Ho BS, et al : Duplex PCR system for simultaneous detection of Neisseria gonorrhoeae and Chlamydia trachomatis in clinical specimens. Journal of clinical pathology 1995 ; 48 (2) : 101-104.
- Meyer T, Klos C et al : Évaluation des performances de la
- Kit de test PelvoCheck CT/NG pour la détection de Chlamydia trachomatis et Neisseria gonorrhoeae. BMJ open 2016 ; 6 (1) : e009894.
- Low N, Unemo M, et al : Diagnostic moléculaire de la gonorrhée : implications pour la résistance antimicrobienne et la menace d’une gonorrhée incurable. PLoS medicine 2014 ; 11 (2) : e1001598.
- Del Prete R, Ronga L et al : Détection et identification simultanées d’agents pathogènes d’IST par PCR multiplex en temps réel dans des échantillons de voies génitales dans une zone sélectionnée des Pouilles, une région du sud de l’Italie. Infection 2017 ; 45 (4) : 469-477.
- Fernandez G, Martro E, et al : Utilité d’un nouveau test PCR multiplex en temps réel pour le diagnostic des infections sexuellement transmissibles. Enferm Infecc Microbiol Clin 2016 ; 34(8) : 471-476.
- Bissessor M, Whiley DM et al : La persistance de l’ADN de Neisseria gonorrhoeae après le traitement pour la gonorrhée pharyngée et rectale est influencée par la susceptibilité aux antibiotiques et la réinfection. Clin Infect Dis 2015 ; 60 (4) : 557-563.
- Watchirs Smith LA, Hillman R et al : Tests au point d’intervention pour le diagnostic de l’infection à Neisseria gonorrhoeae : une revue systématique des caractéristiques opérationnelles et de performance. Sex Transm Infect 2013 ; 89 (4) : 320-326.
- Dierig A, Frei R, Egli A : The fast route to microbe identification : matrix assisted laser desorption/ionization-time of flight mass spectrometry (MALDI-TOF MS). Pediatr Infect Dis J 2015 ; 34 (1) : 97-99.
- Tarr P : Infections sexuellement transmissibles à Chlamydia trachomatis : Recommandations de la Commission fédérale pour la santé sexuelle (CFSS) et de la Société suisse d’infectiologie (SSI). Bulletin de l’OFSP 2017 ; 35 : 8-14.
- Unemo M, Shipitsyna E, Domeika M : Eastern European S, Reproductive Health Network Antimicrobial Resistance G. Gonorrhoea surveillance, laboratory diagnosis and antimicrobial susceptibility testing of Neisseria gonorrhoeae in 11 countries of the eastern part of the WHO European region. APMIS : acta pathologica, microbiologica, et immunologica Scandinavica 2011 ; 119 (9) : 643-649.
- Elias J, Frosch M, Vogel U : Neisseria. In : Jorgensen JH, ed. Manuel de microbiologie clinique. 11e éd. Washington, DC : ASM Press ; 2015 : 635-651.
- Jacobs E : Mycoplasmes et bactéries intracellulaires obligatoires. In : Neumeister B, Geiss HK, BRaun RW, Kimmig P, eds. Diagnostic microbiologique. Stuttgart, New York : Thieme ; 2009.
- Gaydos CA, Essig A, Vogel U : Chlamydaceae. In : Jorgensen JH, ed. Manuel de Mircobiologie Clinique. 11e éd. Washington : ASM Press ; 2015 : 1106-1121.
- Hobbs MM, van der Pol B et al. From the NIH : proceedings of a workshop on the importance of self-obtained vaginal specimens for detection of sexually transmitted infections. Maladies sexuellement transmissibles 2008 ; 35 (1) : 8-13.
- Ripa T, Nilsson P : A variant of Chlamydia trachomatis with deletion in cryptic plasmid : implications for use of PCR diagnostic tests. Euro surveillance : bulletin européen sur les maladies transmissibles = European communicable disease bulletin 2006 ; 11 (11) : E061109 2.
- Unemo M, Clarke IN : La nouvelle variante suédoise de Chlamydia trachomatis. Curr Opin Infect Dis 2011 ; 24(1) : 62-9.
- de Roche M, Sawatzki M et al : Lymphogranulome vénérien. Une vieille maladie dans un nouvel habit. Der Internist 2011 ; 52 (5) : 584-589.
- Goldenberger D, Dutly F, Gebhardt M : Analyse de 721 échantillons urogénitaux positifs à Chlamydia trachomatis provenant d’hommes et de femmes à l’aide d’un test PCR en temps réel spécifique au lymphogranulome vénérien L2. Euro surveillance : bulletin européen sur les maladies transmissibles = European communicable disease bulletin 2006 ; 11 (10) : E061018 4.
- Stoner BP, Cohen SE : Lymphogranulome vénérien 2015 : Présentation clinique, diagnostic et traitement. Clin Infect Dis 2015 ; 61 (8) : S865-873.
- Gaydos CA, Crotchfelt KA, et al : Molecular amplification assays to detect chlamydial infections in urine samples from high school female students and to monitor the persistance of chlamydial DNA after therapy. J Infect Dis 1998 ; 177 (2) : 417-424.
DERMATOLOGIE PRATIQUE 2017 ; 27(6) : 22-28