La diarrhée est définie par l’émission d’au moins trois selles non formées en l’espace de 24 heures. Si les symptômes disparaissent dans les 14 jours, on parle de diarrhée “aiguë” [1]. Les étiologies de la diarrhée sont multiples et comprennent, outre les infections, de nombreuses causes non infectieuses. Les signes d’un événement infectieux peuvent être, entre autres, un début aigu, de la fièvre et une accumulation de cas dans le temps [1]. Les diarrhées infectieuses aiguës contractées en ambulatoire sont fréquentes, généralement autolimitées et ne conduisent donc qu’exceptionnellement à une consultation et dans les cas les plus graves. Le présent article discute de l’évaluation microbiologique des patients symptomatiques présentant une diarrhée aiguë et une étiologie infectieuse présumée. Les diarrhées persistantes (>14 jours) ou chroniques (>quatre semaines) ne sont pas ciblées.
Quel que soit le mécanisme, la plupart des gastro-entérites bactériennes sont autolimitées et, à quelques exceptions près, ne nécessitent ni traitement antibiotique empirique ni culture de selles : jusqu’à l’obtention de leurs résultats, les symptômes de la plupart des patients ont disparu, ce qui signifie que les cultures de selles ne contribuent généralement pas aux soins des patients [2]. Selon les directives de la Société américaine de gastroentérologie, les cas cliniquement graves avec diarrhée sévère et persistante et déshydratation, fièvre supérieure à 38,5°C et présence de sang dans les selles sont exclus [3]. Des considérations diagnostiques particulières sont également indiquées chez les voyageurs de retour de voyage, chez les patients immunocompromis ainsi qu’en cas de diarrhée associée à l’hôpital et en cas d’accumulation de cas de maladie dans le temps.
Diagnostic standard par biologie moléculaire – Bactériologie fécale générale
Lors de l’examen microbiologique de la diarrhée bactérienne aiguë acquise en ambulatoire, les méthodes de biologie moléculaire pour la détection des pathogènes intestinaux bactériens les plus fréquents (tableau 1) sont beaucoup plus sensibles que la culture et ne sont guère influencées par des préanalyses inappropriées ou par l’administration d’antibiotiques. Les craintes que les techniques de biologie moléculaire puissent détecter des acides nucléiques spécifiques de l’agent pathogène mais biologiquement inactifs sont infondées, du moins pour les infections à Campylobacter , comme nous avons pu le montrer récemment : La réponse inflammatoire intestinale et la charge pathogène sont directement corrélées dans les infections à Campylobacter[4]. L’expérience acquise jusqu’à présent montre que la disponibilité rapide des résultats des examens est particulièrement importante pour les premiers soins aux patients. Les cultures ne sont ciblées que secondairement, en présence d’une détection positive de l’agent pathogène par biologie moléculaire (“test réflexe”), afin de disposer ainsi de l’isolat du patient pour effectuer des tests de résistance et des examens complémentaires importants sur le plan épidémiologique (par ex. sérotypage).

Les agents zoonotiques Campylobacter, Salmonella non typhoïde et EHEC font partie, avec les Shigella, des quatre pathogènes intestinaux bactériens les plus fréquemment signalés aux États-Unis [5]. Le diagnostic standard par biologie moléculaire (tableau 1) permet donc de détecter les pathogènes intestinaux bactériens les plus fréquents. Par exemple, la Suisse enregistre chaque année plus de 7000 infections à Campylobacterconfirmées en laboratoire, avec des pics en été pendant la saison des barbecues et pendant les fêtes de fin d’année [6]. C’est pourquoi, dans un contexte clinique et épidémiologique donné – par exemple en cas de suspicion clinique d’une infection à Campylobacter pendant les fêtes de fin d’année – la demande d’un diagnostic standard pour clarifier une diarrhée aiguë peut être suffisante et ciblée. Grâce à l’utilisation de méthodes indépendantes de la culture, les résultats des analyses sont généralement disponibles le jour même. L’envoi de plusieurs échantillons de patients par épisode n’est plus nécessaire, ce qui est dû d’une part à la disponibilité en temps réel des résultats d’analyse et d’autre part à la grande sensibilité des méthodes de biologie moléculaire. Nous pensons que le fait de ne pas envoyer plus d’un échantillon par patient et par épisode pourrait permettre de réaliser des économies.
Tous les échantillons de selles testés positifs sont mis en culture de manière ciblée afin de disposer de l’isolat du patient correspondant pour un test de résistance et d’autres examens complémentaires importants sur le plan épidémiologique, comme le sérotypage des salmonelles (test réflexe). Ces résultats ne sont généralement disponibles que plusieurs jours plus tard, car les méthodes basées sur la culture prennent beaucoup de temps. Il n’est pas rare que des isolats de patients soient également envoyés au Centre national des bactéries entéropathogènes et des listeria (NENT) pour une caractérisation ou une confirmation plus poussée [7].
Au cours du traitement par culture d’échantillons de selles positifs par biologie moléculaire, nous observons parfois que les milieux de culture mis en place restent négatifs et que l’agent pathogène indiqué ne peut pas être cultivé. Ce phénomène est particulièrement fréquent lors de la culture de Campylobacter et de Shigella. Dans ce contexte, c’est l’occasion de souligner l’importance de la pré-analyse et du transport des échantillons pour la détection des agents pathogènes par culture. Les échantillons de selles fraîches doivent être traités dans les deux heures suivant leur prélèvement au laboratoire ; ce délai est particulièrement critique pour la survie de Campylobacter et de Shigella. Si un échantillon de selles frais ne peut pas être traité au laboratoire dans les deux heures suivant son prélèvement, il doit être placé dans un tube contenant le milieu de transport Cary-Blair et envoyé au laboratoire [2].
Diagnostic orienté vers le syndrome
Le diagnostic axé sur les syndromes implique l’utilisation de techniques de biologie moléculaire qui permettent d’analyser simultanément des échantillons de patients pour détecter la présence de plus de 20 agents bactériens, parasitaires et viraux, en fonction de la présentation clinique ou du syndrome présent. La composition des batteries d’agents pathogènes est basée sur des données globales concernant l’épidémiologie de chaque agent pathogène (tableau 2).
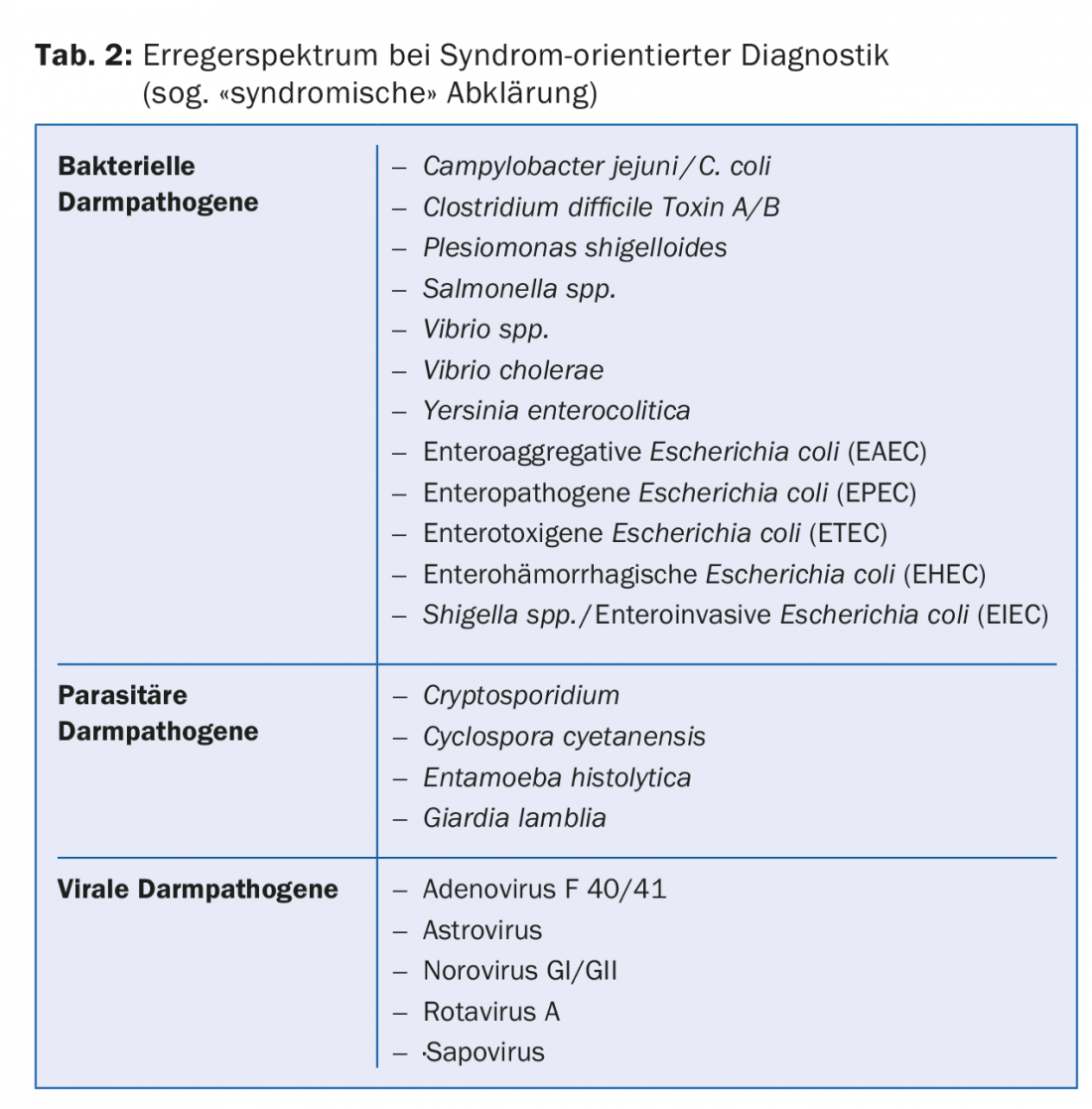
Contrairement à la procédure standard, les agents pathogènes qui ne correspondent pas à l’épidémiologie locale sont également détectés. Cela rend l’utilisation de batteries d’agents pathogènes particulièrement précieuse dans l’évaluation des patients de retour de voyage et des patients immunocompromis chez qui on soupçonne une diarrhée infectieuse aiguë. Un examen orienté sur les syndromes peut également être utile dans le contexte de cas de maladie associés à l’hôpital ou en cas d’accumulation dans le temps de cas de maladie d’étiologie incertaine (fig. 1).

Infections multiples
L’utilisation de larges batteries d’agents pathogènes lors de l’examen microbiologique initial de la diarrhée aiguë rend de plus en plus évident le fait que les infections multiples sont probablement plus fréquentes chez nous qu’on ne le pensait jusqu’à présent [8]. D’après notre expérience, les infections multiples avec deux agents pathogènes intestinaux potentiels ou plus sont particulièrement fréquentes chez les voyageurs de retour de voyage. Cela correspond aux résultats de l’étude Global Enteric Multicenter Study (GEMS), qui a suivi de manière prospective plus de 9 000 enfants âgés de moins de cinq ans souffrant de diarrhée modérée à sévère dans sept pays d’Afrique et d’Asie du Sud-Est sur une période de 36 mois [9]. Au total, plus d’un pathogène intestinal a été identifié chez 45% de ces enfants. Il convient de noter que même chez les témoins sains, plus de deux pathogènes intestinaux potentiels ont été identifiés dans 31% des cas.
Diagnostic 2.0
La combinaison de la génétique moléculaire et de la culture (Diagnostic 2.0) combine les avantages d’une détection rapide, sensible et spécifique des agents pathogènes pour les soins immédiats aux patients avec la possibilité d’isoler et de caractériser plus en profondeur les agents pathogènes par culture. Les gastro-entérites infectieuses aiguës sont fréquentes, généralement autolimitées et ne conduisent qu’exceptionnellement à une consultation. Dans les cas graves, un examen microbiologique peut être indiqué [3]. Aujourd’hui, grâce aux progrès technologiques, nous disposons de plusieurs options de diagnostic. Les premières indications sont fournies par l’anamnèse et la présentation clinique du patient (Fig. 1). Toutes les options de diagnostic ont en commun la disponibilité rapide des résultats d’examen, en général le jour même si l’échantillon du patient est reçu avant 11 . Les résultats d’examen sont ensuite transmis au laboratoire d’analyses.
Diagnostic standard
Le diagnostic standard est suffisant pour détecter les pathogènes intestinaux bactériens les plus fréquemment associés à la diarrhée aiguë. La culture ciblée d’échantillons de patients positifs fait partie de l’enquête et ne doit pas être demandée spécifiquement (test réflexe). L’utilisation du kit d’infection intestinale pour le transport des échantillons améliore les taux de détection des cultures, en particulier pour Campylobacter et Shigella. Les isolats de patients sont disponibles pour des études supplémentaires, telles que les tests de résistance.
Selon le contexte clinique, il n’est pas rare que le diagnostic standard soit étendu à la détection sélective de norovirus et/ou de Clostridium difficile produisant des toxines. Ces deux analyses fournissent également des résultats le même jour.
Utilisation de larges batteries d’excitateurs
Le diagnostic axé sur le syndrome peut être supérieur au diagnostic standard dans des cas sélectionnés. Nous pensons qu’il s’agit notamment des patients de retour de voyage et des patients immunocompromis, ainsi que de certains cas de diarrhée associée à l’hospitalisation et d’une accumulation de cas de maladie dans le temps qui n’est pas claire. Là encore, la culture ciblée d’échantillons de patients testés positifs fait partie intégrante de l’enquête (test réflexe), dans la mesure du possible ; le kit dit d’infection intestinale est recommandé pour le transport des échantillons.
Voyageur de retour
Les Escherichia coli entérotoxinogènes (ETEC) sont responsables de la diarrhée des voyageurs dans près de 50% des cas, ce qui en fait la principale cause de diarrhée des voyageurs [1]. Les E. c oli entéro-aggrégatifs (EAEC) et les E. coli entéro-invasifs (EIEC) jouent également un rôle important dans ce domaine et, tout comme les ETEC, ne sont pas détectés par les diagnostics standard. Les infections multiples sont relativement fréquentes.
Patients immunocompromis
Les troubles gastro-intestinaux sont relativement fréquents chez les patients immunocompromis et il n’est pas rare qu’ils évoluent vers la chronicité. Dans ce contexte, il peut être difficile de distinguer une diarrhée infectieuse aiguë d’une aggravation transitoire dans le cadre de la pathologie sous-jacente, en particulier parce qu’en raison de l’immunodéficience, des pathogènes intestinaux potentiels plus rares peuvent être mis en cause en plus des pathogènes fréquents. Dans ce cas, le diagnostic axé sur les syndromes offre des avantages indéniables en couvrant un large éventail de pathogènes intestinaux bactériens, parasitaires et viraux et détecte également les infections multiples.
Diarrhée associée à l’hospitalisation
Les troubles gastro-intestinaux et les diarrhées sont relativement fréquents à l’hôpital et peuvent être dus à une perturbation de la flore intestinale due à un traitement antibiotique. Il faut distinguer les diarrhées causées par Clostridium difficile producteur de toxines, qui sont de plus en plus souvent contractées en ambulatoire [5]. Dans les services d’urgence, le triage efficace des patients atteints de diarrhée infectieuse revêt également une importance en termes d’hygiène hospitalière : les pathogènes à faible dose infectieuse tels que Shigella et EHEC, mais aussi les protozoaires et les virus, se transmettent particulièrement facilement à d’autres personnes et comportent un risque d’épidémies hospitalières [5]. L’identification en temps réel de ces patients est donc dans l’intérêt du patient et de l’institution.
Accumulation temporelle de cas de maladie d’étiologie incertaine
En cas d’accumulation dans le temps de cas de maladie avec une anamnèse peu concluante et une présentation clinique peu caractéristique, l’investigation orientée sur le syndrome des premiers cas de maladie peut être un moyen simple et finalement aussi rentable de clarifier rapidement une situation peu claire.
Conclusion
“J’envisage que dans un avenir proche, les méthodes de laboratoire conventionnelles visant à isoler des pathogènes spécifiques deviendront des outils de seconde ligne à déployer uniquement lorsque le dépistage multiplex le juge nécessaire”, a écrit le professeur Franz Allerberger de l’Agence autrichienne pour la santé et la sécurité alimentaire (AGES) [10]. Les avantages de la détection de l’agent pathogène par biologie moléculaire, indépendante de la culture, résident principalement dans la disponibilité rapide des résultats d’analyse et dans la relative insensibilité aux influences perturbatrices pendant le prélèvement et le transport des échantillons. Les inconvénients possibles sont que seuls les agents pathogènes connus peuvent être recherchés et détectés ; les agents pathogènes émergents ou les variantes d’agents pathogènes connus peuvent ne pas être détectés, bien qu’ils soient cliniquement pertinents. La combinaison avec les méthodes de détection par culture combine les avantages d’une détection rapide, sensible et spécifique des agents pathogènes pour les soins immédiats aux patients avec la possibilité d’isoler et de caractériser plus en profondeur les agents pathogènes par culture.
Reproduction avec l’aimable autorisation du Labormedizinisches Zentrum Dr. Risch AG, 3097 Bern-Liebefeld. D’abord publié dans Riport 81 (printemps 2016) : www.risch.ch/de/10123/riport.html.
Littérature :
- Mandell, Douglas, and Bennett’s Principles and Practice of Infectious Diseases, 8th ed. 2015.
- Humphries RM, et al : Diagnostic de laboratoire de la gastroentérite bactérienne. Clin Microbiol Rev 2015 ; 28 : 3.
- DuPont HL : Guidelines on acute infectious diarrhea in adults. The Practice Parameters Committee of the American College of Gastroenterology. Am J Gastroenterol 1997 ; 92 : 1962.
- Wohlwend N, et al : Evaluation of a multiplex real-time PCR assay for detecting major bacterial enteric pathogens in fecal specimens : intestinal inflammation and bacterial load are correlated in Campylobacter infections. J Clin Microbiol 2016 ; 54 : 2262-2266.
- DuPont HL : Diarrhée bactérienne. New Engl J Med 2009 ; 361 : 1560.
- www.blv.admin.ch/themen/04678/04711/04777/index.html?lang=de
- www.ils.uzh.ch/Diagnostik/NENT.html
- Spina A, et al : Spectrum of enteropathogens detected by the FilmArray GI Panel in a multicenter study of community-acquired gastroenteritis. Clin Microbiol Infect 2015 ; 21 : 719.
- Kotloff KL, et al. : Burden and aetiology of diarrheeal disease in infants and young children in developing countries (the Global Enteric Multicenter Study, GEMS) : a prospective, case-control study. Lancet 2013 ; 382 : 209.
- Allerberger F : Diarrhée aiguë : nouvelles perspectives. Clin Microbiol Infect 2015 ; 21 : 717.
PRATIQUE DU MÉDECIN DE FAMILLE 2016, 11(12) : 40-45











