Les troubles respiratoires du sommeil sont désormais reconnus comme un facteur de risque cardiaque. Elle peut non seulement déclencher des maladies circulatoires telles que l’hypertension et l’insuffisance cardiaque, mais aussi la fibrillation auriculaire. De ce fait, elle met souvent en péril le pronostic des patients sans être détectée et de manière insidieuse.
Ces dernières années, il est apparu que l’apnée obstructive du sommeil (AOS) est une maladie fréquente chez les adultes. Elle se caractérise par des apnées et une hypoxie répétées, causées par le collapsus des voies aériennes supérieures pendant le sommeil, malgré les efforts respiratoires du diaphragme. Cinq apnées ou plus par heure de sommeil sont généralement considérées comme anormales, les patients gravement atteints en font plusieurs centaines par nuit. La plupart des apnées et hypopnées se terminent par un réveil temporaire du sommeil suivi d’une hyperventilation.
Hypertension artérielle et apnée du sommeil
La pression artérielle nocturne est plus élevée chez les patients atteints de SAOS et il est de plus en plus prouvé que le SAOS est également un facteur de risque indépendant d’hypertension artérielle pendant la journée. Bien que les mécanismes exacts ne soient pas encore clairs, on pense qu’une augmentation persistante du tonus sympathique, causée par une hypoxie et un éveil chroniques et répétés, sont les mécanismes clés des augmentations de la pression artérielle à court et à long terme dans le SAOS.
La pression positive continue nasale (nCPAP) est devenue le traitement standard du SAOS et a montré qu’elle réduisait les symptômes et améliorait la qualité de vie des patients atteints de SAOS. Cependant, des études contrôlées ont montré soit l’absence d’effet, soit une faible réduction de la pression artérielle de 1,4 ou 2,5 mm Hg. L’efficacité de ce traitement sur les séquelles cardiovasculaires chez les patients atteints de SAOS a été globalement remise en question, explique le privat-docent. Dr Jan Börgel, St. Barbara Klinik Heessen Innere Medizin Hamm, Allemagne [1].
Effet antihypertenseur du traitement par PPC
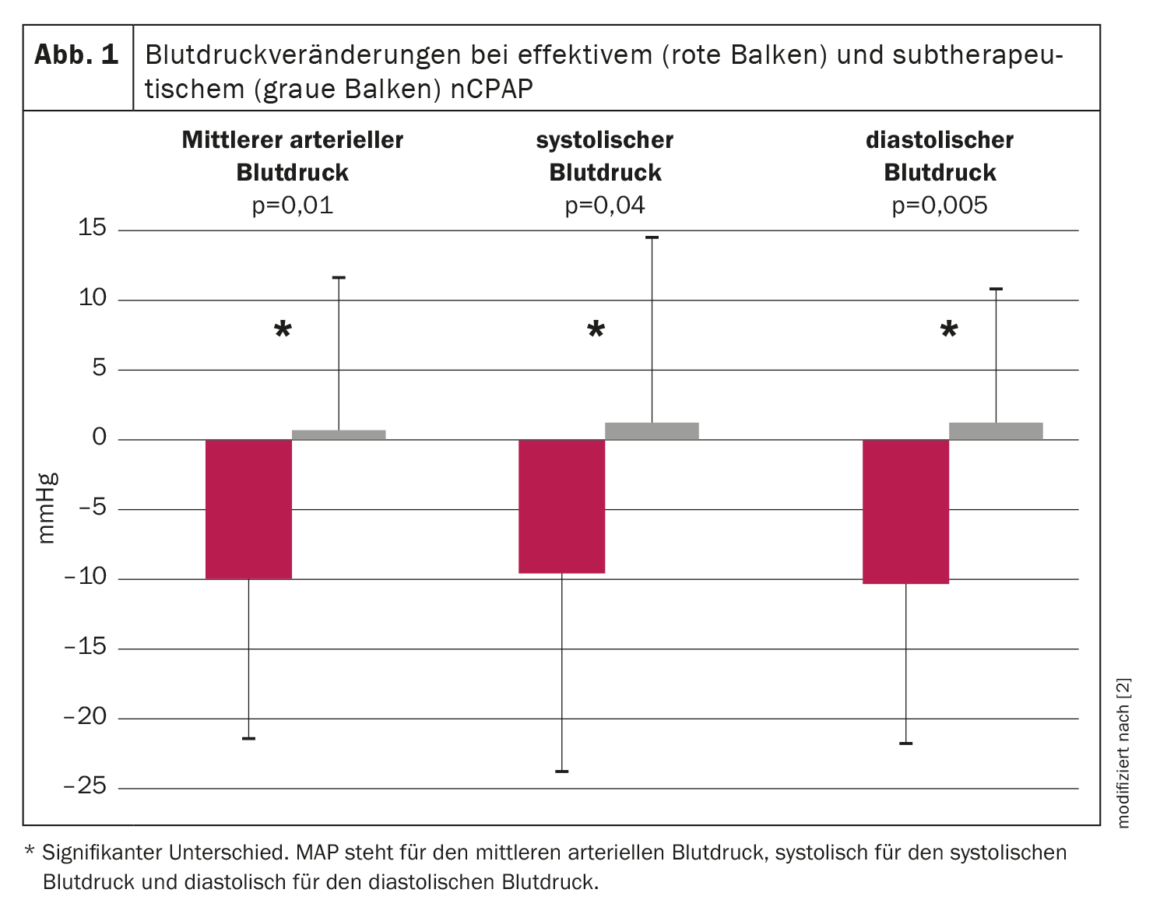
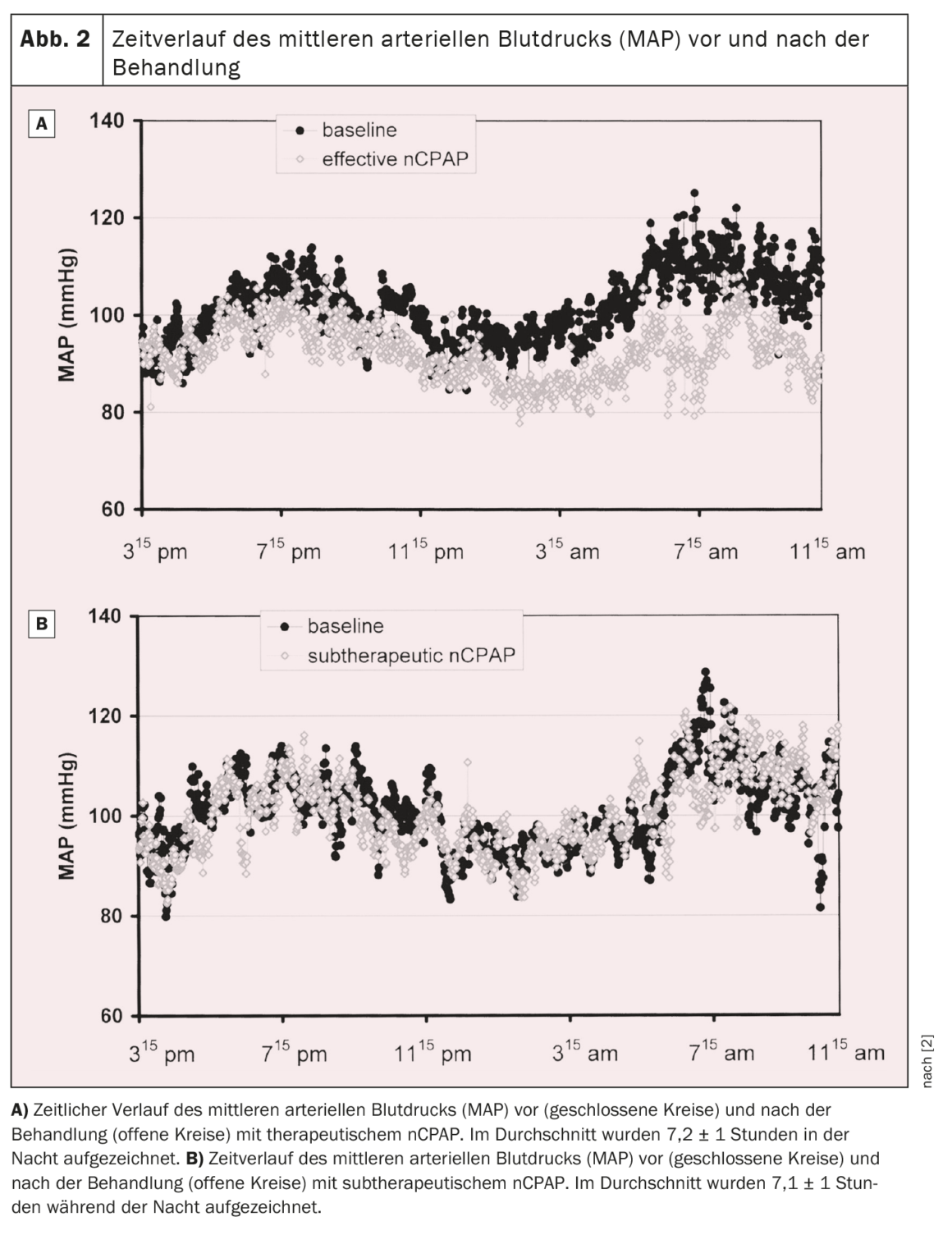
Une étude prospective randomisée a donc été menée pour évaluer l’effet de la nCPAP sur la pression artérielle des patients atteints du SAOS. Au total, 60 patients consécutifs souffrant d’un SAOS modéré à sévère ont été randomisés pour recevoir soit un traitement efficace, soit un traitement sous-thérapeutique par PPCN pendant neuf semaines en moyenne. Une polysomnographie nocturne et un enregistrement continu non invasif de la pression artérielle pendant 19 heures ont été réalisés avant et pendant le traitement. Les apnées et les hypopnées ont été réduites de ≈95% et 50% respectivement dans les groupes thérapeutique et sous-thérapeutique. La pression artérielle moyenne a diminué de 9,9 ± 11,4 mm Hg dans le groupe nCPAP thérapeutique au cours de la période d’enregistrement de 19,1 ± 1,3 heures, alors qu’elle a augmenté de 0,6 ± 10,8 mm Hg dans le groupe nCPAP sous-thérapeutique (p=0,01, interaction ANOVA temps par groupe). Les pressions artérielles diastolique et systolique ont également diminué de manière significative sous nCPAP thérapeutique, respectivement de 10,3 ± 11,4 mm Hg et 9,5 ± 15,0 mm Hg (p<0,005 et p=0,04 respectivement, temps d’interaction ANOVA par groupe) par rapport à la nCPAP sous-thérapeutique (Figure 1). La baisse de la pression artérielle moyenne sous nCPAP efficace a été observée à la fois pendant la journée (-10,0 ± 12,1 mmHg) et la nuit (-10,3 ± 15,3 mmHg). L’évolution temporelle de la pression artérielle moyenne avant et pendant le traitement pour les deux groupes est présentée dans la figure 2 [2]. Dans le groupe ayant reçu un traitement efficace, la pression artérielle moyenne a diminué pendant toute la période d’enregistrement, la baisse la plus importante se produisant la nuit et le matin jusqu’à environ midi. L’après-midi et le soir, la baisse de la pression artérielle était toujours présente, mais moins prononcée que pendant la nuit et la première moitié de la journée [2].
Une méta-analyse d’essais contrôlés randomisés (ECR) a continué à quantifier l’ampleur de l’effet de la réduction de la pression artérielle par le traitement CPAP par rapport à d’autres traitements passifs (CPAP factice, comprimés placebo, mesures conservatoires) ou actifs (appareil de déglutition, médicaments antihypertenseurs). Sur 1.599 articles, 31 ECR ont été inclus, comparant la PPC soit à un traitement passif soit à un traitement actif. Dans l’analyse avec effets aléatoires par rapport au traitement passif (29 ECR, 1820 sujets), une différence moyenne ± SEM nette de 2,6 ± 0,6 mmHg pour la pression artérielle systolique et de 2,0 ± 0,4 mmHg pour la pression artérielle diastolique a été observée, ce qui favorise le traitement par PPC (p<0,001). Dans les études de surveillance ambulatoire de la pression artérielle sur 24 heures, qui ont fourni des données sur les périodes de jour et de nuit, la différence moyenne de pression artérielle systolique et diastolique était respectivement de 2,2 ± 0,7 et 1,9 ± 0,6 mmHg pendant la journée et de 3,8 ± 0,8 et 1,8 ± 0,6 mmHg pendant la nuit. Dans l’analyse de régression, un indice d’apnée/hypopnée plus élevé au début de l’étude était associé à une diminution nette moyenne plus importante de la pression artérielle systolique (β ± SE, 0,08 ± 0,04). Les résultats ont montré que le traitement par PPC réduit significativement la pression artérielle chez les patients souffrant de SAOS, mais avec une taille d’effet limitée. Les patients présentant des épisodes d’apnée fréquents peuvent être ceux qui bénéficient le plus du traitement [3].
Une autre étude a analysé l’effet de la PPC sur la pression artérielle (PA) chez des patients souffrant de SAOS et d’hypertension résistante. Ont été inclus les ECR évaluant l’effet de la PPC sur la pression artérielle chez les patients souffrant de SAOS et d’hypertension résistante, indexés dans MEDLINE, Embase et la Cochrane Library depuis le début jusqu’au 20 mars 2015. Au total, cinq ECR répondant aux critères d’inclusion ont été identifiés. Les changements regroupés après le traitement par PPC pour la pression artérielle systolique et diastolique ambulatoire sur 24 heures (DBP) étaient de -4,78 mm Hg (intervalle de confiance à 95% [CI], -7,95 à -1,61) et -2,95 mm Hg (IC à 95%, -5,37 à -0,53) en faveur du groupe PPC. La PPC a également été associée à une réduction de la DBP nocturne (différence moyenne, -1,53 mmHg, IC à 95%, -3,07-0). Ces résultats suggèrent une réduction favorable de la pression artérielle sous traitement par PPC chez les patients souffrant de SAOS et d’hypertension résistante [4].
L’exposition à l’hypoxie prédit la mortalité associée aux MCV
Jusqu’à présent, les effets du SAOS sur les événements MCV mortels restaient controversés, car les associations entre l’exposition et le résultat n’étaient pas cohérentes. Des données récentes ont suggéré qu’il n’y avait pas de lien entre le traitement par pression positive des voies aériennes et la prévention secondaire des MCV.
Jusqu’à présent, la médecine du sommeil s’appuie sur la quantification de la fréquence des apnées et des hypopnées observées pendant le sommeil (indice d’apnées-hypopnées, IAH) pour diagnostiquer le SAOS et déterminer sa sévérité. Sur la base de ces indicateurs, il a été constaté que le SAOS prédisait modestement la mortalité, mais les résultats se limitaient en grande partie aux hommes d’âge jeune à moyen. On s’est demandé si l’IAH permettait d’évaluer les principaux aspects du SAOS qui ont un impact négatif sur le système cardiovasculaire. L’apnée obstructive du sommeil est une maladie dans laquelle l’obstruction répétée des voies respiratoires affecte la ventilation et entraîne une perturbation des gaz du sang. Par conséquent, l’IAH, qui est un simple décompte des épisodes obstructifs par heure de sommeil sans tenir compte de la durée et de la profondeur du trouble ventilatoire ou des modifications des gaz du sang, ne constitue pas une description complète des troubles physiologiques. Plusieurs études d’observation ont montré que les mesures de l’hypoxémie nocturne, telles que le pourcentage de temps passé pendant le sommeil avec une saturation en oxygène inférieure à 90% (TST90), permettent de mieux prédire les MCV et la mortalité totale que l’IAH. Cependant, le TST90 et les mesures similaires caractérisent non seulement l’hypoxémie intermittente secondaire à des événements obstructifs, mais aussi l’hypoxémie persistante, par exemple en raison d’une bronchopneumopathie chronique obstructive (BPCO) ou d’une hypoventilation chez les obèses, qui n’est pas liée à l’obstruction des voies aériennes supérieures et au SAOS.
Une étude a donc tenté de développer une mesure de la sévérité du SAOS qui quantifie l’hypoxémie liée au SAOS, dont on pensait qu’elle prédisait significativement la mortalité liée aux MCV après ajustement pour les indices de polysomnographie (PSG) mesurés en routine. En conséquence, une mesure a été développée pour capturer la fréquence, la durée et la profondeur de la contribution des événements respiratoires à l’hypoxémie artérielle, en particulier l'”aire sous la courbe” de la désaturation en oxygène associée aux apnées et hypopnées individuelles – la “charge hypoxique” spécifique au SAOS.
Les échantillons provenaient de deux études de cohorte : la Résultats des troubles du sommeil chez les hommes âgés (MrOS), à laquelle ont participé 2 743 hommes âgés de 76,3 ± 5,5 ans, et Étude sur la santé cardiaque au repos (SHHS), qui comprenait 5111 adultes d’âge moyen et avancé (52,8% de femmes) âgés de 63,7 ± 10,9 ans. Les résultats incluaient la mortalité totale et la mortalité liée aux maladies cardiovasculaires (MCV). L’exposition à l’hypoxie a été déterminée en mesurant l’aire sous la courbe de saturation finale par rapport à la situation initiale avant l’événement. Des modèles de Cox ont été utilisés pour calculer les rapports de risque ajustés pour l’exposition hypoxique. Contrairement à l’IAH, la “charge hypoxique” prédisait fortement la mortalité due aux MCV et la mortalité totale (uniquement pour les MrOS). Les personnes de l’étude MrOS exposées à l’hypoxie dans les deux quintiles les plus élevés avaient un hazard ratio de 1,81 [intervalle de confiance (IC) à 95% : 1,25-2,62] et de 2,73 (IC à 95% : 1,71-4,36), respectivement. De la même manière, le groupe dans le SHHS avec une “charge hypoxique” dans le quintile le plus élevé présentait un ratio de risque de 1,96 (IC 95% 1,11-3,43). La “charge hypoxique”, un signal facile à déduire de l’étude sur le sommeil nocturne, prédit donc la mortalité due aux MCV dans différents groupes de population. Les résultats suggèrent que non seulement la fréquence, mais aussi la profondeur et la durée des obstructions des voies respiratoires supérieures liées au sommeil sont des caractéristiques importantes caractérisant la maladie [5].
Le phénotype de somnolence excessive a été identifié comme un prédicteur d’événements cardiovasculaires émergents et récurrents, mais pas de la mortalité cardiovasculaire. Néanmoins, même dans les essais cliniques qui se sont concentrés sur les participants présentant des symptômes minimes ou sans somnolence, un bénéfice limité du traitement du SAOS a été constaté en termes de pression artérielle et de résultats cardiovasculaires [6].
Réduction de la pression artérielle – statut de Dipper en cas de SAOS/hypertension non traités
Une analyse post-hoc a examiné l’effet de la PPC sur la pression artérielle en tenant compte du schéma circadien de la pression artérielle chez des patients hypertendus non traités. Les sujets ont été classés en fonction du rapport de dipping (dipper/non-dipper). Au total, 272 hypertendus ont été inclus dans l’analyse (113 dippers et 159 non-dippers). Les variables cliniques et polysomnographiques initiales étaient similaires dans les deux groupes. Le traitement par PPC des patients non dippers était associé à une réduction des variables de pression artérielle ambulatoire sur 24 heures et des mesures de pression artérielle ambulatoire la nuit. Cependant, un effet non significatif a été observé dans le groupe Dipper. Les différents effets de la PPC entre les groupes étaient de -2,99 mmHg (IC à 95% -5,92 à -0,06 mmHg) pour la pression artérielle ambulatoire moyenne sur 24 heures et de -5,35 mmHg (IC à 95% -9,01 à -1,69 mmHg) pour la pression artérielle ambulatoire moyenne pendant la nuit. Les résultats montrent un effet différent du traitement par PPC sur la pression artérielle chez les patients hypertendus en fonction du modèle circadien. Selon cette étude, seuls les patients non dippers ont bénéficié du traitement par PPC en termes de réduction de la pression artérielle [7].
Fibrillation auriculaire et apnée du sommeil
Le SAOS ne provoque pas seulement une hypoxémie, une hypercapnie, un dysfonctionnement autonome, une excitation et d’importantes modifications négatives de la pression intrathoracique, explique le Pr. Anil-Martin Sinha, Sana Klinikum Hof GmbH Klinik für Kardiologie, Nephrologie, Pneumologie und interntischen Intensivmedizin Hof, Allemagne [8], la pathophysiologie du SAOS entraîne également une inflammation, un dysfonctionnement endothélial, une coagulation déséquilibrée, des modifications hémodynamiques, un remodelage électrique/structurel des oreillettes/ventricules et une dérégulation autonome. Ces facteurs sont associés à l’apparition et au maintien de la fibrillation auriculaire. La physiopathologie du SAOS est donc multifactorielle et de nombreux mécanismes complexes non résolus sont impliqués dans le développement de la fibrillation auriculaire, ce qui a des conséquences à la fois aiguës et à long terme sur les substrats arythmogènes [9].
Expression de GJA1 et remodelage de l’oreillette gauche
Des études ont montré que les gènes qui contrôlent l’inflammation, les jonctions gap et la fibrose auriculaire sont liés au mécanisme physiopathologique de la fibrillation auriculaire. Chez l’homme, la protéine connexine-43 est codée par le gène GJA1 sur le chromosome 6 et est exprimée par les cardiomyocytes auriculaires et ventriculaires, les cellules musculaires lisses vasculaires, les cellules endothéliales, les monocytes et les macrophages. La continuité électrique du myocarde est maintenue par des connexines situées dans des jonctions gap qui maintiennent le couplage intercellulaire à faible résistance. Des différences dans l’expression de la connexine-43 entraînent une conduction discontinue non uniforme et des arythmies cardiaques. Les exosomes, des vésicules liées à la membrane d’un diamètre de 40 à 100 nm, sont libérés par de nombreux types de cellules, notamment les cellules sanguines, les cellules endothéliales, les cellules immunitaires, les plaquettes sanguines et les cellules musculaires lisses, et sont présents dans presque tous les fluides biologiques. Les ARN contenus dans les exosomes peuvent être absorbés par des cellules voisines ou éloignées lorsque les exosomes circulent, et modulent ensuite les cellules réceptrices. La découverte de leur fonction dans les échanges génétiques entre cellules a permis aux exosomes de bénéficier d’une attention croissante.
Une étude a examiné les prédicteurs de l’apparition de la fibrillation auriculaire chez les patients souffrant de SAOS et les effets des exosomes de patients souffrant de SAOS avec et sans fibrillation auriculaire sur l’expression de GJA1 et d’autres gènes de l’inflammation et de la fibrose impliqués dans la physiopathologie de la fibrillation auriculaire dans les cellules HL-1 afin de clarifier leur lien avec l’apparition de la fibrillation auriculaire. L’étude a permis de tirer plusieurs conclusions importantes. Tout d’abord, les patients souffrant de SAOS et de fibrillation auriculaire avaient plus de diabète sucré, une efficacité du sommeil plus faible, une FEVG plus basse et une oreillette gauche (AL) plus grande que les patients souffrant de SAOS sans fibrillation auriculaire. Deuxièmement, la taille de l’oreillette gauche était le prédicteur le plus significatif de l’apparition d’une fibrillation auriculaire chez les patients souffrant de SAOS, la valeur seuil étant de 38,5 mm. Troisièmement, l’expression du gène de l’ARNm de GJA1 était plus faible et le TNF-α plus élevé dans les cellules HL-1 incubées avec des exosomes de patients atteints de SAOS souffrant de fibrillation auriculaire que dans celles incubées avec des exosomes de patients atteints de SAOS sans fibrillation auriculaire. Après contrôle de l’âge et du sexe, l’expression génétique de GJA1 était toujours plus faible dans les cellules HL-1 incubées avec des exosomes de patients atteints de SAOS et souffrant de fibrillation auriculaire. Enfin, l’expression du gène GJA1 était négativement corrélée à l’IAH et à l’indice de désaturation de l’oxygène chez les patients atteints de SAOS avec fibrillation auriculaire, en particulier pendant la phase non-REM [10].
Prévalence de l’apnée du sommeil non diagnostiquée en cas de fibrillation auriculaire
L’objectif d’une autre étude était de déterminer la proportion de patients atteints de fibrillation auriculaire (FA) chez qui l’apnée du sommeil n’avait pas été diagnostiquée non plus, et d’étudier l’impact de ce diagnostic sur l’observance du traitement de l’apnée du sommeil. L’étude prospective a porté sur 188 patients consécutifs atteints de fibrillation auriculaire sans diagnostic préalable d’apnée du sommeil et pour lesquels une ablation de la fibrillation auriculaire était prévue. Le test d’apnée du sommeil à domicile était positif chez 155 des 188 patients (82,4%) ; parmi ces 155, 127 (82%) avaient une composante obstructive prédominante et 28 (18%) une apnée du sommeil mixte avec une composante centrale de 15,2 ± 7,4%. La sévérité de l’apnée du sommeil était légère pour 43,8%, modérée pour 32,9% et sévère pour 23,2%. La sensibilité et la spécificité du questionnaire STOP-BANG étaient respectivement de 81,2% et 42,4%. Dans une analyse multivariée, STOP-BANG n’était pas prédictif de l’apnée du sommeil (Odds Ratio : 0,54 ; intervalle de confiance à 95% : 0,17-1,76 ; p=0,31). Chez 73 des 85 patients (85,9%) souffrant d’apnée du sommeil modérée ou sévère, un traitement par respirateur à pression positive continue a été instauré et 68 des 73 patients (93,1%) n’ont présenté aucun symptôme après une période de suivi moyenne de 21 ± 6,2 mois. Par conséquent, l’apnée du sommeil est extrêmement fréquente chez les patients atteints de fibrillation auriculaire référés pour ablation, dont une grande partie n’est pas diagnostiquée, car la valeur prédictive des symptômes d’apnée du sommeil est limitée dans ce groupe de fibrillation auriculaire. Le dépistage de l’apnée du sommeil a permis d’obtenir un taux élevé de patients adhérant à la pression positive continue à long terme [11].
Effets de la PPC sur le substrat de la fibrillation auriculaire
L’étude SLEEP-AF a évalué l’impact du traitement du SAOS sur le substrat auriculaire en cas de fibrillation auriculaire. Pour ce faire, 24 patients consécutifs présentant un SAOS au moins modéré (IAH ≥15) et adressés pour un traitement de la fibrillation auriculaire ont été recrutés. Les participants ont été randomisés selon un ratio 1:1 et ont reçu soit une pression positive continue (PPC), soit aucune thérapie (n=12 avec PPC ; n=12 sans PPC). Tous les participants ont subi un examen électrophysiologique invasif (cartographie à haute densité de l’oreillette droite) au début et après au moins six mois. Les variables de résultat étaient la tension auriculaire (mV), la vitesse de conduction (m/s), la surface auriculaire <0,5 mV (%), le pourcentage de points complexes (%) et la période réfractaire effective de l’oreillette (ms). Les caractéristiques cliniques et les paramètres électrophysiologiques étaient similaires dans les deux groupes au début du traitement. L’observance du traitement par PPC était élevée (utilisation de l’appareil : 79% ± 19% ; utilisation moyenne/jour : 268 ± 91 min) et a entraîné une réduction significative de l’IAH (réduction moyenne : 31 ± 23 événements/h). En ce qui concerne la pression artérielle et l’indice de masse corporelle, il n’y a pas eu de différence entre les groupes au fil du temps. Lors du suivi, le groupe CPAP a présenté une vitesse de conduction plus élevée (0,86 ± 0,16 m/s vs 0,69 ± 0,12 m/s ; p (temps × groupe) = 0,034), des tensions significativement plus élevées (2,30 ± 0,57 mV vs 1,94 ± 0,72 mV ; p<0,05) et une proportion plus faible de points complexes (8,8% ± 3,61% vs 11,93% ± 4,94% ; p=0,011) par rapport au groupe témoin. Le traitement par PPC a également eu tendance à réduire la proportion de surface auriculaire <0,5 mV (1,04% ± 1,41% vs 4,80% ± 5,12% ; p=0,065). Les résultats montrent que le traitement par PPC entraîne une inversion du remodelage auriculaire dans la fibrillation auriculaire et fournit des preuves mécanistiques en faveur du traitement du SAOS dans la fibrillation auriculaire [12].
Lien entre l’apnée du sommeil détectée par le DAI et la fibrillation auriculaire
L’indice de perturbation respiratoire (RDI) calculé par un algorithme pour les défibrillateurs cardioverteurs implantables (DAI) permet de détecter avec précision les apnées du sommeil (AS) sévères. Une étude récente a testé si le RDI pouvait également prédire l’exposition à la fibrillation auriculaire. La moyenne hebdomadaire du RDI, calculée pendant toute la période de suivi et sur une période d’une semaine avant l’étude sur le sommeil, a été prise en compte. Une fibrillation auriculaire sévère (RDI ≥30 épisodes/h) a été diagnostiquée chez 92 (56%) patients au moment de l’étude sur le sommeil. Au cours du suivi, une charge de fibrillation auriculaire ≥5 minutes/jour a été documentée chez 70 (43%) patients, ≥6 heures/jour chez 48 (29%) et ≥23 heures/jour chez 33 (20%). Le RDI ≥30 épisodes/h enregistré par les appareils au moment de la polygraphie et l’indice d’apnée-hypopnée ≥30 épisodes/h mesuré par la polygraphie n’étaient pas associés à la survenue des critères d’évaluation lorsqu’un modèle de régression de Cox était utilisé. Cependant, en utilisant un modèle dépendant du temps, un RDI moyen hebdomadaire mesuré en continu ≥30 épisodes/h était indépendant d’une exposition à la FA ≥5 min/jour (Hazard Ratio [HR]2,13, intervalle de confiance de 95%. [CI]: 1,24-3,65, p=0,006), ≥6 h/jour (HR : 2,75, IC à 95% : 1,37-5,49, p=0,004) et ≥23 h/jour (HR : 2,26, IC à 95% : 1,05-4,86, p=0,037) sont associés. Les résultats montrent que chez les patients atteints d’insuffisance cardiaque avec une fibrillation auriculaire sévère diagnostiquée par le CIM, la probabilité de subir un épisode de fibrillation auriculaire est de deux à trois fois plus élevée selon le seuil de la charge quotidienne de fibrillation auriculaire [13].
Insuffisance cardiaque et apnée du sommeil
Les troubles du sommeil sont fréquents chez les patients atteints d’insuffisance cardiaque à fraction d’éjection réduite (IFCR), le taux de prévalence étant de 50 à 75% selon les rapports. Le SAOS, en particulier, est plus fréquent chez les patients souffrant d’insuffisance cardiaque que dans la population générale. L’apnée centrale du sommeil, qui peut se manifester par une respiration de Cheyne-Stokes, est observée chez 25 à 40% des patients souffrant d’insuffisance cardiaque avec une fraction d’éjection réduite. Michael Arzt, Universitätsklinikum Regensburg Klinik und Poliklinik für Innere Med. II, Kardiologie Regensburg, Allemagne [14]. Il existe un certain nombre de mécanismes par lesquels l’apnée centrale du sommeil peut avoir un impact négatif sur la fonction cardiaque, notamment une activité accrue du système nerveux sympathique et une hypoxémie intermittente. En outre, l’apnée centrale du sommeil est un marqueur de risque indépendant de mauvais pronostic et de décès chez les patients souffrant d’insuffisance cardiaque.
Dans l’étude canadienne CANPAP(Canadian Continuous Positive Airway Pressure for Patients with Central Sleep Apnea and Heart Failure), des patients souffrant d’insuffisance cardiaque et d’apnée centrale du sommeil ont été traités de manière aléatoire soit par CPAP, soit sans CPAP. L’étude a été interrompue avant la fin et n’a montré aucun effet positif de la PPC sur la morbidité ou la mortalité. Une analyse post-hoc a suggéré que la mortalité pourrait être plus faible si l’indice d’apnée-hypopnée (IAH ; le nombre d’événements d’apnée ou d’hypopnée par heure de sommeil) était réduit à moins de 15 événements par heure [15].
Effets de la servo-ventilation adaptative
Les deux types de troubles respiratoires du sommeil, l’apnée obstructive du sommeil (AOS) et l’apnée centrale du sommeil (ASC), sont fréquents chez les patients souffrant d’insuffisance cardiaque et de fraction d’éjection réduite (FERC). Jusqu’à présent, il n’était pas clair si le traitement des troubles respiratoires du sommeil par servoventilation adaptative (ASV) réduisait la morbidité et la mortalité chez ces patients. La servoventilation adaptative est une thérapie ventilatoire non invasive qui soulage efficacement l’apnée centrale du sommeil en fournissant une aide à la pression inspiratoire servocommandée en plus de la pression expiratoire positive des voies aériennes.
L’étude SERVE-HF (Traitement des troubles respiratoires du sommeil avec apnée centrale du sommeil prédominante par ventilation assistée adaptative chez les patients atteints d’insuffisance cardiaque) a étudié l’impact de l’ASV (AutoSet CS, ResMed) sur la survie et les résultats cardiovasculaires de patients souffrant d’insuffisance cardiaque à fraction d’éjection réduite et d’apnée du sommeil principalement centrale, traités en plus du traitement médical prescrit par les directives. Au total, 1 325 patients présentant une fraction d’éjection ventriculaire gauche inférieure ou égale à 45 %, un indice d’apnée-hypopnée (IAH) de 15 événements ou plus (événements d’apnée ou d’hypopnée) par heure et une prédominance d’événements centraux ont été assignés au hasard à un traitement médical basé sur des lignes directrices avec ASV ou à un traitement médical basé sur des lignes directrices seul (contrôle). Le critère d’évaluation principal dans l’analyse du délai d’intervention était le premier événement mortel, quelle qu’en soit la cause, une intervention cardiovasculaire visant à sauver la vie (transplantation cardiaque, implantation d’un système d’assistance cardiaque, réanimation après un arrêt cardiaque soudain ou un choc vital approprié) ou une hospitalisation non planifiée en raison d’une aggravation de l’insuffisance cardiaque.
Dans le groupe ASV, la valeur moyenne de l’IAH à 12 mois était de 6,6 événements par heure. L’incidence du critère principal n’était pas significativement différente entre le groupe ventilé par ASV et le groupe témoin (54,1% et 50,8% respectivement ; hazard ratio, 1,13 ; intervalle de confiance à 95% [CI], 0,97-1,31 ; p=0,10). La mortalité totale et la mortalité cardiovasculaire étaient significativement plus élevées dans le groupe ASV que dans le groupe témoin (hazard ratio pour les décès toutes causes confondues, 1,28 ; IC 95%, 1,06-,55 ; p=0,01 ; et hazard ratio pour les décès cardiovasculaires, 1,34 ; IC 95%, 1,09-1,65 ; p=0,006). L’ASV n’a donc pas eu d’impact significatif sur le critère d’évaluation principal chez les patients souffrant d’insuffisance cardiaque à fraction d’éjection réduite et d’apnée centrale du sommeil prédominante, mais la mortalité totale et la mortalité cardiovasculaire étaient toutes deux augmentées sous ce traitement [16]. Plusieurs explications ont été proposées pour expliquer comment l’ASV peut déclencher des arythmies ventriculaires, par exemple des changements rapides des gaz sanguins, du pH et du niveau de potassium, ainsi que des effets sur le retour veineux et la tension de la paroi transmurale dus à la pression positive appliquée aux voies aériennes.
Une analyse complémentaire de l’étude principale SERVE-HF a donc évalué l’impact de l’ASV sur l’exposition aux arythmies ventriculaires nocturnes chez les patients traités par ASV souffrant d’HFrEF et d’apnée centrale du sommeil. Entre le début de l’étude et les périodes de 3 et 12 mois de suivi, le nombre de complexes ventriculaires prématurés (contrôle : médiane 19,7, 19,0 et 19,0 ; ASV : 29,1, 29,0 et 26,0 événements/h ; p=0,800) et la survenue de ≥1 tachycardies ventriculaires non interrompues/nuit (contrôle : 18, 25 et 18% des patients ; ASV : 24, 16 et 24% des patients ; p=0,095) étaient similaires dans les groupes contrôle et ASV. L’ajout de l’ASV au traitement médical prescrit n’a pas eu d’effet significatif sur les ectopies ventriculaires nocturnes ou les tachyarythmies sur une période de 12 mois chez des patients vivants souffrant d’HFrEF et d’apnée centrale du sommeil. Les résultats ne soutiennent pas l’hypothèse selon laquelle l’ASV peut entraîner une mort cardiaque subite en provoquant des tachyarythmies ventriculaires [17].
L’étude ADVENT-HF, une étude multicentrique, multinationale, randomisée, ouverte, en groupes parallèles, avec évaluation en aveugle des critères d’évaluation du traitement médical standard pour l’HFrEF seul par rapport à l’ajout de l’ASV chez les patients atteints d’HFrEF et de troubles respiratoires du sommeil, n’a en revanche démontré aucun effet positif ou négatif du traitement ASV sur le pronostic des patients atteints d’HFrEF (FEVG <45%) et d’apnée obstructive ou centrale du sommeil. [18].
Ne pas limiter les troubles respiratoires du sommeil aux patients HFrEF
Les données actuellement disponibles sur les troubles respiratoires du sommeil en cas d’insuffisance cardiaque se concentrent principalement sur l’HFrEF, tandis que les données sur les troubles respiratoires du sommeil et l’insuffisance cardiaque à fraction d’éjection préservée (HFpEF) sont limitées. Cependant, les troubles respiratoires modérés à sévères liés au sommeil semblent également être une comorbidité fréquente dans l’HFpEF, affectant 37 à 58% des patients. Par exemple, le traitement du SAOS chez les patients atteints de FHPF offre la possibilité d’améliorer la qualité de vie et les performances physiques, et a le potentiel de prévenir la progression de la FHPF en réduisant la pression artérielle et la charge de travail cardiaque, et en empêchant le remodelage cardiaque. En raison de la différence de physiopathologie, de l’impact et des implications pronostiques ainsi que des modalités de traitement, il est donc essentiel de distinguer les patients HF avec SAOS ou ASC prédominants.
L’objectif de l’analyse du registre XT du sommeil était donc d’étudier la prévalence et les prédicteurs des troubles respiratoires du sommeil (à la fois le SAOS et l’ASC) en fonction du sexe chez les patients atteints de HFpEF par rapport à ceux ayant une fonction d’éjection légèrement réduite (HFmrEF) ou HFrEF. Sur les 3289 patients inclus, 2032 avaient une HFpEF, 559 une HFmrEF et 698 une HFrEF. La prévalence des troubles respiratoires du sommeil était élevée chez les HFpEF, mais nettement inférieure à celle des HFmrEF ou des HFrEF (36% contre 41 et 48% respectivement). Les taux de troubles respiratoires liés au sommeil chez les hommes et les femmes étaient de 41 et 28% pour le HFpEF, de 44 et 30% pour le HFmrEF et de 50 et 40% pour le HFrEF. La proportion d’hommes et de femmes souffrant de troubles respiratoires du sommeil et présentant un SAOS était significativement plus élevée chez les HFpEF que chez les HFrEF. Le sexe masculin, l’âge avancé, l’indice de masse corporelle plus élevé et la classe fonctionnelle III/IV de la New York Heart Association étaient des prédicteurs significatifs de troubles respiratoires du sommeil modérés à sévères chez les patients HFpEF. La prévalence des troubles respiratoires du sommeil chez les HFpEF était donc élevée, mais inférieure à celle des patients atteints de HFmrEF ou de HFrEF. Les troubles respiratoires modérés à sévères liés au sommeil étaient plus fréquents chez les hommes que chez les femmes sur l’ensemble du spectre de l’insuffisance cardiaque. Dans les deux sexes, la proportion de SAOS avec HFpEF était plus élevée que celle avec HFrEF [19].
Les clusters de patients peuvent aider à la prise de décision clinique
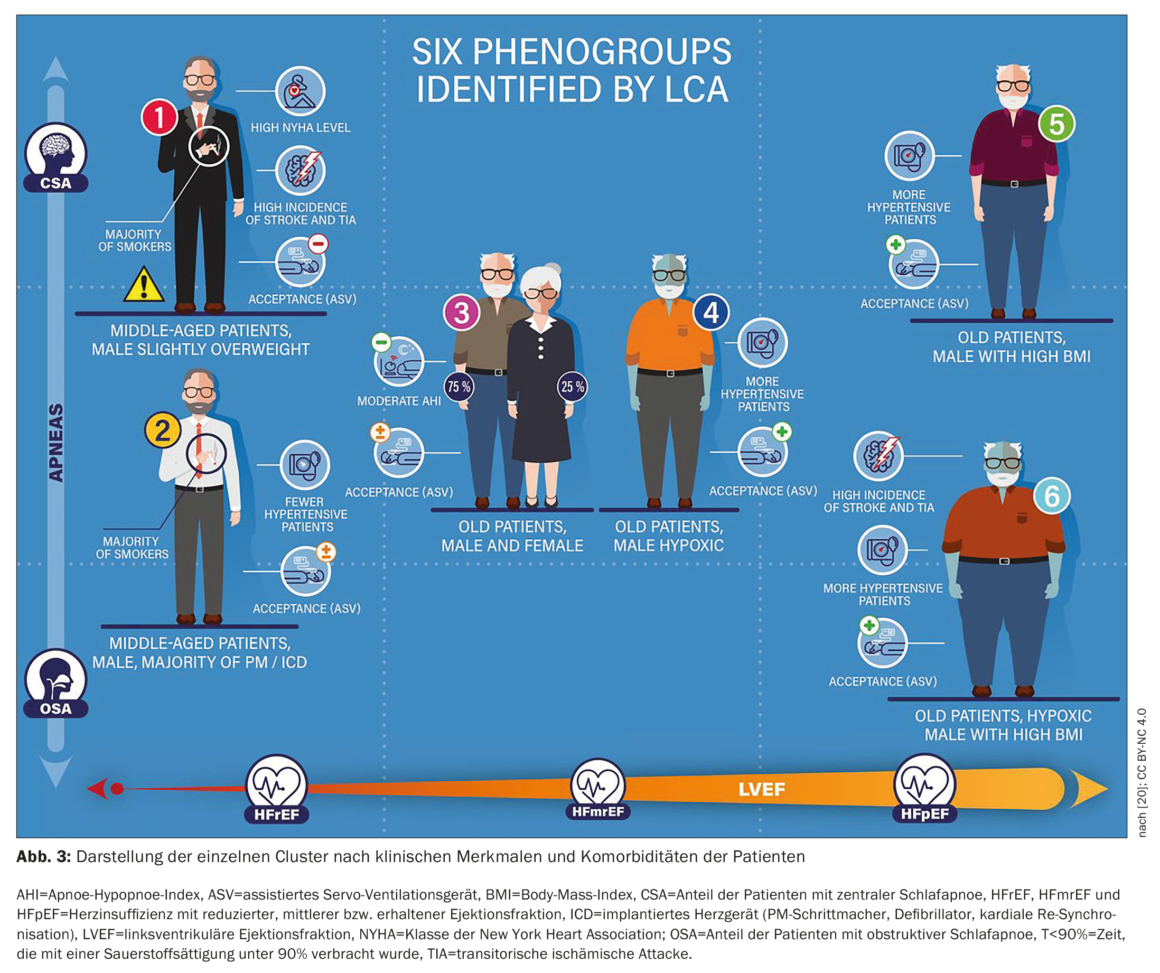
L’étude FACE, une étude de cohorte observationnelle prospective multicentrique européenne, a utilisé des données réelles pour évaluer l’effet du traitement de la PAP par ASV sur la morbidité et la mortalité chez les patients atteints de HFrEF, HFmrEF ou HFpEF et de troubles respiratoires centraux du sommeil ou de CSA/OSA concomitants. Des données à 3 mois ont été présentées dans des sous-groupes de patients définis à l’aide de l’analyse de la classe latente (ACL). L’ACL a identifié pour la première fois six groupes discrets de patients qui constituent des sous-groupes cliniquement pertinents dans le contexte de la gestion de la PDS chez les patients souffrant d’insuffisance cardiaque avec une utilisation différente de l’ASV et un pronostic différent. Le taux à 3 mois des critères d’évaluation primaires était significativement plus élevé chez les patients du cluster 1 (principalement des hommes, FEVG basse, FC sévère, CSA ; 13,9% contre 1,5-5% dans les autres clusters, p<0,01). Cela peut améliorer le phénotypage des patients dans la pratique clinique et permettre d’individualiser le traitement.
La figure 3 [20] montre la représentation clinique de chaque cluster. Les principaux paramètres qui différenciaient les clusters étaient l’IAH obstructif, l’IAH central, la FEVG (%), la classe I/II de la NYHA, le T90 et la présence de HFrEF. Comme prévu, il y avait des différences significatives entre les clusters en termes de démographie des patients, de caractéristiques de la maladie HF et de caractéristiques de la PDS, directement issues de la méthodologie ACL. Il est intéressant de noter que l’adhésion à l’ASV et le refus de l’ASV différaient significativement entre les clusters, bien que ces variables n’aient pas été incluses dans le modèle d’ACV. Le taux à 3 mois des critères d’évaluation primaires était significativement plus élevé chez les patients du cluster 1 (principalement des hommes, FEVG basse, FC sévère, CSA ; 13,9% contre 1,5-5% dans les autres clusters, p<0,01). Ce cluster correspondait à ceux qui, dans la population inscrite à SERVE-HF, ont un mauvais pronostic sous traitement ASV [20].
Congrès : 89e réunion annuelle de la DGK
Littérature :
- Börgel J: Neues vom unheilvollen Duo Nr. 1: Arterielle Hypertonie und Schlafapnoe. 89. Jahrestagung der DGK, 12.04.2023, Sitzung: Kardiovaskuläre Erkrankungen und schlafbezogene Atmungsstörungen im digitalen Zeitalter.
- Becker HF, et al.: Effect of Nasal Continuous Positive Airway Pressure Treatment on Blood Pressure in Patients With Obstructive Sleep Apnea. Circulation 2002; https://doi.org/10.1161/01.CIR.0000042706.47107.7A.
- Fava C, et al.: Effect of CPAP on Blood Pressure in Patients With OSA/Hypopnea: A Systematic Review and Meta-analysis. ScienceDirect 2014; https://doi.org/10.1378/chest.13-1115.
- Liping L, et al.: Continuous Positive Airway Pressure in Patients With Obstructive Sleep Apnea and Resistant Hypertension: A Meta-Analysis of Randomized Controlled Trials. J Clin Hypertens (Greenwich) 2016 Feb; doi: 10.1111/jch.12639.
- Azarbarzin A, et al.: The hypoxic burden of sleep apnoea predicts cardiovascular disease-related mortality: the Osteoporotic Fractures in Men Study and the Sleep Heart Health Study. Eur Heart J. 2019; doi: 10.1093/eurheartj/ehy624.
- Mehra R, Azarbarzin A: Sleep Apnea–Specific Hypoxic Burden and Not the Sleepy Phenotype as a Novel Measure of Cardiovascular and Mortality Risk in a Clinical Cohort. Am J Respir Crit Care Med 2022; doi: 10.1164/rccm.202110-2371ED.
- Sapiña-Beltrán E, et al.: Differential blood pressure response to continuous positive airway pressure treatment according to the circadian pattern in hypertensive patients with obstructive sleep apnoea. European Respiratory Journal 2019;
doi: 10.1183/13993003.00098-2019. - Sinha AM: Neues vom unheilvollen Duo Nr. 2: Vorhofflimmern und Schlafapnoe. 89. Jahrestagung der DGK, 12.04.2023, Sitzung: Kardiovaskuläre Erkrankungen und schlafbezogene Atmungsstörungen im digitalen Zeitalter.
- Iwasaki Y: Mechanism and management of atrial fibrillation in the patients with obstructive sleep apnea. Journal of Arrhythmia 2022;
https://doi.org/10.1002/joa3.12784. - Chen YL, et al.: GJA1 Expression and Left Atrial Remodeling in the Incidence of Atrial Fibrillation in Patients with Obstructive Sleep Apnea Syndrome. Biomedicines 2021; doi: 10.3390/biomedicines9101463.
- Shapira-Daniels A, et al.: Prevalence of Undiagnosed Sleep Apnea in Patients With Atrial Fibrillation and its Impact on Therapy. JACC Clin Electrophysiol 2020; doi: 10.1016/j.jacep.2020.05.030
- Nelliah CJ, et al.: Impact of CPAP on the Atrial Fibrillation Substrate in Obstructive Sleep Apnea: The SLEEP-AF Study. JACC Clin Electrophysiol 2022; doi: 10.1016/j.jacep.2022.04.015.
- Boriani G, et al.: Association between implantable defibrillator-detected sleep apnea and atrial fibrillation: The DASAP-HF study. J Cardiovasc Electrophysiol 2022; doi: 10.1111/jce.15506.
- Arzt M: Neues vom unheilvollen Duo Nr. 3: Herzinsuffizienz und Schlafapnoe. 89. Jahrestagung der DGK, 12.04.2023, Sitzung: Kardiovaskuläre Erkrankungen und schlafbezogene Atmungsstörungen im digitalen Zeitalter.
- Bradley TD, et al.: Continuous positive airway pressure for central sleep apnea and heart failure. N Engl J Med 2005; doi: 10.1056/NEJMoa051001.
- Cowie MR, et al.: Adaptive Servo-Ventilation for Central Sleep Apnea in Systolic Heart Failure. N Engl J Med 2015; doi: 10.1056/NEJMoa1506459.
- Fisser C, et al.: Effects of Adaptive Servo-Ventilation on Nocturnal Ventricular Arrhythmia in Heart Failure Patients With Reduced Ejection Fraction and Central Sleep Apnea-An Analysis From the SERVE-HF Major Substudy. Front Cardiovasc Med 2022; doi: 10.3389/fcvm.2022.896917.
- Lyons OD, et al.: Design of the effect of adaptive servo-ventilation on survival and cardiovascular hospital admissions in patients with heart failure and sleep apnoea: the ADVENT-HF trial. Eur J Heart Fail 2017; doi: 10.1002/ejhf.790; Bradley D, et al.: ESC Congress 2022.
- Arzt M, et al.: Prevalence and predictors of sleep-disordered breathing in chronic heart failure: the SchlaHF-XT registry. ESC Heart Fail 2022;
doi: 10.1002/ehf2.14027. - Tamisier R, et al.: Adaptive servo ventilation for sleep apnoea in heart failure: the FACE study 3-month data. Thorax 2022; doi: 10.1136/thoraxjnl-2021-217205.
CARDIOVASC 2023; 22(2): 42–47