L’anticorps monoclonal anti-IL-17A ixekizumab est déjà autorisé depuis 2016 pour le traitement du psoriasis en plaques modéré à sévère et de l’arthrite psoriasique. En 2020, la spondyloarthrite axiale (axSpA) a été ajoutée à la liste des indications pour lesquelles l’ixekizumab constitue une option thérapeutique. Sur la base du programme d’études COAST, l’efficacité et la tolérance de l’ixekizumab ont été démontrées dans l’axSpA non radiographique ainsi que dans l’axSpA radiographique chez des patients avec ou sans traitement préalable par des inhibiteurs du TNF-α.
L’anticorps monoclonal anti-IL-17A ixekizumab est déjà autorisé depuis 2016 pour le traitement du psoriasis en plaques modéré à sévère et de l’arthrite psoriasique. En 2020, la spondyloarthrite axiale (axSpA) a été ajoutée à la liste des indications pour lesquelles l’ixekizumab constitue une option thérapeutique. Sur la base du programme d’études COAST, l’efficacité et la tolérance de l’ixekizumab ont été démontrées dans l’axSpA non radiographique ainsi que dans l’axSpA radiographique chez des patients avec ou sans traitement préalable par des inhibiteurs du TNF-α [1–4].
Arthrite psoriasique
Les stratégies thérapeutiques approuvées pour l’arthrite psoriasique (PsA) comprennent l’utilisation d’AINS, de csDMARD, de produits biologiques (inhibiteurs du TNF, inhibiteurs de l’IL-12/23 et de l’IL-17, modulateurs des cellules T) et de tsDMARD (inhibiteurs de la PDE4, inhibiteurs des JAK). Les substances actives à utiliser chez tel ou tel patient sont déterminées individuellement en fonction du schéma de manifestation et d’autres facteurs (par exemple, les comorbidités, les facteurs sociaux, le mode d’application et les maladies associées).
L’American College of Rheumatology (ACR), la European League Against Rheumatism (EULAR) et le Group for Research and Assessment of Psoriasis and Psoriatic Arthritis (GRAPPA) sont trois institutions internationales qui proposent des recommandations thérapeutiques permettant d’orienter la prescription [5]. La stratégie de première ligne recommandée dans le traitement de la PsA reste ici l’utilisation d’anti-inflammatoires non stéroïdiens (AINS), qui peuvent être utilisés dès le début des symptômes, mais aussi avant la confirmation du diagnostic. Dans le cadre des soins quotidiens, il convient de tenir compte des risques gastro-intestinaux, cardiovasculaires et rénaux spécifiques à chaque substance. En revanche, les glucocorticoïdes systémiques (GC) ne jouent qu’un rôle mineur dans la PsA. Cependant, l’injection intra-articulaire peut être envisagée pour le traitement d’un schéma d’atteinte mono- ou oligoarticulaire ou en complément d’un traitement existant par des thérapies antirhumatismales modificatrices de la maladie (DMARD). Les DMARD sont utilisés une fois le diagnostic établi et en cas de persistance des symptômes.
Amélioration significative après seulement 6 semaines
L’ixekizumab est indiqué dans le traitement de la PsA chez les adultes qui ont présenté une réponse insuffisante ou une intolérance à un ou plusieurs antirhumatismaux modificateurs de la maladie (DMARD), seuls ou en association avec le méthotrexate. En l’occurrence, il est possible d’obtenir une amélioration significative des flores cutanées avec une quasi-normalisation de la structure de la peau après seulement 6 semaines de traitement. En outre, une diminution rapide des démangeaisons et une amélioration de la qualité de vie ont été décrites pour la substance active.
Actuellement, une amélioration de la douleur a été rapportée pour l’ixekizumab chez des patients avec ou sans inflammation mesurable dans l’arthrite psoriasique [6]. L’efficacité de l’ixekizumab (IXE) et de l’adalimumab (ADA) chez les patients atteints de PsA a déjà été démontrée en termes de taux de réponse à l’ACR50 et au PASI (Psoriasis Area and Severity Index)-100. [7,8]Dans le cadre de l’étude sur l’efficacité de l’IXE ou de l’ADA en monothérapie sur la réduction de la douleur au-delà de l’inflammation mesurable chez les patients atteints de PsA active et présentant une faible protéine C-réactive (CRP, <5 mg/l) à la ligne de base, le Dr.
L’étude SPIRIT-H2H a porté sur 95 patients atteints de monothérapie. Les caractéristiques de départ étaient similaires entre les deux bras de traitement. Chez les patients présentant une inflammation faible et persistante (mesurée par la CRP), il n’y a pas eu de différence dans l’amélioration des douleurs articulaires entre les patients traités par IXE et ceux traités par ADA. Cependant, chez les patients présentant une inflammation fluctuante, les patients traités par IXE ont montré une amélioration moyenne numériquement plus importante des douleurs articulaires (VAS) par rapport aux patients traités par ADA à la semaine 16 (IXE : -31,64, ADA : -25,33). Celle-ci s’est poursuivie jusqu’à la semaine 52 (IXE : -47,69, ADA : -20,67). Une significativité en faveur de l’IXE a été mesurée aux semaines 32 (p=0,0045) et 52 (p=0,0288). De même, chez les patients présentant une amélioration continue du gonflement des articulations ainsi qu’une amélioration fluctuante (évaluée par SJC), des améliorations moyennes numériquement plus importantes des douleurs articulaires ont été mesurées dans le bras IXE par rapport aux patients traités par ADA à partir de la semaine 4 et 16 respectivement, et maintenues jusqu’à la semaine 52.
Cette analyse suggère des schémas différents d’amélioration de la douleur chez les patients ayant une CRP initiale faible et traités par IXE ou ADA en monothérapie, avec un résultat de réduction de la douleur plus favorable pour les patients traités par IXE. Cela se manifeste même lorsque l’inflammation, mesurée par l’amélioration de la CRP ou de la SJC, fluctue. Cette étude soutient donc l’hypothèse selon laquelle l’IXE améliore les douleurs articulaires chez les patients atteints de PsA avec ou sans inflammation mesurable.
Spondyloarthrite axiale
La spondyloarthrite axiale (axSpA) est une maladie inflammatoire chronique qui se compose d’une axSpA non radiologique et d’une axSpA radiologique (r-axSpA). Cette dernière, également connue sous le nom de spondylarthrite ankylosante (SA), se caractérise par des douleurs dorsales inflammatoires et des signes radiologiques d’atteinte de l’articulation sacro-iliaque [9]. Ces manifestations, ainsi que les signes et symptômes musculo-squelettiques et extra-articulaires périphériques, peuvent contribuer à la réduction de la mobilité, à l’invalidité progressive et à la diminution de la qualité de vie (QdV). Les antirhumatismaux biologiques modificateurs de la maladie (bDMARD), y compris les inhibiteurs du facteur de nécrose tumorale (TNFi) et un antagoniste de l’interleukine (IL)-17A, sont recommandés pour le traitement des patients atteints d’axSpA qui ne répondent pas aux anti-inflammatoires non stéroïdiens (AINS) ou ne les tolèrent pas. Cependant, jusqu’à 40% des patients traités par des inhibiteurs du TNF n’obtiennent pas un contrôle satisfaisant de leur maladie [10], et chez certains patients, le traitement par TNFi peut être contre-indiqué.
La voie de signalisation de l’IL-17 joue un rôle clé dans la pathogenèse de l’axSpA. Deux études cliniques randomisées et contrôlées de phase 3 (COAST-V et COAST-W) ont évalué l’efficacité et la sécurité de l’ixekizumab en tant qu’anticorps monoclonal de haute affinité ciblant sélectivement l’IL-17A, sur une période allant jusqu’à 52 semaines, chez des patients atteints de spondyloarthrite axiale radiologique active (r-axSpA). Les participants à COAST-V étaient naïfs de bDMARD, ceux de COAST-W étaient expérimentés avec les inhibiteurs du TNF.
Dans COAST-V, 341 patients atteints de r-axSpA active ont été randomisés pour recevoir 80 mg d’ixekizumab (IXE) toutes les 2 ou 4 semaines, un placebo ou 40 mg d’adalimumab (ADA) toutes les deux semaines. Dans COAST-W, 316 patients ont reçu de l’ixekizumab 1:1:1 toutes les 2 ou 4 semaines ou un placebo. A la semaine 16, les patients recevant l’ixekizumab ont poursuivi leur traitement attribué, les patients sous placebo ou ADA ont été transférés 1:1 vers IXE Q2W ou IXE Q4W jusqu’à la semaine 52.
Bonne efficacité et sécurité
Il est apparu que les deux traitements par ixekizumab amélioraient l’activité de la maladie, la fonction physique, les marqueurs objectifs de l’inflammation, la qualité de vie, l’état de santé et la fonction globale sur une période allant jusqu’à 52 semaines.
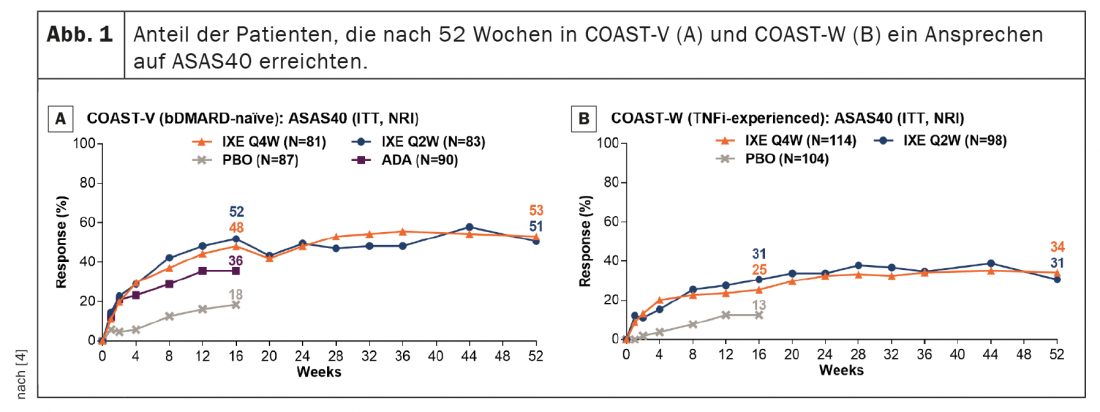
Chez les patients traités en continu par ixekizumab, les taux de réponse ASAS40 se sont maintenus de la semaine 16 à la semaine 52 (Fig. 1). Les taux de réponse à l’ASAS40 à la semaine 52 étaient de 53,1% (IXE Q4W) et 50,6% (IXE Q2W) dans COAST-V et de 34,2% (IXE Q4W) et 30,6% (IXE Q2W) dans COAST-W. Les taux de réponse à l’ASAS40 à la semaine 52 ont été respectivement de 53,1% (IXE Q4W) et 50,6% (IXE Q2W). Les patients randomisés pour recevoir un placebo et re-randomisés pour recevoir l’ixekizumab à la semaine 16 ont montré une amélioration rapide des taux de réponse ASAS40 après le passage à l’ixekizumab. (Fig. 2) ; Les taux de réponse à la semaine 52 (46,5% dans COAST-V, 38,7% dans COAST-W) étaient numériquement similaires à ceux des patients initialement randomisés pour recevoir l’ixekizumab. Dans COAST-V, les patients randomisés vers ADA ont montré de nouvelles améliorations numériques des taux de réponse ASAS40 (36,0% à la semaine 16, 51,2% à la semaine 52) après le passage à l’ixekizumab (Fig. 2A) ; les taux de réponse à la semaine 52 étaient numériquement similaires à ceux des patients initialement randomisés vers l’ixekizumab.
Le RIAE groupé pour le psoriasis était de 1,0. Un patient a présenté un événement indésirable cérébrocardiovasculaire grave (infarctus aigu du myocarde) et deux affections malignes ont été signalées (leucémie promyélocytaire aiguë et cancer de la vessie). Moins de réactions au site d’injection (ISR) ont été signalées avec IXE Q4W (9,2%) qu’avec IXE Q2W (17,2%). Le nombre de patients ayant signalé une ISR a diminué au fil du temps. Plus précisément, 6,4%, 3,8% et 3,4% des patients sous IXE Q4W et 14,3%, 8,6% et 5,2% des patients sous IXE Q2W ont rapporté une ISR aux semaines 0-12, semaines 12-24 et semaines 24-36, respectivement. Seuls quelques patients (IXE Q4W ≤1%; IXE Q2W environ 3%) ont signalé une ISR au-delà de la semaine 36.
En général, les réactions au traitement ont été moins nombreuses chez les patients expérimentés en matière de TNFi par rapport aux patients naïfs de bDMARD, ce qui s’explique par une population plus difficile à traiter, avec des échecs de traitement antérieurs et une maladie de longue durée [4]. Les traitements biologiques actuellement autorisés pour l’axSpA comprennent plusieurs anti-TNF et un antagoniste de l’IL-17A. Bien que seules les études comparatives directes puissent évaluer pleinement l’efficacité et la sécurité relatives des différents traitements, les résultats de l’ASAS40 rapportés ici à la semaine 52 sont cohérents avec ceux rapportés pour le TNFi chez les patients naïfs de BDMARD et pour le sécukinumab dans des sous-groupes de patients naïfs de BDMARD ou chez lesquels un traitement par TNFi avait précédemment échoué.
Le taux d’abandon en raison d’événements indésirables (EI) était <4% dans les deux études, et les événements indésirables graves (EIG) ont été rapportés par <6% des patients. La plupart des infections et des ISR étaient légères à modérées. Les ISR étaient plus fréquents chez IXE Q2W que chez IXE Q4W. En outre, les ISR ont été rapportés le plus souvent au cours des 4 premières semaines de traitement et leur fréquence a diminué au fil du temps. Au cours des périodes d’étude de 52 semaines de COAST-V et COAST-W (n=641), le taux d’incidence poolé ajusté à l’exposition pour 100 patients-années (EAIR) des infections graves était de 2,0 chez les patients traités par ixekizumab. Les EAIRs groupés de l’infection à Candida et de la neutropénie de grade 3/4 étaient respectivement de 1,0 et 0,2. Les EAIR correspondants pour la maladie de Crohn, la colite ulcéreuse et les maladies inflammatoires de l’intestin (MII) étaient respectivement de 0,8, 0,4 et 0,4 (EAIR total MII : 1,6). L’EAIR pour l’uvéite antérieure (UA) était de 3,9 ; 15 patients sur 20 (75%) avaient des antécédents d’UA et 14 patients sur 20 (70%) étaient issus de COAST-W. Les résultats de l’EAIR pour l’uvéite antérieure étaient de 3,9. Moins d’événements de DEC ont été rapportés avec IXE Q2W qu’avec IXE Q4W, et il n’y avait pas de lien apparent entre la durée d’exposition à l’ixekizumab et le DEC. Des rapports antérieurs ont montré que la RIEA pour l’UA chez les patients atteints de spondylarthrite ankylosante (SA) se situe dans une fourchette de 2,6 à 3,5 pour les patients traités par TNFi [11].
En résumé, les données de COAST-V et COAST-W montrent que l’ixekizumab a permis une amélioration soutenue et cliniquement significative des signes et symptômes du r-axSpA actif pendant une période allant jusqu’à 52 semaines. Les résultats en matière de sécurité étaient conformes au profil de sécurité connu de l’ixekizumab. Ces résultats suggèrent que l’ixekizumab pourrait être une option de traitement de l’axSpA chez les patients naïfs de bDMARD ou qui ont précédemment présenté une réponse insuffisante ou une intolérance aux inhibiteurs du TNF.
Étude sur les effets après rémission
Les résultats d’études randomisées sur l’arrêt des inhibiteurs du facteur de nécrose tumorale (TNF) chez les patients atteints de spondyloarthrite axiale suggèrent que l’arrêt du TNFi entraîne une poussée chez la plupart des patients et qu’un traitement continu peut être important pour le maintien du contrôle de la maladie. Cependant, aucune étude n’a encore été menée pour se concentrer sur les effets de la poursuite par rapport à l’arrêt d’un antagoniste de l’interleukine (IL) 17A chez les patients atteints d’axSpA. COAST-Y est une étude de suivi de COAST-V et COAST-W. Elle a pour but d’évaluer l’impact de l’utilisation de l’alcool sur la santé. L’objectif de cette étude [12], publiée en 2021, était de combler cette lacune et d’évaluer la poursuite vs. l’arrêt d’un traitement par ixekizumab chez des patients atteints de spondyloarthrite axiale ayant atteint la rémission.
Dans l’étude de prolongation de phase 3, randomisée, en double aveugle et contrôlée par placebo, les patients qui avaient terminé les études initiales COAST-V, COAST-W ou COAST-X de 52 semaines sont entrés dans une phase d’introduction de 24 semaines et ont continué à prendre 80 mg d’IXE toutes les 2 (Q2W) ou 4 semaines (Q4W). Les patients qui ont atteint la rémission (c’est-à-dire un score d’activité de la spondylarthrite ankylosante (ASDAS) <1,3 au moins une fois à la semaine 16 ou à la semaine 20 et <2,1 aux deux visites) ont été répartis de manière égale et aléatoire à la semaine 24 pour continuer IXE Q4W, IXE Q2W ou arrêter le traitement en aveugle par placebo. Le critère d’évaluation principal était la proportion de patients sans poussée (ASDAS ≥2,1 lors de deux visites consécutives ou ASDAS >3,5 lors de chaque visite) après la période de 40 semaines de RWRP (randomised withdrawal-reatment period), le délai avant la poussée étant un critère d’évaluation secondaire important.
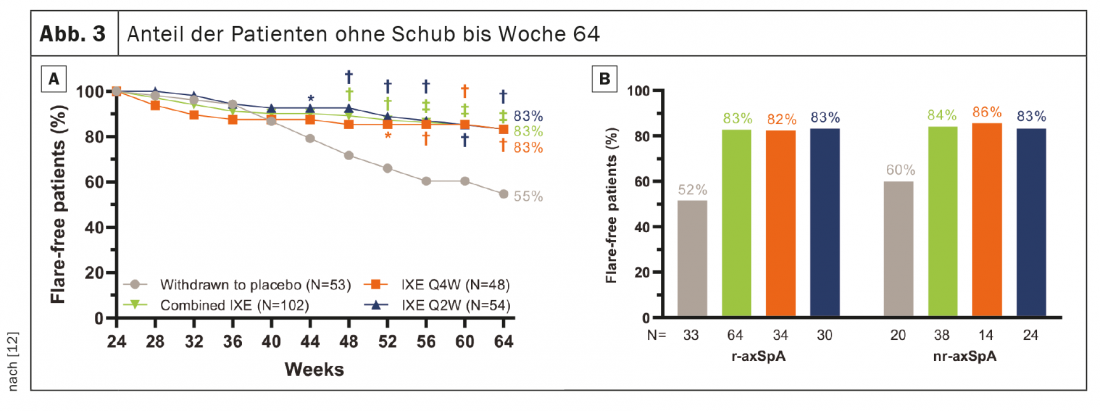
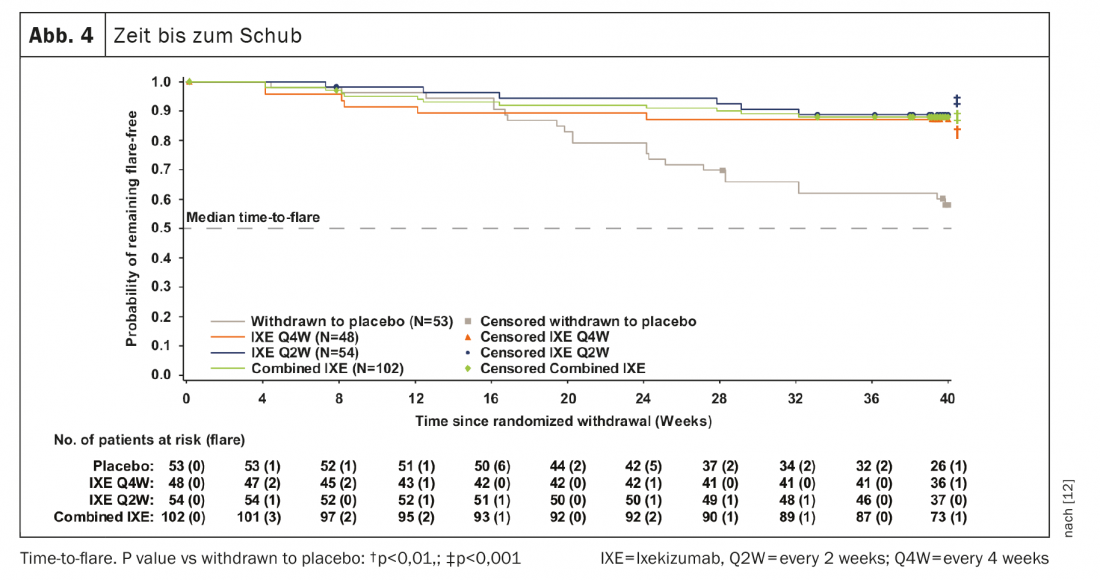
741 patients ont terminé la phase d’introduction de 24 semaines et 155 sont entrés dans le RWRP. L’objectif principal et tous les principaux objectifs secondaires ont été atteints à la semaine 64. Quarante semaines après le sevrage randomisé, 83,3% des patients restaient dans les groupes combinés IXE (85/102, p<0,001), IXE Q4W (40/48, p=0,003) et IXE Q2W (45/54, p=0,001) sans rechute versus 54,7% dans le groupe placebo (29/53) (Fig. 3A). Le pourcentage de patients sans poussée était similaire entre les sous-groupes de patients avec r-axSpA et nr-axSpA (Fig. 3B). La poursuite de l’IXE a significativement retardé le délai avant la poussée par rapport au placebo, la plupart des patients restant jusqu’à 20 semaines sans poussée après l’arrêt de l’IXE. (Fig. 4). Le fait que 54,7% des patients ayant arrêté le placebo n’aient pas eu de poussées pendant le RWRP était plus élevé que dans les études comparables sur l’arrêt de l’adalimumab (47%) et du certolizumab pegol (20,2%). [13–16].
Prédicteurs et sécurité
Des analyses post-hoc ont identifié plusieurs caractéristiques des patients associées à une poussée, y compris l’aire ASDAS sous la courbe, ce qui suggère que les patients dont la maladie était moins bien contrôlée au fil du temps étaient plus susceptibles d’avoir une poussée que ceux dont le contrôle de la maladie était stable. En outre, l’arrêt de l’IXE, un taux initial de CRP plus élevé et un IMC non normal (qui était dans la plupart des cas ≥25kg/m2) ont été identifiés comme étant associés à une poussée. Un score de douleur BASDAI plus élevé à la semaine 24 était également associé à une poussée chez les patients qui ont poursuivi le traitement par IXE, mais pas chez ceux qui avaient arrêté le placebo.
La RWRP de COAST-Y comprenait des patients appartenant à l’ensemble du spectre axSpA, avec ou sans échec préalable du TNFi, et dont la durée des symptômes allait de 1,9 à 44,7 ans (moyenne de 12,7 ans) [17]. Il n’y a eu aucun problème de sécurité nouveau ou inattendu pendant le RWRP. Des événements indésirables liés au traitement (TEAE), généralement d’intensité légère à modérée, ont été rapportés chez 42,6% (IXE Q4W), 44,4% (IXE Q2W) et 52,8% (arrêt du placebo) des patients. Deux patients (IXE Q2W) ont abandonné l’étude en raison d’UE. Des EIAS ont été observés chez deux (4,3%) patients du groupe IXE Q4W (atomes bénins des cellules germinales ovariennes et fracture par compression), deux (3,7%) patients du groupe IXE Q2W (amygdalite chronique et myélopathie chez un patient et colite à Clostridium difficile chez un autre) et un (1,9%) patient qui avait arrêté le placebo (inflammation des tissus mous). Seul un SUE (colite difficile) a entraîné l’arrêt du traitement. Aucun décès n’a été enregistré et aucun cas de réactivation de la tuberculose, de maladie inflammatoire de l’intestin, d’événement cardiovasculaire indésirable grave (MACE) ou de malignité n’a été signalé.
Dans l’ensemble, ces résultats suggèrent que le traitement continu de l’IXE est important pour la plupart des patients afin de maintenir le contrôle à long terme de la maladie [12]. Cependant, la longue durée de la réponse au traitement après l’arrêt de l’IXE suggère qu’une interruption temporaire du traitement, par exemple pendant une infection ou avant une intervention chirurgicale, n’entraînera probablement pas de poussée chez la plupart des patients. Ces résultats sont importants pour les cliniciens qui souhaitent prendre des décisions de traitement concernant l’interruption du traitement et optimiser la gestion à long terme de l’axSpA.

Messages Take-Home
- L’ixekizumab est autorisé dans le traitement du psoriasis en plaques modéré à sévère, de l’arthrite psoriasique et de la spondyloarthrite axiale.
- Dans le cas du PsA, l’ixekizumab peut entraîner une amélioration significative de la flore cutanée après seulement 6 semaines de traitement. De plus, une amélioration de la douleur a été actuellement rapportée chez les patients avec et sans inflammation mesurable.
- L’ixekizumab constitue un traitement efficace chez les patients atteints de r-axSpA actif qui sont naïfs de bDMARD ou qui ont été exposés au TNFi.
- L’ixekizumab peut améliorer l’activité de la maladie, la fonction physique, les marqueurs objectifs de l’inflammation, la qualité de vie, l’état de santé et la fonction globale chez les patients atteints de r-axSpA sur une période allant jusqu’à 52 semaines.
- Chez les patients en rémission d’une axSpA, un traitement continu par IXE est associé à une probabilité plus élevée de maintenir un contrôle optimal de la maladie par rapport à un sevrage de l’IXE.
Littérature :
- Deodhar A, et al : Ixekizumab pour les patients atteints de spondyloarthrite axiale non radiographique (COAST-X) : un essai randomisé et contrôlé par placebo. Lancet 2020 Jan 4 ; 395 (10217) : 53-64.
- van der Heijde D, et al : Ixekizumab, an interleukin-17A antagonist in the treatment of ankylosing spondylitis or radiographic axial spondyloarthritis in patients previously untreated with biological disease-modifying anti-rheumatic drugs (COAST-V) : 16 week results of a phase 3 randomised, double-blind, active controlled and placebo-controlled trial. Lancet 2018 Dec 8 ; 392 (10163) : 2441-2451.
- Deodhar A, et al : Efficacité et sécurité de l’ixekizumab dans le traitement de la spondyloarthrite axiale radiographique : Résultats à seize semaines d’un essai de phase III randomisé, en double aveugle, contrôlé par placebo chez des patients ayant antérieurement présenté une réponse inadéquate ou une intolérance aux inhibiteurs du facteur de nécrose tumorale. Arthritis Rheumatol 2019 ; 71 (4) : 599-611.
- Dougados M, Wei JCC, Landewé R, et al : Efficacité et sécurité de l’ixekizumab pendant 52 semaines dans deux essais cliniques de phase 3, randomisés et contrôlés chez des patients atteints de spondyloarthrite axiale radiographique active (COAST-V et COAST-W). Ann Rheum Dis 2020 ; 79 : 176-185 ; doi : 10.1136/annrheumdis-2019-216118.
- Köhm M, Burkhardt H, Behrens F : Stratégies thérapeutiques de l’arthrite psoriasique. DMW – Deutsche Medizinische Wochenschrift 2020 ; 145(11) : 773-780 ; doi : 10.1055/a-0964-0231.
- de Vlam K, Gallo G, Mease P, et al : Ixekizumab Shows a Pattern of Pain Improvement in Patients with and Without Measurable Inflammation in Psoriatic Arthritis. Arthritis Rheumatol 2021 ; 73 (suppl 10).
- Mease PJ, Smolen JS, Behrens F, The SPIRIT H2H study group et al : A head-to-head comparison of the efficacy and safety of ixekizumab and adalimumab in biological-naïve patients with active psoriatic arthritis : 24-week results of a randomised, open-label, blind-assessor trial. Ann Rheum Dis 2020 ; 79 : 123-131 ; doi : 10.1136/annrheumdis-2019-215386.
- Smolen JS, Sebba A, Ruderman EM, et al : Efficacité et sécurité de l’ixekizumab avec ou sans méthotrexate chez les patients naïfs biologiques atteints d’arthrite psoriasique : 52-week results from SPIRIT-H2H Study. Rheumatol Ther 2020 ; 7 : 1021-1035 ; doi : 10.1007/s40744-020-00250-3.
- Sieper J, Poddubnyy D : Spondyloarthrite axiale. Lancet 2017 ; 390 : 73-84 ; doi : 10.1016/S0140-6736(16)31591-4.
- Sepriano A, Regel A, van der Heijde D, et al : Efficacité et sécurité des DMARDs biologiques et ciblés-synthétiques : une revue systématique de la littérature informant la mise à jour 2016 des recommandations ASAS/EULAR pour la prise en charge de la spondyloarthrite axiale. RMD Open 2017 ; 3 : e000396 ; doi : 10.1136/rmdopen-2016-000396.
- Deodhar A, Miceli-Richard C, Baraliakos X, et al : Low incidence of both new-onset and flares of uveitis in secukinumab-treated patients with ankylosing spondylitis : clinical trial and post-marketing safety analysis. Ann Rheum Dis 2018 ; 77(Suppl 2) : 999 ; doi : 10.1136/annrheumdis-2018-eular.4474.
- Landewé RBM, Gensler LS, Poddubnyy D, et al. : Continuing versus withdrawing ixekizumab treatment in patients with axial spondyloarthritis who achieved remission : efficacy and safety results from a placebo-controlled, randomised withdrawal study (COAST-Y). Ann Rheum Dis 2021 ; 80 : 1022-1030 ; doi : 10.1136/annrheumdis-2020-219717.
- Landewé RB, van der Heijde D, Dougados M, et al : Maintenance of clinical remission in early axial spondyloarthritis following certolizumab pegol dose reduction. Ann Rheum Dis 2020 ; 79 : 920-928 ; doi : 10.1136/annrheumdis-2019-216839.
- Landewé R, Sieper J, Mease P, et al : Efficacité et sécurité du traitement continu par adalimumab versus le retrait dans le maintien de la rémission chez les patients atteints de spondyloarthrite axiale non radiographique (ABILITY-3) : une étude multicentrique, randomisée, en double aveugle. Lancet 2018 ; 392 : 134-144 ; doi : 10.1016/S0140-6736(18)31362-X.
- Haibel H, Heldmann F, Braun J, et al : Efficacité à long terme de l’adalimumab après retrait du médicament et retraite chez les patients atteints de spondyloarthrite axiale active non radiographiquement évidente et qui connaissent un flare. Arthritis Rheum 2013 ; 65 : 2211-2213 ; doi : 10.1002/art.38014.
- Song IH, Althoff CE, Haibel H, et al : Fréquence et durée de la rémission sans médicament après 1 an de traitement par étanercept versus sulfasalazine dans la spondyloarthrite axiale précoce : 2 ans de données de l’essai ESTHER. Ann Rheum Dis 2012 ; 71 : 1212-1215 ; doi : 10.1136/annrheumdis-2011-201010.
- Smolen JS, Schöls M, Braun J, et al : Traiter la spondyloarthrite axiale et la spondyloarthrite périphérique, en particulier l’arthrite psoriasique, pour atteindre l’objectif : 2017 mise à jour des recommandations par un groupe de travail international. Ann Rheum Dis 2018 ; 77 : 3-17 ; doi : 10.1136/annrheumdis-2017-211734.
InFo DOULEUR & GERIATRIE 2021 ; 3(2) : 14-18