Selon les connaissances actuelles, le reflux gastro-œsophagien et l’œsophagite à éosinophiles sont des entités différentes qui nécessitent des approches thérapeutiques différentes. Ce point est particulièrement souligné dans la mise à jour du guide S2k “Reflux gastro-œsophagien et œsophagite à éosinophiles” publié cette année par la Société allemande de gastro-entérologie, de digestion et de métabolisme.
Le reflux gastro-œsophagien (RGO) et l’œsophagite à éosinophiles (EoE) sont les maladies les plus courantes de l’œsophage et présentent des symptômes qui se chevauchent en partie [1]. Il n’existe pas d’étalon-or diagnostique permettant de prouver ou d’exclure le RGO. En revanche, des critères ont été développés pour limiter la probabilité de diagnostic. Le Consensus de Lyon est une référence en la matière. Il est basé sur des résultats de diagnostic endoscopique et fonctionnel. En particulier chez les patients souffrant de reflux réfractaire, le diagnostic différentiel doit toujours prendre en compte la possibilité d’une EoE, comme le souligne la ligne directrice.
DIRD vs. EoE
Alors que le RGO est une maladie inflammatoire de l’œsophage provoquée par un reflux pathologique du contenu de l’estomac, l’EoE est une maladie chronique de l’œsophage à médiation immunitaire, caractérisée par des symptômes de dysfonctionnement œsophagien et, sur le plan histologique, par une inflammation à éosinophiles prédisposés. Les autres causes systémiques et/ou locales d’éosinophilie œsophagienne doivent être exclues [3]. Si l’EoE n’est pas traitée, elle présente un risque élevé de fibrose œsophagienne, de striction et d’obstruction du bolus [4–6].
Résultats endoscopiques généralement remarquables en cas d’EoE
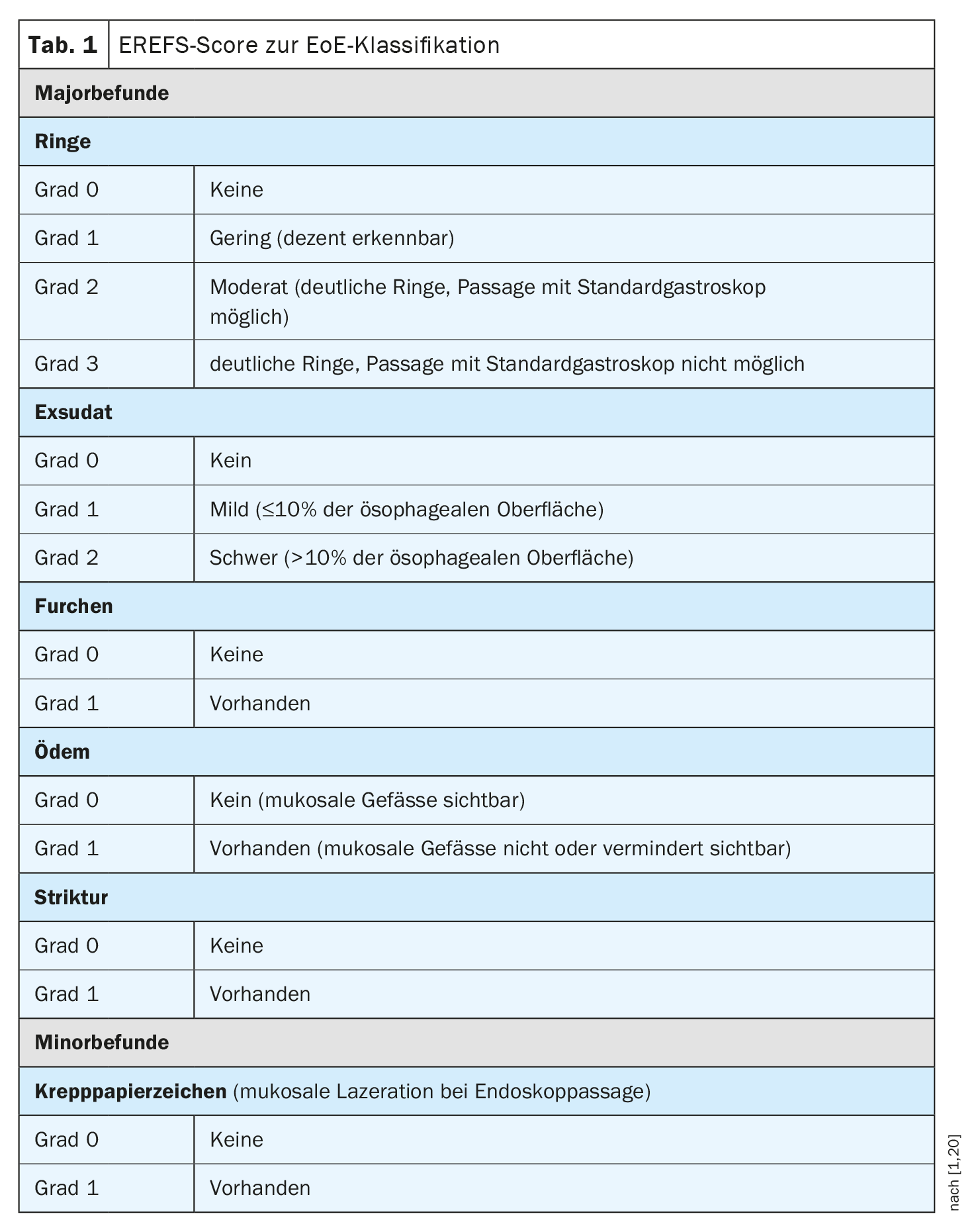
Si les symptômes initialement interprétés comme un RGO ne s’améliorent pas avec un traitement par IPP de 8 semaines, un examen endoscopique est indiqué. Chez les patients atteints de RGO, environ 70% des endoscopies sont normales [2]. En revanche, des anomalies endoscopiques caractéristiques sont détectées chez environ 90% des patients atteints d’EoE. Il s’agit notamment de modifications structurelles visibles de l’œsophage sous la forme d’exsudats blanchâtres, de sillons longitudinaux, d’œdème de la muqueuse, d’anneaux fixés, d’un œsophage de petit calibre et de strictures, ainsi que d’une lacération muqueuse lors du massage endoscopique (signe du papier crêpé). Ces caractéristiques peuvent être présentes seules ou combinées. Pour l’évaluation endoscopique de l’EoE, il convient d’utiliser le score de référence endoscopique (EREFS) (tableau 1) [1]. Il s’agit d’un système de classification qui permet de documenter et de classer systématiquement les caractéristiques histologiques. Il a été démontré que ce système de scoring est corrélé à l’amélioration histologique dans l’EoE [24].
Latence de diagnostic : pronostic défavorable
Une étude rétrospective portant sur 200 patients de la cohorte suisse EoE a montré que plus la latence du diagnostic est importante, plus le taux de strictions œsophagiennes augmente lors de l’endoscopie index [4]. Si le diagnostic a été posé dans les deux ans suivant le début des symptômes, des sténoses œsophagiennes ont été observées dans 47% des cas. Si le diagnostic a été posé plus de 20 ans après le début des symptômes, le taux de striction est passé à 88%. Dans la plus grande étude de cohorte menée à ce jour aux Pays-Bas, portant sur 721 patients (dont 117 enfants), il est apparu que le taux de signes de fibrose endoscopique au moment du diagnostic était significativement plus élevé chez les adultes (76%) que chez les enfants (39%) [5]. Si le délai de diagnostic était de deux ans maximum, le taux de signes de fibrose à l’endoscopie index était de 54%. Les taux de striction et d’obstruction de bolus de haut niveau étaient respectivement de 19% et 24%. En cas de retard de diagnostic de 21 ans ou plus, ces taux sont passés respectivement à 52% et 57%. Sur la base de ces données, un risque de progression de 9% par an a été calculé pour une maladie non traitée [5].
Stratégies thérapeutiques recommandées pour l’EoE
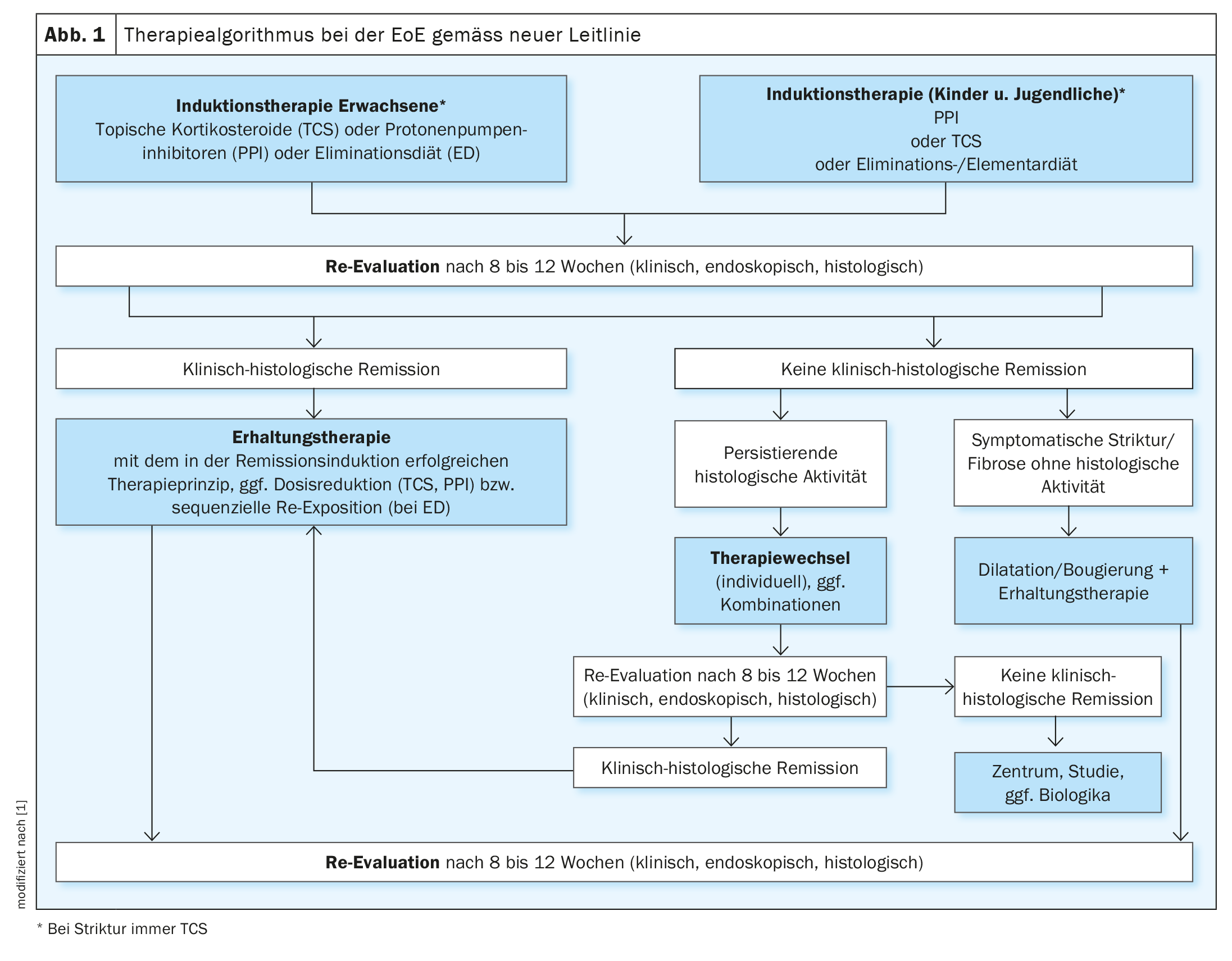
Les directives européennes et américaines actuelles recommandent d’initier un traitement d’induction visant à obtenir une rémission clinico-histologique (figure 1) en cas de détection d’une EoE active [1,3,7]. Chez les adultes, un traitement par corticostéroïdes topiques est recommandé. Les options de traitement alternatives mentionnées sont les IPP à haute dose ou un régime d’élimination des 6 aliments. Le guide de la DGVS présente en détail les preuves actuelles concernant ces options thérapeutiques, en citant notamment les résultats des études suivantes [1] :
- Corticostéroïdes topiques : 11 études en double aveugle contrôlées par placebo ont été menées à ce jour sur le traitement inducteur de rémission de l’EoE par des corticostéroïdes topiques chez les adultes et les enfants, dont sept études sur le budésonide et quatre sur la fluticasone [1]. De plus, il existe cinq études randomisées avec d’autres comparateurs : Fluticasone vs prednisolone, fluticasone vs ésoméprazole, budésonide en suspension vs budésonide en nébulisation, budésonide en suspension vs fluticasone en nébulisation [1]. De plus, 6 méta-analyses sont disponibles [8–13].
- IPP à forte dose : dans une étude observationnelle prospective publiée en 2016, un taux de rémission clinico-histologique de 33% a été rapporté chez 121 patients adultes atteints d’EoE active après 8 semaines de traitement par IPP à forte dose (oméprazole 2×40 mg par jour) [14]. Dans une étude de registre prospective publiée en 2020, l’analyse intérimaire de 630 patients (554 adultes) après un traitement par IPP a révélé un taux de rémission histologique de 48,8% (<15 Eos/hpf) et 37,9% (<5 Eos/hpf) respectivement [15].
- Régime d’élimination : le régime d’élimination des 6 aliments consiste à éliminer les aliments les plus fréquemment associés aux allergies alimentaires, à savoir les protéines du lait de vache, le blé, le soja, les œufs, les noix et les poissons/fruits de mer. Une étude rétrospective chez l’enfant a montré que jusqu’à 74% des patients traités de cette manière présentaient une rémission histologique, mais que lors de la réintroduction des différents aliments par de nouvelles endoscopies, l’aliment en cause n’a pu être identifié que chez quelques patients [16,17].
L’objectif d’un traitement d’induction réussi est à la fois la rémission clinico-histologique et l’amélioration des résultats endoscopiques. Un contrôle approprié doit être effectué après 8 à 12 semaines [1].
- Des questionnaires validés (par ex. ESAI-PRO, DRQ pour les adultes, PEES2 pour les enfants) ou une échelle numérique permettent d’évaluer objectivement les symptômes [21–23].
- Les résultats endoscopiques doivent être enregistrés de manière standardisée à l’aide de la classification EREFS [20].
- Pour le moment, seule l’endoscopie avec biopsie est appropriée pour vérifier la présence d’une rémission histologique, car les symptômes et les résultats endoscopiques ne sont souvent que faiblement corrélés à l’activité inflammatoire [1].
- Il n’existe pas non plus de biomarqueurs non invasifs fiables à ce jour [1].
Après le traitement d’induction ou la rémission : traitement d’entretien
Chez les patients atteints d’EoE, un traitement de maintien de la rémission doit être poursuivi après l’obtention d’une rémission clinique et histologique (figure 1). La ligne directrice recommande de vérifier leur efficacité tous les 1 à 2 ans sur le plan clinique et endoscopique-histologique.
Dans une étude randomisée en double aveugle, contrôlée par placebo, publiée en 2011 et portant sur 28 patients, un traitement de maintien de la rémission par une suspension de budésonide 2× 0,25 mg par jour a entraîné un taux de récidive histologique significativement plus faible après 50 semaines. Le taux de rémission histologique à 50 semaines était de 36% avec le budésonide et de 0% avec le placebo. Le taux de rémission clinique était également plus élevé à 50 semaines par rapport au placebo, mais pas de manière statistiquement significative [18].
Une étude européenne de phase III portant sur 204 patients adultes atteints d’EoE en rémission clinique et histologique a montré l’efficacité et l’innocuité du budésonide orodispersible en maintien de la rémission [19]. Dans cette étude randomisée en double aveugle, le critère d’évaluation principal de rémission clinico-histologique a été atteint chez 73,5% et 75% des patients respectivement après 48 semaines de traitement par le budésonide orodispersible en comprimés à la dose quotidienne de 2× 0,5 mg ou 2× 1 mg (p<0,0001 vs placebo : 4,4%).
La ligne directrice mentionne qu’il n’existe à ce jour aucun ECR sur le traitement à long terme de l’EoE par IPP et que les données sur les effets à long terme d’un régime d’élimination sont rares.
Littérature :
- S2k-Leitlinie Gastroösophageale Refluxkrankheit und eosinophile Ösophagitis der Deutschen Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten (DGVS) – mars 2023 – AWMF-Registerummer : 021-013. Z Gastroenterol 2023 ; 61(7) : 862-933.
- Gerson LB : Diagnostic Yield of Upper Endoscopy in Treated GERD Patients. Gastroenterology 2010 ; 139 : 1408-1409.
- Lucendo AJ, et al : Guidelines on eosinophilic esophagitis : evidence-based statements and recommendations for diagnosis and management in children and adults. United European Gastroenterology Journal 2017 ; 5 : 335-358.
- Schoepfer AM, et al. Le retard dans le diagnostic de l’œsophagite à éosinophiles augmente le risque de formation de stries de manière temporellement dépendante. Gastroenterology 2013 ; 145 : 1230-1236.e1-2.
- Warners MJ, et al : The natural course of eosinophilic esophagitis and long-term consequences of uniagnosed disease in a large cohort. Am J Gastroenterol 2018 ; 113 : 836-844.
- Shaheen NJ, et al : Natural history of eosinophilic esophagitis : a systematic review of epidemiology and disease course. Dis Esophagus 2018 ; 31(8) : doy015. doi : 10.1093/dote/doy015.
- Hirano I, et al : AGA Institute et le Joint Task Force on Allergy-Immunology Practice Parameters Clinical Guidelines for the Management of Eosinophilic Esophagitis. Gastroenterology 2020 ; 158 : 1776-1786.
- Chuang M-y, et al : Topical SteroidTherapy for the Treatment of Eosinophilic Esophagitis (EoE) : A Systematic Review and Meta-Analysis. Clinical and Translational Gastroenterology 2015 ; 6 : e82.
- Tan ND, Xiao YL, Chen MH : Traitement par stéroïdes pour l’œsophagite à éosinophiles : revue systématique et méta-analyse. J of Digestive Diseases 2015 ; 16 : 431-442.
- Lipka S, et al : Systematic review with network meta-analysis : comparative effectiveness of topical steroids vs PPIs for the treatment of the spectrum of eosinophilic oesophagitis. Alimentary Pharmacology & Therapeutics 2016 ; 43 : 663-673.
- Murali AR, et al. : Topical steroids in eosinophilic esophagitis : Systematic review and meta-analysis of placebo-controlled randomized clinical trials. Journal of Gastroenterology and Hepatology 2016 ; 31 : 1111-1119.
- Rokkas T, Niv Y, Malfertheiner P : A Network Meta-Analysis of Randomized Controlled Trials on the Treatment of Eosinophilic Esophagitis in Adults and Children. Journal of Clinical Gastroenterology 2020 ; 55 : 400-410.
- de Heer J, et al : Histologic and Clinical Effects of Different Topical Corticosteroids for Eosinophilic Esophagitis : Lessons from an Updated Meta-Analysis of Placebo-Controlled Randomized Trials. Digestion 2020 ; 102 : 377-385.
- Gómez-Torrijos E, et al : The efficacy of step-down therapy in adult patients with proton pump inhibitor-responsive oesophageal eosinophilia. Alimentary Pharmacology and Therapeutics 2016 ; 43 : 534-540.
- Laserna-Mendieta EJ, et al. : Efficacité du traitement par inhibiteur de la pompe à protons pour l’œsophagite à éosinophiles chez 630 patients : résultats de l’enregistrement EoE connect. Alimentary Pharmacology & Therapeutics 2020 ; 52 : 798-807.
- Kagalwalla AF, et al : Identification of Specific Foods Responsible for Inflammation in Children With Eosinophilic Esophagitis Successfully Treated With Empiric Elimination Diet. Journal of Pediatric Gastroenterology & Nutrition 2011 ; 53 : 145-149.
- Kagalwalla AF, et al : Effect of Six-Food Elimination Diet on Clinical and Histologic Outcomes in Eosinophilic Esophagitis. Gastroentérologie et hépatologie cliniques 2006 ; 4 : 1097-1102.
- Straumann A, et al : Le traitement d’entretien au budésonide à long terme est partiellement efficace pour les patients atteints d’œsophagite à éosinophiles. Clin Gastroenterol Hepatol 2011 ; 9 : 400-409.e1
- Straumann A, et al : Budesonide Orodispersible Tablets Maintain Remission in a Randomized, Placebo-Controlled Trial of Patients With Eosinophilic Esophagitis. Gastroenterology 2020 ; 159 : 1672-1685.e5
- Hirano I, et al : Évaluation endoscopique des caractéristiques œsophagiennes de l’œsophagite à éosinophiles : validation d’un nouveau système de classification et de gradation. Gut 2013 ; 62 : 489-495.
- Schoepfer AM, et al : Development and validation of a symptom-based activity index for adults with eosinophilic esophagitis. Gastroenterology 2014 ; 147 : 1255-1266.e21
- Dellon ES, et al : Développement et test sur le terrain d’une nouvelle mesure de résultat patient-reporté de la dysphagie chez les patients atteints d’œsophagite à éosinophiles. Aliment Pharmacol Ther 2013 ; 38 : 634-642
- Martin LJ, et al : Pediatric Eosinophilic Esophagitis Symptom Scores (PEESS v2.0) identifient les corrélations histologiques et moléculaires des principales caractéristiques cliniques de la maladie. J Allergy Clin Immunol 2015 ; 135 : 1519-1528.e8
PRATIQUE DU MÉDECIN DE FAMILLE 2023, 18(9) : 34-36