Le virus du SRAS-CoV-2 constitue une menace particulière pour les patients hématologiques. de danger. D’une part, leur système immunitaire est souvent affaibli par la maladie et, d’autre part, de nombreux traitements réduisent encore la réponse immunitaire. Que faut-il faire lorsque le cancer du sang et le COVID-19 se rencontrent ? Et quelle est la place de la vaccination ?
Face à la pandémie, non seulement les soins aux patients hématologiques sont compromis, mais une autre menace est apparue pour eux avec un virus potentiellement mortel. Alors que la mortalité liée à COVID-19 dans le secteur hospitalier est d’environ 12,1% pour l’ensemble des patients non oncologiques, elle est de 20,5% pour les patients oncologiques, ce qui constitue une différence statistiquement significative. Ces chiffres sont fournis par le registreeuropéen LEOSS (Lean European Open Survey on SARS-CoV-2 infected patients). Selon le registre, même après un traitement intensif de l’infection, la mortalité des personnes atteintes de cancer est plus élevée que celle des patients sans diagnostic oncologique. Les personnes atteintes d’une maladie hématologique sont encore plus vulnérables, comme le montre une étude publiée en août 2020 dans la revue Nature [1]. Celle-ci a prouvé ce que beaucoup soupçonnaient déjà à l’époque : La mortalité liée au COVID-19 chez les patients hématologiques est particulièrement élevée. Elle est plus élevée que celle de tous les autres patients oncologiques et est comparable à celle des patients immunodéprimés. Au cours de la première année de traitement, le risque de décès par le virus du SRAS-CoV-2 est même multiplié par deux par rapport à la population générale. En ce qui concerne la maladie de base, les lymphomes en particulier semblent constituer une mauvaise condition préalable à l’évolution de l’infection par le SRAS-CoV-2 [2]. Ces connaissances acquises au cours des deux dernières années incitent à une approche différenciée de la maladie COVID-19 chez les patients hématologiques et soulignent l’importance de la meilleure prophylaxie possible dans ce groupe de population – un défi compte tenu de la situation dynamique et de la jeunesse des études.
Quels sont les patients les plus à risque ?
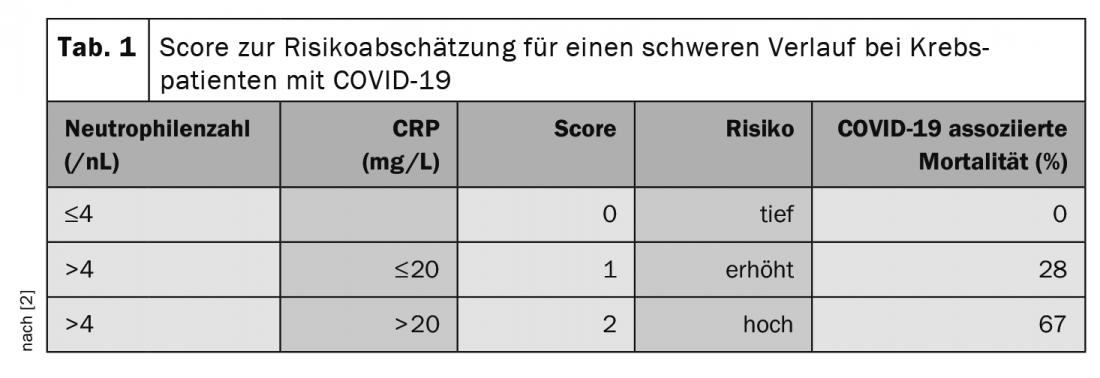
Dans le cadre de la réunion annuelle des sociétés allemande, autrichienne et suisse d’hématologie et d’oncologie médicale en octobre, le professeur Clemens Wendtner, médecin-chef de la clinique munichoise de Schwabing et secrétaire scientifique du groupe d’étude allemand sur la LLC (DCLLSG), a souligné l’importance du traitement pour le risque associé à COVID-19. Ainsi, les patients sous traitement par anticorps anti-CD20, comme le rituximab, et sous traitement stéroïdien seraient particulièrement à risque, >10 mg/j d’équivalent prednisone pendant >5 jours étant déjà considéré comme critique. Les inhibiteurs de point de contrôle sont également associés à une augmentation de la létalité [2]. Une étude a également recherché des facteurs permettant de prédire les évolutions graves de COVID-19 chez les patients atteints de tumeurs [2]. Dans ce cas, le nombre de neutrophiles (>4,4/nL) et le taux de CRP (>20 mg/L) avant l’infection semblent avoir une valeur pronostique. Les auteurs ont développé un score à partir de cette constatation (tab. 1).
Gestion du SRAS-CoV-2 chez les patients hématologiques : Danse avec le diable
En plus de la sensibilité accrue aux évolutions graves et mortelles de COVID-19, on observe également une excrétion virale prologée jusqu’à 70 jours après le diagnostic chez les personnes atteintes d’hémopathies malignes. Même en cas d’évolution asymptomatique, cela représente un risque potentiel d’infection pour les personnes en contact et ne doit pas être négligé lors du traitement des patients concernés [3]. Outre le respect strict des mesures d’hygiène au profit de toutes les personnes concernées, une importance particulière est accordée au traitement précoce. Pourtant, la meilleure approche thérapeutique n’est toujours pas claire. Selon les experts présents au congrès, l’optimisation des mesures de soutien est notamment une priorité indiscutable. Cela inclut l’anticoagulation prophylactique chez les patients hospitalisés, mais aussi une bonne prophylaxie et un traitement antibiotique, antiviral et antifongique des infections secondaires. Par exemple, une protection médicamenteuse systématique entraîne une incidence significativement plus faible de l’aspergillose pulmonaire associée au COVID-19 [4]. De même, les immunoglobulines intraveineuses (IgIV) peuvent et doivent être utilisées en cas de déficit secondaire avéré en immunoglobulines. La question de savoir si un éventuel traitement immunosuppresseur doit être arrêté face à une maladie COVID-19 n’est actuellement pas claire et doit être décidée au cas par cas. De manière générale, le traitement de ce groupe de patients particulièrement vulnérables doit être individualisé et étroitement lié à l’immunosuppression et au titre d’anticorps.
En ce qui concerne le traitement spécifique du COVID-19, on utilise notamment, comme pour les patients non hématologiques, l’antiviral Remdesivir, la dexaméthasone et le tocilizumab. De plus en plus, l’accent est mis sur le traitement par anticorps passifs. Elle joue un rôle de plus en plus important, en particulier chez les patients séronégatifs, dont font souvent partie les personnes immunodéprimées et les personnes atteintes d’hémopathies malignes. Entre-temps, il existe quelques études sur la combinaison des agents casirivimab et imdevimab, également connue sous le nom de REGEN-COV. Il est également possible d’utiliser du plasma de convalescence, bien qu’il n’existe actuellement aucune étude positive sur les personnes immunodéprimées. Dans tous les cas, un traitement précoce dans les 3 à 5 jours suivant le début des symptômes est le plus prometteur. L’utilisation chez les patients à risque dans le cadre d’une prophylaxie post-exposition – par exemple après une épidémie nosocomiale – est envisageable et en cours d’étude. Une étude a montré que cette approche permettait de réduire les risques de 83% en cas d’utilisation précoce, et une procédure d’autorisation de mise sur le marché est en cours auprès de la FDA américaine [5]. En particulier chez les patients à haut risque, comme ceux qui suivent un traitement par déplétion des cellules B, l’utilisation d’un traitement par anticorps peut encore être envisagée à un stade ultérieur de la maladie si l’on soupçonne une production insuffisante par le patient lui-même. C’est ce que recommande le STAKOB allemand (Ständiger Arbeitskreis der Kompetenz- und Behandlungszentren für Krankheiten durch hochpathogene Erregen), en particulier en cas de charge virale élevée. De plus, selon le STAKOB, les anticorps anti-pics devraient être prélevés, sans attendre les résultats. En cas de traitement par anticorps, le risque de réactions allergiques ne doit pas être négligé, un contrôle clinique étroit avec une période de suivi d’au moins une heure est nécessaire.
En ce qui concerne l’efficacité du REGEN-COV, certaines lacunes apparaissent tant pour les variantes sud-africaines que pour les variantes brésiliennes et écossaises. En revanche, le sotrovimab (VIR-7831), plus récent, semble pleinement efficace dans ce cas également. Avec l’émergence en cours de nouvelles variantes, les médecins et l’industrie pharmaceutique vont probablement devoir relever plusieurs défis. Il s’agit de maintenir une surveillance étroite pendant toutes les phases de la pandémie et de rester constamment à jour au niveau individuel. C’est la seule façon de garantir les meilleurs soins possibles.
Vacciner, vacciner, vacciner
Dans le cadre de la vaccination également, l’émergence de nouveaux variants est régulièrement au centre de l’attention, avec des préoccupations indéniables quant à l’efficacité de l’immunisation active. Celle-ci varie entre les différentes variantes du virus. Là encore, les personnes atteintes de maladies hématologiques constituent un cas particulier. Par exemple, une analyse de 88 patients ayant subi une transplantation de cellules souches hématopoïétiques et ayant reçu un vaccin contre l’ARNm a montré que 41% d’entre eux n’ont pas développé une protection vaccinale suffisante [6]. La réponse au vaccin était particulièrement mauvaise si un traitement immunosuppresseur avait été administré au cours des trois derniers mois, si la transplantation avait eu lieu il y a moins d’un an et si le nombre de lymphocytes <était de 1 G/L – tous ces facteurs étant déjà connus pour d’autres vaccins.
Mais même s’il est prouvé que la réponse à la vaccination est moins bonne, les experts présents à la conférence annuelle ont été unanimes : la vaccination reste la mesure de prévention la plus importante – et le faible taux de vaccination le plus gros problème. En effet, même si la protection vaccinale est plus faible chez les patients immunodéprimés, la vaccination ne leur fait pas de mal. Elle est également recommandée avant, pendant ou après un traitement hémato-oncologique, quel que soit le type de traitement. Comme la protection n’est pas seulement médiée par les cellules B, mais aussi par les cellules T, même la déplétion des cellules B et le traitement à haute dose par transplantation de cellules souches hématopoïétiques ne constituent pas des contre-indications absolues, selon les lignes directrices d’Onkopedia actuellement en vigueur [7]. Cependant, la réponse à la vaccination est plus élevée à mesure que l’on s’éloigne de la greffe de cellules souches hématopoïétiques. Par conséquent, compte tenu de la situation infectieuse, l’attentisme peut être justifié.
Un grand espoir réside actuellement dans la troisième dose de vaccin, qui devrait augmenter la réponse et la durée de la réponse vaccinale. Pour les transplantés d’organes, il a déjà été démontré qu’elle avait un effet durable sur la réponse immunitaire [8]. Selon des données israéliennes, la troisième dose permet également de réduire de manière significative le risque d’évolution grave dans la population générale [9]. Selon les données, celui-ci est multiplié par 19,5 chez les personnes de plus de 60 ans qui n’ont pas reçu de vaccin de rappel. Le professeur Wendtner pense que cet effet devrait également se faire sentir chez les personnes atteintes d’hémopathies malignes. Une étude menée chez des patients ayant subi une greffe de cellules souches allogéniques a montré une nette amélioration de la réponse vaccinale avec la troisième vaccination. Cependant, là encore, 22% des participants à l’étude n’ont pas obtenu de réponse vaccinale suffisante [10]. Selon le professeur Wendtner, il est possible de procéder à une vaccination de rappel après seulement 3 à 4 mois selon la situation, une administration simultanée avec le vaccin contre la grippe ne pose aucun problème et s’impose. La troisième vaccination devrait dans tous les cas être effectuée avec un agent à base d’ARNm, même si un vaccin vectoriel a été utilisé auparavant. L’expert conseille également de contrôler à bas seuil la réponse vaccinale des patients en hématologie et en oncologie afin de rassurer les patients et les soignants.
Source : Conférences “COVID 19 in hematological diseases” par Clemens-Martin Wendtner et “COVID-19 in Allogenic Stem Cell Recipients” par Eduard Schulz dans le cadre du symposium scientifique “COVID 19 – Part 1”. Congrès annuel des sociétés allemande, autrichienne et suisse d’hématologie et d’oncologie médicale, 02.10.2021, Berlin (D).
Littérature :
- Williamson EJ, et al : Factors associated with COVID-19-related death using OpenSAFELY. Nature 2020 ; 584(7821) : 430-436.
- Kiani A, et al : Les paramètres de laboratoire de pré-infection peuvent prédire la sévérité du COVID-19 chez les patients atteints de tumeurs. Cancer Med 2021 ; 10(13) : 4424-4436.
- Avanzato VA, et al. : Etude de cas : Dépouillement infectieux prolongé du SRAS-CoV-2 chez un individu asymptomatique immunocompromis atteint d’un cancer. Cell 2020 ; 183(7) : 1901-1912.e9.
- Hatzl S, et al : Antifungal prophylaxis for prevention of COVID-19-associated pulmonary aspergillosis in critically ill patients : an observational study. Crit Care 2021 ; 25(1) : 335.
- O’Brien MP, et al. : Subcutaneous REGEN-COV Antibody Combination to Prevent Covid-19. N Engl J Med 2021 ; 385(13) : 1184-1195.
- Redjoul R, et al : Réponse anti-corps après une seconde dose de BNT162b2 chez des receveurs de TCSH allogéniques. Lancet 2021 ; 398(10297) : 298-299.
- Lilienfeld-Toal M, et al. : Infection à coronavirus (COVID-19) chez les patients* atteints d’hémopathies et de cancers – Ligne directrice Onkopedia. Situation en avril 2021. www.onkopedia.com/de/onkopedia/guidelines/coronavirus-infektion-covid-19-bei-patient-innen-mit-blut-und-krebserkrankungen/@@guideline/html/index.html.
- Kamar N, et al : Three Doses of an mRNA Covid-19 Vaccine in Solid-Organ Transplant Recipients. N Engl J Med 2021. 385 : 661-662.
- Bar-On YM, et al : Protection of BNT162b2 Vaccine Booster against Covid-19 in Israel. N Engl J Med 2021 ; 385(15) : 1393-1400.
- Redjoul R, et al : Réponse anti-corps après une troisième dose de BNT162b2 chez les receveurs de TCSH allogéniques. Lancet Haematol 2021 ; 8(10) : e681-e683.
InFo ONKOLOGIE & HÄMATOLOGIE 2021 ; 9(6) : 23-24 (publié le 8.12.21, ahead of print)