La forme la plus courante de démence est la maladie d’Alzheimer, qui évolue de manière chronique et progressive et qui se caractérise principalement par des troubles de la mémoire. Une fois le diagnostic d’exclusion initial effectué par le prestataire de soins primaires, un diagnostic différencié doit être effectué dans une clinique de référence. Cela permet d’établir un diagnostic différentiel des maladies de démence.
Cliniquement, le diagnostic de démence repose actuellement, selon le DSM IV-TR et la CIM-10, sur la mise en évidence d’une altération de la mémoire et de troubles du raisonnement, de l’attention et d’autres troubles tels que l’aphasie, l’apraxie, l’agnosie ou l’altération des fonctions exécutives. Il faut en outre constater une détérioration par rapport au niveau de performance antérieur et une altération des capacités quotidiennes.
Causes de la démence
Fin 2012, le nombre de personnes âgées de plus de 60 ans en Suisse était de 1,8 million, ce qui, avec une prévalence de la démence de 6,9% en Europe occidentale [1], laisse présager plus de 120 000 personnes atteintes de démence dans ce groupe. Les causes les plus fréquentes de démence sont la maladie d’Alzheimer (MA), les formes de démence vasculaire (VaD) et la démence liée à la maladie de Parkinson/corps de Lewy (PDD/DLB). Chez les moins de 60 ans, les dégénérescences lobaires fronto-temporales (FTLD) et les déficiences cognitives dues à des maladies psychiatriques, comme l’abus d’alcool, jouent un rôle important [2]. À un âge avancé, les formes mixtes de MA et de pathologie vasculaire sont la cause la plus fréquente [3]. Les causes de démence potentiellement réversibles sont nettement minoritaires.
Diagnostic différentiel de la démence d’Alzheimer
Le diagnostic d’exclusion reste d’une importance capitale. Dans le cadre du diagnostic primaire, l’anamnèse détaillée est essentielle. Elle doit également permettre d’appréhender les répercussions des troubles cognitifs sur la vie quotidienne et la situation sociale du patient. Il s’agit d’interroger de manière ciblée les facteurs de stress actuels et les indices d’un syndrome dépressif. L’utilisation d’un instrument de dépistage (par exemple, le MMSE avec le test de l’horloge) est utile et bénéfique. Les examens suivants sont recommandés en routine : NFS, Na, K, Ca, créatinine, urée, GPT, GOT, gamma-GT, albumine, glucose à jeun et HBA1c, TSH, BSR, CRP, vitamine B12 et acide folique, ainsi qu’une imagerie cérébrale [modifiziert nach 4].
Pour chaque syndrome de démence, l’orientation vers une clinique de la mémoire doit être envisagée, toujours en tenant compte de la volonté du patient et de sa famille et des réserves, craintes et attentes de toutes les parties concernées.
La MA sporadique est la cause la plus fréquente de démence et débute lentement de manière progressive par des troubles de la mémoire sans déficit neurologique. Hormis les symptômes affectifs tels que l’anxiété et la dépression, qui peuvent apparaître au début ou avant la maladie, la personnalité est préservée pendant longtemps. Les écarts par rapport à ce tableau typique, par exemple un début précoce, une progression rapide, un début avec des troubles du comportement ou du langage et une évolution fluctuante des symptômes cognitifs, peuvent être des indicateurs d’une autre forme de démence et plaident pour une présentation du patient à une clinique de la mémoire. L’apparition de symptômes neurologiques focaux et de troubles quantitatifs de la conscience nécessite une évaluation immédiate.
Les connaissances de base suivantes concernant les diagnostics différentiels les plus courants de la MA sont très pertinentes :
1. les dégénérescences lobaires fronto-temporales (FTLD) constituent un groupe hétérogène sur le plan clinique et pathologique. De nouvelles protéines contribuant à la neurodégénérescence (TDP-43, FUS) ont été identifiées au cours des dernières années. La caractéristique de la dégénérescence lobaire fronto-temporale est l’atrophie des lobes frontaux et temporaux, dont le schéma détermine le tableau clinique variable. La division la plus connue est celle de la démence fronto-temporale (DFT) avec troubles primaires du comportement, ainsi que l’aphasie progressive non fluente (AP) et la démence sémantique (DS) avec troubles primaires du langage [5].
Les principaux symptômes de la démence fronto-temporale sont une altération de la personnalité et du comportement social, un émoussement émotionnel précoce et une perte de la conscience de la maladie. La mémoire est relativement intacte au début de la maladie.
L’aphasie non fluente, qui est souvent liée à une pathologie de la MA, est une aphasie où le débit de parole est perturbé. Les troubles de la recherche de mots, de la grammaire et de la syntaxe sont typiques. Au fur et à mesure de l’évolution, une augmentation
Développer le mutisme. Bien que les patients semblent gravement affectés, leurs capacités cognitives en dehors du langage sont souvent conservées longtemps. Le langage de la démence sémantique est fluide, mais souvent vide de contenu. La signification des objets ou même les visages connus ne sont plus reconnus. Les informations ne sont souvent plus comprises.
2. dans la démence à corps de Lewy et la démence de Parkinson, les dépôts d’α-synucléine constituent le trait caractéristique. Un trouble de la mémoire n’est pas une condition préalable au diagnostic. La démence parkinsonienne est diagnostiquée dans le cadre d’une maladie de Parkinson de longue durée, lorsqu’un trouble cognitif affectant le niveau de performance sociale ou professionnelle se développe. Dans la DLB, les troubles cognitifs se manifestent avant les symptômes de la maladie de Parkinson ou à un moment proche de ceux-ci, et une pathologie de la MA est généralement associée. Les principaux symptômes sont une forte fluctuation des performances cognitives avec une vigilance et une attention fluctuantes, ainsi que des hallucinations visuelles détaillées récurrentes et des symptômes parkinsoniens. Un trouble du comportement du sommeil paradoxal et une forte sensibilité aux antagonistes de la dopamine sont également des signes révélateurs, qu’il faut absolument éviter en cas de suspicion de DLB/PDD. Si deux symptômes centraux sont présents, ou un symptôme central et un symptôme évocateur, il est possible de diagnostiquer un PDD/DLB probable.
3. les formes de démence vasculaire sont très hétérogènes sur le plan clinique et pathologique. La démence multi-infarctus, par exemple, est très différente de l’encéphalopathie artérioscléreuse sous-corticale (SAE). Alors que les petits infarctus stratégiques suffisent à provoquer un syndrome de démence, les infarctus plus importants peuvent être cliniquement muets. L’imagerie est centrale pour mettre en évidence une lésion vasculaire explicative et, idéalement, il existe un lien temporel entre l’apparition de la lésion et les troubles cognitifs [6], ce qui est particulièrement difficile dans le cas de la SAE. Dans le cas des formes mixtes fréquentes avec la MA, il est difficile de déterminer au cas par cas la part de chaque pathologie dans le tableau des troubles.
Démence d’Alzheimer et dépression – points communs et différences
La prévalence de la dépression majeure chez les personnes âgées est de 3%. De plus, 40% d’entre eux présentent des symptômes de dépression cliniquement significatifs [7]. La dépression liée à l’âge est souvent accompagnée de maladies neurodégénératives. Il n’est pas rare que les personnes âgées souffrant d’un début de trouble cognitif consultent leur médecin en raison de symptômes dépressifs. Inversement, la dépression liée à l’âge peut entraîner des troubles cognitifs évidents. On peut citer par exemple le déclin général dans le traitement de l’information ainsi que l’altération de la mémoire épisodique, du langage et des fonctions exécutives [8]. De plus, il est possible qu’il existe une base neurobiologique commune entre la dépression liée à l’âge et la MA [9]. On trouve des indices de processus inflammatoires chroniques, d’une activation excessive de l’axe HPA et d’une perturbation de la cascade de signalisation des facteurs de croissance nerveuse. Cela pourrait expliquer le risque plus élevé de MA en cas de troubles dépressifs récurrents.
Dans la MA, outre les troubles de la mémoire, ce sont les troubles de l’orientation qui sont au premier plan, alors que cette dernière est généralement intacte dans la dépression. Les patients dépressifs ont souvent des antécédents de dépression et les troubles cognitifs régressent avec le traitement. La neuropsychologie peut également constater des différences : dans la MA, la reconnaissance est nettement perturbée par rapport à la dépression – des intrusions et des erreurs constructives-apraxiques apparaissent [10]. En raison du meilleur pronostic des troubles cognitifs de la dépression lorsqu’ils sont traités, il est urgent de diagnostiquer précocement la maladie chez les personnes âgées. Un traitement antidépresseur est également indiqué en cas de symptômes dépressifs dans le cadre d’une MA.
Démence versus délire
Les symptômes cliniques de la MA et du delirium se chevauchent souvent, ce qui rend la distinction difficile. Les deux maladies présentent des troubles de la mémoire, de l’orientation et du langage, ainsi que des symptômes associés tels que la dépression, les troubles du rythme veille-sommeil, l’agitation et l’agressivité. [11]. Seule l’altération de la conscience est caractéristique du délire et n’est pas présente dans la MA. Ce symptôme ne peut être détecté que par une observation continue car il est très fluctuant. Le délire, en tant qu’état aigu, peut régresser grâce au traitement de l’élément déclencheur. En revanche, les troubles cognitifs de la MA s’aggravent au fil du temps. L’âge et la MA étant des facteurs de risque pour le délire, les deux affections apparaissent souvent ensemble. En cas de delirium V.a., une recherche étendue des facteurs causaux tels que les infections, les troubles métaboliques et les médicaments est indiquée. Les échelles de délire aident à établir un diagnostic différentiel.
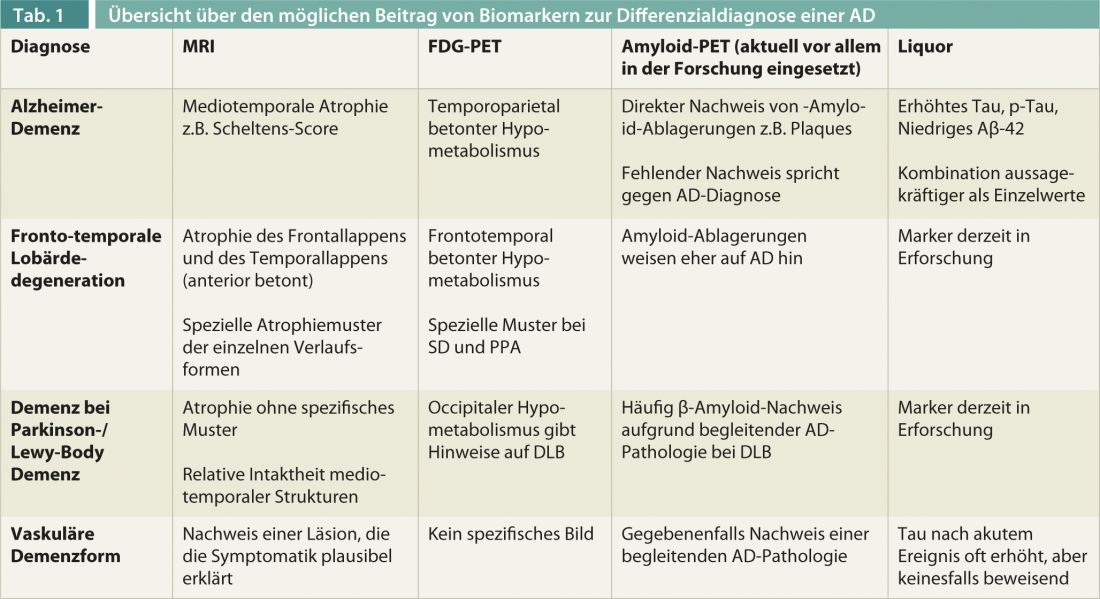
Perspectives d’avenir : Détection directe de la pathologie par des biomarqueurs
La spécificité d’un diagnostic clinique de la MA pour une confirmation pathologique est actuellement de 58 en médiane et la sensibilité de 87% [12]. Pour améliorer la fiabilité du diagnostic, on utilise de plus en plus de biomarqueurs, ce qui sera particulièrement important lors de l’utilisation de thérapies spécifiques comme l’immunothérapie contre la β-amyloïde et le diagnostic précoce (tableau 1).
PD Dr. med. Egemen Savaskan
Dr. med. Anton Gietl
Littérature :
- Alzheimers Dement 2013 ; 9(1) : 63-75 e2.
- Lancet Neurol 2010 ; 9(8) : 793-806.
- Acta Neuropathol 2010 ; 119(4) : 421-433.
- DGPPN : Ligne directrice sur le diagnostic et le traitement de la démence. 2010.
- Neurology 1998 ; 51(6) : 1546-1554.
- Neurology 1993 ; 43(2) : 250-260.
- Savaskan E : La dépression chez les personnes âgées : ce que le médecin généraliste doit savoir. InFo N&P 2011 ; 9 (5-6) : 21-24.
- Am J Psychiatry 2012 ; 169 : 1185-1193.
- Eur J Pharmacol 2010 ; 626 : 64-71.
- Beblo T, Lautenbacher S : Neuropsychologie de la dépression. Éditions Hogrefe, 2006.
- Leading Opinions, Neurologie & Psychiatrie 2012 ; 1 : 6-7.
- J Neuropathol Exp Neutrol 2012 ; 71 : 266-273.