Les poussées caractérisées par la formation de larges pustules sur la peau sont caractéristiques du psoriasis pustuleux généralisé (GPP) et peuvent être associées à des réactions inflammatoires systémiques et à des complications graves. Une étude publiée cette année dans le JEADV a analysé les données d’une grande cohorte européenne de patients atteints de GPP. Elle a confirmé que le tableau clinique est hétérogène, la sévérité des symptômes variant entre les individus et au sein d’un même individu.
Les symptômes associés au GPP, tels que la douleur, la fièvre et la fatigue, ainsi que les maladies associées fréquentes, peuvent avoir un impact considérable sur la qualité de vie [1,2]. De plus, les patients atteints de GPP souffrent souvent d’anxiété et de dépression [3]. L’European Rare and Severe Psoriasis Expert Network (ERASPEN) définit la GPP comme une maladie caractérisée par des pustules primaires, stériles et macroscopiquement visibles sur une peau non acrale (en dehors des plaques de psoriasis) [4]. Les pustules profondes se manifestent au niveau du derme supérieur (“pustules spongiformes de Kogoj”), du stratus spinosum (“micro-abcès de Munro”) ainsi qu’à l’intérieur ou à proximité de la couche cornée de l’épiderme. La formation de pustules s’accompagne d’une infiltration marquée de granulocytes neutrophiles et de cellules mononucléées dans l’épiderme [4,5].
Série de cas européens multicentriques
Selon la définition de l’ERASPEN, le GPP se caractérise par une évolution récurrente ou persistante, la formation de pustules pouvant être associée à une inflammation systémique et/ou apparaître en même temps que des symptômes de psoriasis vulgaire [4]. Le score Generalized Pustular Psoriasis Physician Global Assessment (GPPGA) est souvent utilisé pour évaluer la sévérité du GPP [6–8]. Les préparations histologiques permettent de mettre en évidence des éléments caractéristiques du GPP, tels qu’un infiltrat neutrophilique prononcé dans le derme supérieur, des pustules de Kogoj spongiformes et une hyperkératose avec micro-abcès neutrophiliques dans l’épiderme. Un diagnostic définitif n’est généralement possible qu’en combinant l’anamnèse et l’examen clinique. Dans une étude menée en 2022 et publiée en 2024 par Wolf et al., 58 patients atteints de GPP ont été recrutés dans 12 centres médicaux de neuf pays européens [1]. Le diagnostic de GPP a été vérifié à l’aide des critères ERASPEN. Chez 80,4% des patients, le diagnostic a été confirmé par des biopsies cutanées supplémentaires. L’âge moyen des participants était de 61 ans (fourchette : 16-92) et 60,3% étaient des femmes. Les comorbidités les plus fréquentes étaient l’hypertension (43,1%) et l’hyperlipidémie (32,8%). 34 patients (58,6%) présentaient un psoriasis en plaques concomitant avant ou pendant l’évolution de la GPP [1]. Chez 26 personnes, les données de deux poussées distinctes ont été recueillies ; chez 32 patients, la dernière poussée a été déclarée comme étant la plus sévère.
Afin d’obtenir une mesure quantitative de la sévérité des symptômes systémiques d’un patient, chaque patient s’est vu attribuer un score de maladie systémique combiné (0-6) basé sur la présence de symptômes inflammatoires systémiques et de marqueurs d’inflammation pendant chaque poussée de la maladie. Un point a été attribué à la présence de chacun des critères suivants :
- fièvre [>38°C]
- des niveaux élevés de protéine C-réactive (CRP) (>5 mg/L)
- taux élevé de leucocytes (>10 000 ou >13 000 μL)
- Hypocalcémie (<2,1 mmol/L),
- Hypoalbuminémie (<35 g/L)
- des taux élevés de transaminases (taux sérique d’alanine transaminase >35 ou >45 U/L ; taux sérique d’aspartate transaminase >35 ou >40 U/L).
Parmi tous les participants (N=58), le médecin a déterminé, sur la base de tous les épisodes documentés, (a) la dernière poussée survenue et (b) la plus grave. Chez 32 patients, la dernière poussée s’est avérée être la plus grave (tableau 1). Plus de 90% des patients ont été hospitalisés à la suite de la poussée la plus sévère, dont plus de 75% avaient un score GPPGA total de 3 ou 4. Les symptômes systémiques étaient plus fréquents chez les patients ayant un score GPPGA de 3 ou 4, mais étaient également observés lorsque le score GPPGA était ≤2. Une analyse de corrélation de Pearson a été réalisée à partir des données de toutes les poussées individuelles afin de déterminer la relation entre le score combiné de maladie systémique et le score total de GPPGA, le sous-score de pustulation de GPPGA et la durée de la poussée. Une corrélation significative a été observée entre un score de maladie systémique combiné de caractéristiques cliniques et de laboratoire et le score total GPPGA (r=0,385, p<0,001) et le sous-score de pustulation GPPGA (r=0,305, p<0,05).
Corrélations avec les scores GPPGA
Étonnamment, les symptômes systémiques sont également apparus chez les patients ayant un score total de GPPGA ou un sous-score de pustules de GPPGA de 1 ou 2 [1]. Mais dans l’ensemble, une association significative a été observée entre le score combiné de maladie systémique et à la fois le score total GPPGA (r=0,385, p<0,001) et le sous-score de pustulation GPPGA (r=0,305, p<0,05) ainsi que la durée d’hospitalisation (r=0,349, p<0,05). Le score total GPPGA était également significativement corrélé à la concentration de CRP (r=0,360, p<0,05) et aux neutrophiles (r=0,331, p<0,05), tout comme le sous-score de pustulation GPPGA (CRP : r=0,332 ; neutrophiles : r=0,320, p<0,05 pour les deux). Les taux de leucocytes n’étaient pas significativement corrélés au score total de GPPGA (r=0,253) ou au sous-score de pustule de GPPGA (r=0,259).
Une augmentation plus importante des symptômes systémiques, y compris la fièvre (>38°C), l’augmentation de la CRP et des leucocytes, ainsi que des scores GPPGA plus élevés, a été observée dans les sous-groupes ayant l’anamnèse du flare le plus grave (n=26) et du dernier flare le plus grave (n=32) par rapport au sous-groupe ayant d’autres derniers flares (n=26). Dans le sous-groupe de ceux dont le dernier flare était également le plus grave, une proportion plus élevée de patients avait des scores GPPGA de 3 ou 4 par rapport aux autres patients. Une plus grande proportion de patients présentait des symptômes systémiques et des marqueurs d’inflammation systémique plus élevés au cours de la poussée la plus sévère que lors de la dernière poussée.
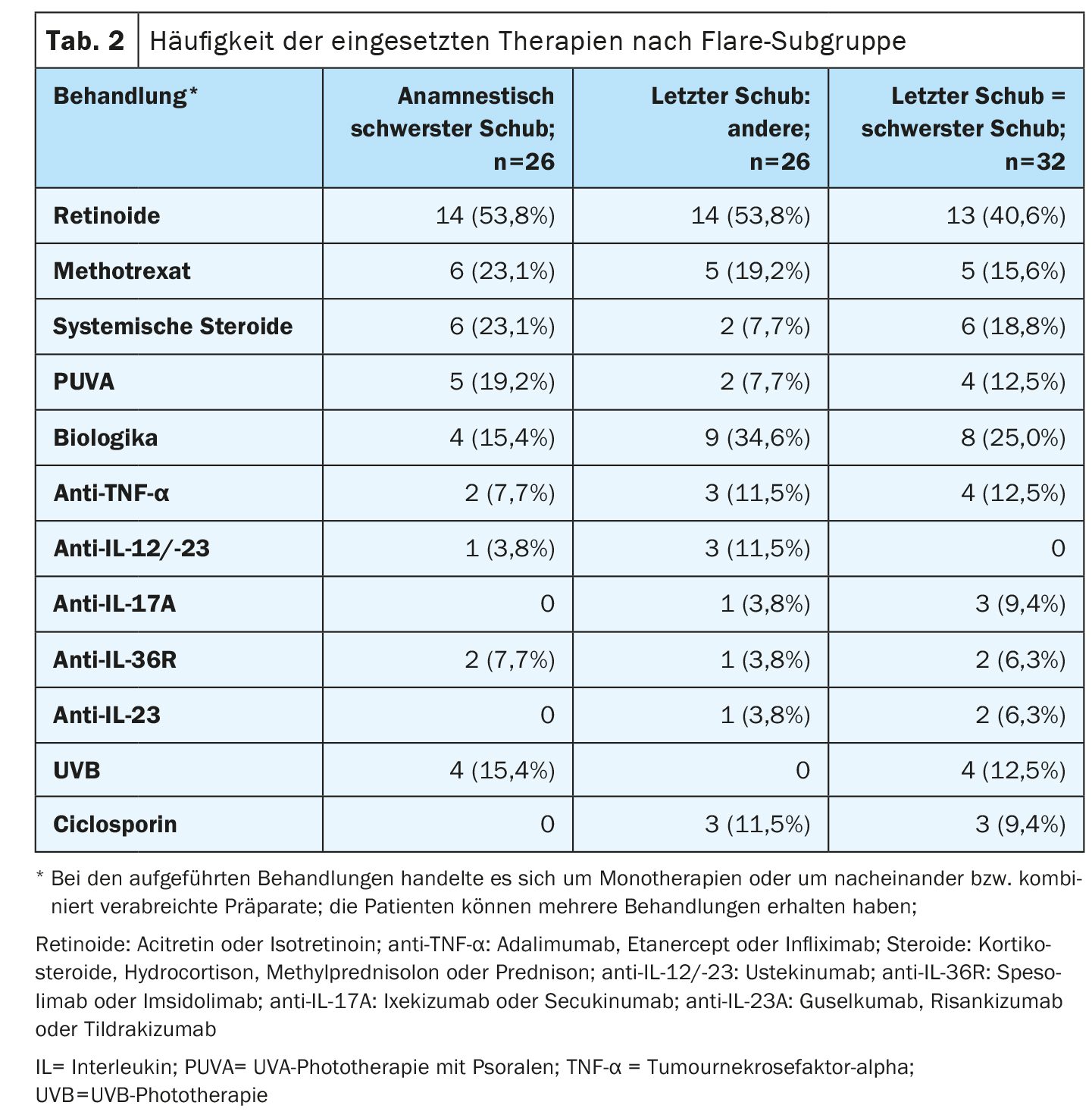
Aperçu des thérapies utilisées
Les rétinoïdes ont été le traitement le plus fréquemment utilisé dans tous les sous-groupes (tableau 2), avec un pourcentage de 25,0% (8 sur 32) de patients traités par des médicaments biologiques dans le sous-groupe “dernière poussée = poussée la plus sévère” par rapport au sous-groupe “poussée anamnestique la plus sévère” (15,4% ; 4 sur 26). L’utilisation de la photothérapie sous forme de PUVA (psoralènes avec UV-A) ou d’UVB était plus élevée dans le sous-groupe ayant l’anamnèse de la poussée la plus sévère de la maladie que dans les sous-groupes dont la dernière poussée correspondait à la poussée la plus sévère de la maladie jusqu’à présent, ainsi que dans les autres dernières poussées. Il en va de même pour l’option thérapeutique des stéroïdes systémiques. La ciclosporine n’a été utilisée que rarement, tant dans le sous-groupe ayant l’anamnèse de la poussée la plus sévère que dans celui ayant la dernière poussée, qui est aussi la plus sévère : 0% (n=0) et 9,4% (3 sur 32).
Avec une fréquence relative de 77,4% (65 sur 84), la majorité des épisodes ont été suivis d’une résolution. Le délai moyen entre le début du traitement et la résolution des poussées était comparable dans tous les sous-groupes :
- anamnèse de la poussée la plus sévère, 4 (intervalle 1-16) semaines
- dernière poussée, qui est aussi la plus grave : 4 (intervalle 0,1-52) semaines
- autres dernières poussées : 4 (intervalle 1-54) semaines.
En résumé, toutes les poussées de GPP ont été associées à une charge clinique importante, ce qui souligne l’importance d’un diagnostic précoce comme base d’un traitement adéquat en temps utile.
Littérature :
- Wolf P, et al. : Caractéristiques et prise en charge du psoriasis pustuleux généralisé (GPP) : expérience du réseau d’experts GPP d’Europe centrale et orientale (CEE). JEADV 2024 ; 38(8) : 1531-1542.
- Prinz JC, et al : JEADV 2022 ; 37 : 256-273.
- Lebwohl M, et al : J Psoriasis Psoriatic Arthritis. 2022 ; 7(2) : 71-78.
- Navarini AA, et al : JEADV 2017 ; 31(11) : 1792-1799.
- Benjegerdes KE, et al : Psoriasis (Auckl) 2016 ; 6 : 131-144.
- Bachelez H, et al. : NEJM 2019 ; 380(10) : 981-983.
- Bachelez H, et al. : NEJM 2021 ; 385(26) : 2431-2440.
- Burden AD, et al : Am J Clin Dermatol 2022 ; 23(Suppl 1) : 39-50.
DERMATOLOGIE PRATIQUE 2024 ; 34(5) : 42-43