La transplantation pulmonaire (Lutx) représente également une option thérapeutique établie chez l’enfant et l’adolescent lorsqu’une maladie grave progresse malgré l’épuisement de toutes les mesures thérapeutiques disponibles, que la qualité de vie s’en trouve considérablement affectée et qu’une défaillance terminale de l’organe semble probable dans un avenir prévisible. Néanmoins, le Lutx est une atteinte considérable à l’intégrité physique de l’enfant, avec de nombreux risques.
La transplantation pulmonaire (Lutx) représente également une option thérapeutique établie chez l’enfant et l’adolescent lorsqu’une maladie grave progresse malgré l’épuisement de toutes les mesures thérapeutiques disponibles, que la qualité de vie s’en trouve considérablement affectée et qu’une défaillance terminale de l’organe semble probable dans un avenir prévisible.

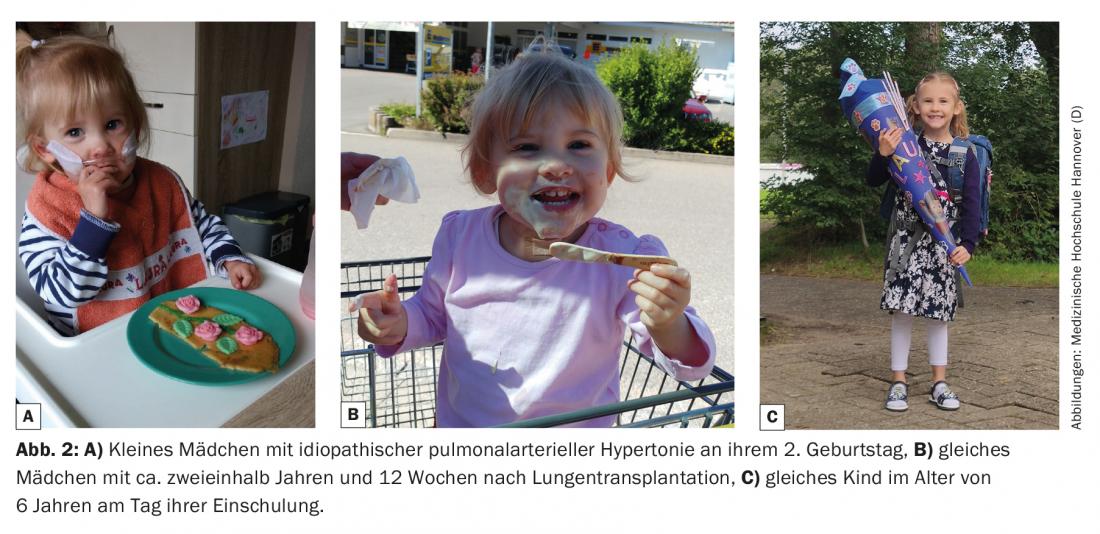
L’objectif principal, à savoir prolonger la vie des personnes concernées et améliorer leur qualité de vie, est atteint dans la plupart des cas. [1,2] (figures 1 et 2). Néanmoins, le Lutx représente une atteinte importante à l’intégrité physique de l’enfant, avec de nombreux risques, des complications potentiellement graves et la nécessité d’un traitement médicamenteux à vie avec de multiples effets secondaires potentiels. Cela a à son tour des conséquences sociales et psychologiques importantes sur l’enfant ou l’adolescent qui grandit, mais aussi sur son environnement familial. La nature et l’étendue sont variables et dépendent de nombreux facteurs tels que la maladie de base, les comorbidités supplémentaires, l’âge, l’environnement social et la stabilité psychologique des personnes concernées. C’est pourquoi, à mon avis, le Lutx est une option de traitement possible, mais pas une conclusion thérapeutique obligatoire pour les enfants dont la vie est en danger. En effet, le choix délibéré de ne pas recourir à une transplantation ne signifie pas l’abandon de l’enfant et n’est pas non plus un signe de faiblesse ou de manque de soins, mais peut même être une meilleure décision pour certains et, dans certaines circonstances, leur éviter des souffrances inutiles.
Pour pouvoir prendre cette grave décision, pour ou contre une transplantation, il est indispensable d’informer le patient et ses tuteurs de manière détaillée et honnête, en tenant compte des circonstances médicales et sociales individuelles. Il est notamment important non seulement d’accepter le souhait de l’enfant (qui n’est pas toujours celui des parents), s’il est en âge de prendre une décision, mais aussi de le soutenir activement.
Il m’est difficile d’écrire sur le fait de grandir après une transplantation pulmonaire dans l’enfance et l’adolescence en général. C’est pourquoi j’ai décidé de commencer par donner un aperçu des principaux aspects médicaux du Lutx chez l’enfant et l’adolescent, puis d’aborder une sélection de particularités et de défis en fonction de la phase de vie.
Transplantation pulmonaire chez les enfants et les adolescents
Chaque année, dans le monde entier, des transplantations pulmonaires sont réalisées chez 120 à 140 enfants dans une quarantaine de centres. La plupart des centres réalisent moins de 5 transplantations par an et moins de 5 centres déclarent 10 transplantations ou plus par an à l’International Thoracic Organ Transplant Registry de l’International Society for Heart and Lung Transplantation (ISHLT) [3]. Le nombre de transplantations combinées cœur-poumons a continuellement diminué au cours des 20 dernières années et n’est plus indiqué que dans des cas exceptionnels. L’âge moyen au moment de la transplantation se situe entre 12 et 15 ans et la fibrose kystique (CF) représente toujours l’indication la plus fréquente (environ 60%), suivie par l’hypertension artérielle pulmonaire (HTAP) [4]. On peut toutefois s’attendre à ce que la proportion de patients pédiatriques atteints de mucoviscidose en phase terminale diminue continuellement au cours des prochaines années en raison d’une détection plus précoce et d’un traitement spécifique grâce au dépistage néonatal généralisé et à la disponibilité de modulateurs de la mucoviscidose très efficaces. D’autre part, le nombre d’enfants plus jeunes atteints de maladies pulmonaires diffuses graves, telles que les dysfonctionnements du surfactant, va probablement augmenter, notamment en raison de l’amélioration croissante des possibilités de traitement en soins intensifs.
La détermination de la date de référencement dépend en grande partie de la gravité et de la progression de la maladie sous-jacente. Les critères de décision importants pour l’inscription des patients atteints de mucoviscidose sont un VEMS inférieur à <30% de la valeur théorique, un déclin rapide et irréversible de la fonction pulmonaire, des exacerbations infectieuses répétées mettant en jeu le pronostic vital, des hémoptysies sévères récidivantes ou une insuffisance hypercapnique pulmonaire chronique [5,6]. Pour d’autres pathologies, il n’existe pas de critères de décision validés pour les enfants et, en particulier pour les patients atteints d’hypertension artérielle pulmonaire (HTAP) héréditaire ou idiopathique, l’évaluation du pronostic est très difficile en raison de l’amélioration croissante des options thérapeutiques. Souvent, les patients sont présentés trop tard dans un centre de transplantation, de sorte qu’une évaluation et une information suffisantes ne sont plus possibles ou que les patients ne peuvent même pas être répertoriés en raison de leur état critique (par exemple, sous respiration artificielle et/ou sous ECMO). Par conséquent, tout patient atteint d’une maladie pulmonaire grave, chronique et évolutive doit être évalué précocement dans un centre [5]. Lors de la décision de référencement, il faut également prendre en compte une longue période d’attente. Le temps d’attente moyen des patients pédiatriques à Hanovre est d’environ 3,5 mois. Les procédures de transplantation varient en fonction du centre. A Hanovre, la préférence est donnée à une double transplantation pulmonaire bilatérale séquentielle selon une technique mini-invasive par thoracotomie antérolatérale, si possible sans procédure de remplacement pulmonaire extracorporelle comme l’ECMO ou la machine cœur-poumon. Les patients atteints d’HTAP constituent une exception à cette règle. Dans ce cas, le ventricule droit est toujours soulagé en peropératoire par une ECMO veino-artérielle ou (par exemple chez les nourrissons) par une machine cœur-poumon. Étant donné que tous les patients atteints d’HTAP sévère développent une hypotrophie musculaire du ventricule gauche, une décompensation ventriculaire gauche due à une charge volumique est très fréquente après la transplantation, avec un retour veineux pulmonaire correspondant et l’œdème pulmonaire qui en découle. Cela est à son tour associé à une longue durée de ventilation et à de nombreuses complications telles que les barotraumatismes, la sédation prolongée, l’immobilisation et les infections [7]. C’est pourquoi certains centres continuent de privilégier la transplantation combinée cœur-poumons chez les patients atteints d’HTAP sévère. A Hanovre, seules des transplantations pulmonaires isolées sont réalisées pour ce groupe de patients. Toutefois, une fois la transplantation effectuée, la va-ECMO est toujours laissée en place afin de soulager le ventricule gauche et d’éviter ainsi une charge volumique. Cette procédure permet généralement d’extuber les patients en peu de temps et d'”entraîner” le ventricule gauche au cours des jours suivants en réduisant progressivement le débit de l’ECMO sous contrôle échocardiographique et en mesurant la pression de l’oreillette gauche, jusqu’à ce que l’ECMO puisse ensuite être explantée après 7 jours en moyenne. Dans notre centre, cette procédure a permis de réduire considérablement le temps de ventilation, de diminuer les dysfonctionnements primaires du greffon et de réduire significativement la mortalité [1,8]. Même si un avantage de survie dû à un traitement d’induction, par exemple avec de la globuline antithymocytaire polyclonale ou des antagonistes monoclonaux du récepteur IL-2, n’a pas pu être démontré jusqu’à présent dans des études randomisées et contrôlées, celui-ci est désormais pratiqué dans la plupart des centres [3].
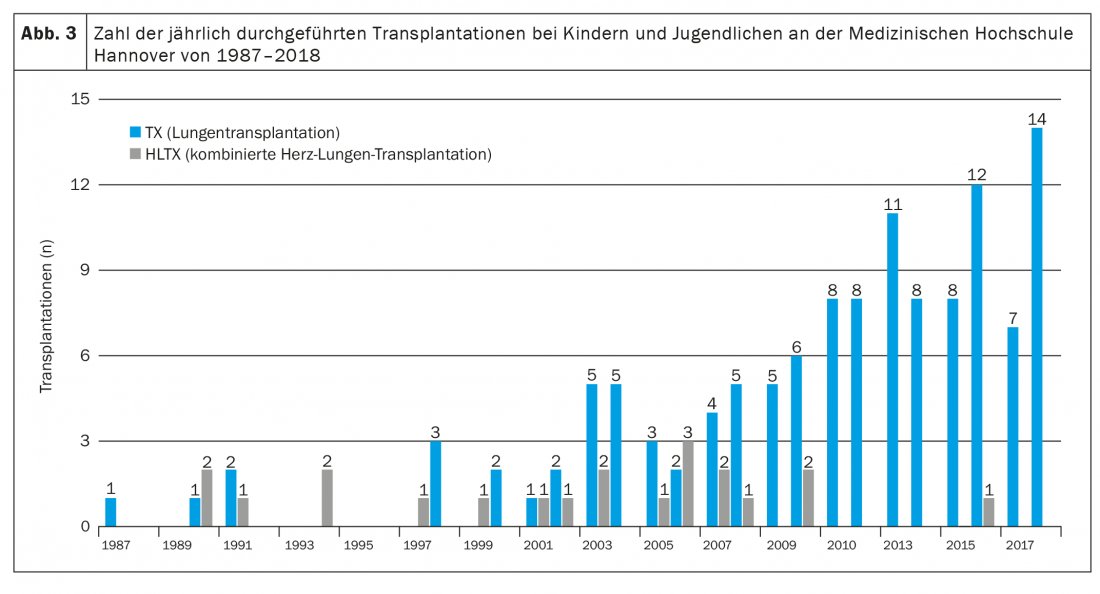
Le traitement immunosuppresseur à long terme comprend un inhibiteur de la calcineurine, un inhibiteur du cycle cellulaire et un glucocorticostéroïde, généralement sous forme de tacrolimus, de mycophénolate mofétil et de prednisolone [3,4,9]. En outre, tous les patients (à Hanovre) reçoivent du ganciclovir ou du valganciclovir pour prévenir une infection à CMV, de l’itraconazole ou du voriconazole pour prévenir une infection fongique et du cotrimoxazole pour prévenir une infection à Pneumocystis jiroveccii, au moins pendant les premiers mois suivant la transplantation. De plus, les effets secondaires souvent très précoces dus au traitement immunosuppresseur, tels que l’hypertension artérielle, l’hypercholestérolémie, le diabète sucré (en particulier chez les patients atteints de mucoviscidose) et l’insuffisance rénale, doivent être traités par des médicaments [4]. En raison de l’immunosuppression intensive requise au cours des 12 premiers mois suivant la transplantation, les infections constituent la principale cause de décès au cours de la première année postopératoire [9]. Les conséquences graves à long terme (dans les 5 premières années après Lutx) du traitement immunosuppresseur sont notamment l’insuffisance rénale sévère (chez environ 6%), le diabète sucré (chez environ 30%) et les tumeurs malignes (chez environ 10%) [3,4,9]. Alors que les tumeurs cutanées sont l’entité maligne la plus fréquente chez les adultes, les patients pédiatriques sont principalement atteints de lymphomes associés à l’EBV. La cause de décès la plus fréquente au-delà de la première année après la transplantation est également la dysfonction chronique de l’allogreffe chez les enfants, généralement sous la forme d’un syndrome de bronchiolite oblitérante (BOS) [10]. 5 ans après la transplantation, environ 50% des patients sont concernés [4]. Comparés à d’autres transplantations d’organes solides, les patients ayant subi une greffe de Lutx continuent d’avoir le plus mauvais pronostic. La survie médiane après Lutx de tous les patients pédiatriques signalés dans le registre ISHLT de 1992 à 2017 était de 5,7 ans et a augmenté à 6,4 ans dans les années plus récentes (2002-2009) [4]. Cela s’explique essentiellement par l’amélioration des possibilités de traitement périopératoire, avec une réduction de la mortalité précoce. Cependant, le pronostic varie parfois considérablement d’un centre à l’autre et semble dépendre en particulier de la taille et donc de l’expérience d’un programme de transplantation [11]. Avec 8 à 14 transplantations par an, la clinique pédiatrique de l’Université de médecine de Hanovre est l’un des plus grands centres de transplantation pulmonaire pédiatrique au monde (Fig. 3). Ici, la survie à 5 ans a augmenté au cours des dernières années, avec un nombre croissant de patients par an, passant de 41% (période de transplantation 1987-2008) à plus de 80% (période de transplantation 2014-2018) [1,12].
L’une des principales raisons de ce mauvais pronostic par rapport à d’autres greffes d’organes solides est probablement l’exposition nettement plus élevée des poumons à l’environnement, avec la stimulation constante du système immunitaire qui en résulte. Par exemple, les infections aiguës ou chroniques des voies respiratoires inférieures constituent un facteur de risque de rejet chronique du greffon après une transplantation pulmonaire.
Les faits mentionnés ci-dessus mettent en évidence la complexité, les difficultés et les contraintes extraordinaires d’un Lutx pour les enfants, les adolescents et leurs proches, et suggèrent l’impact qu’il a sur la vie d’un enfant en pleine croissance.
Aspects spécifiques aux nourrissons et aux jeunes enfants
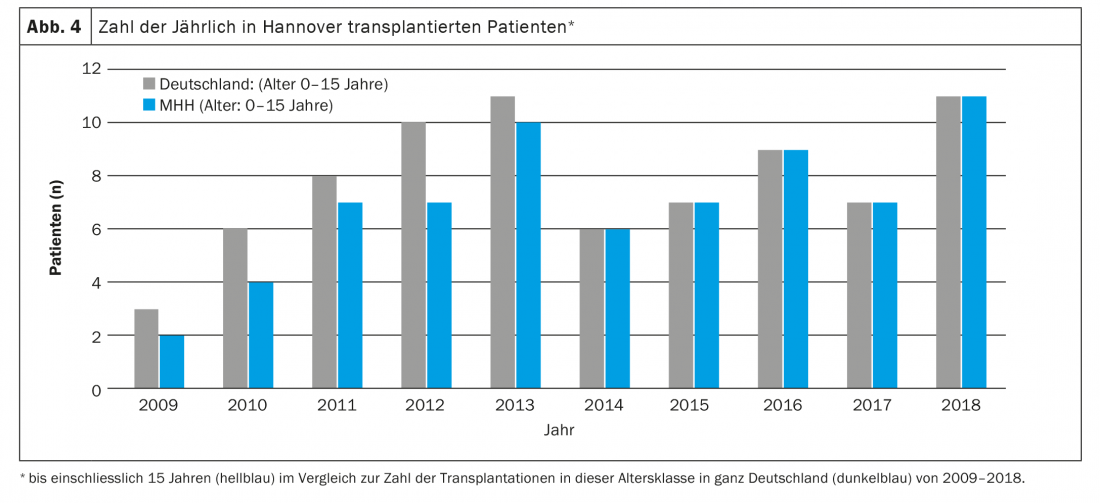
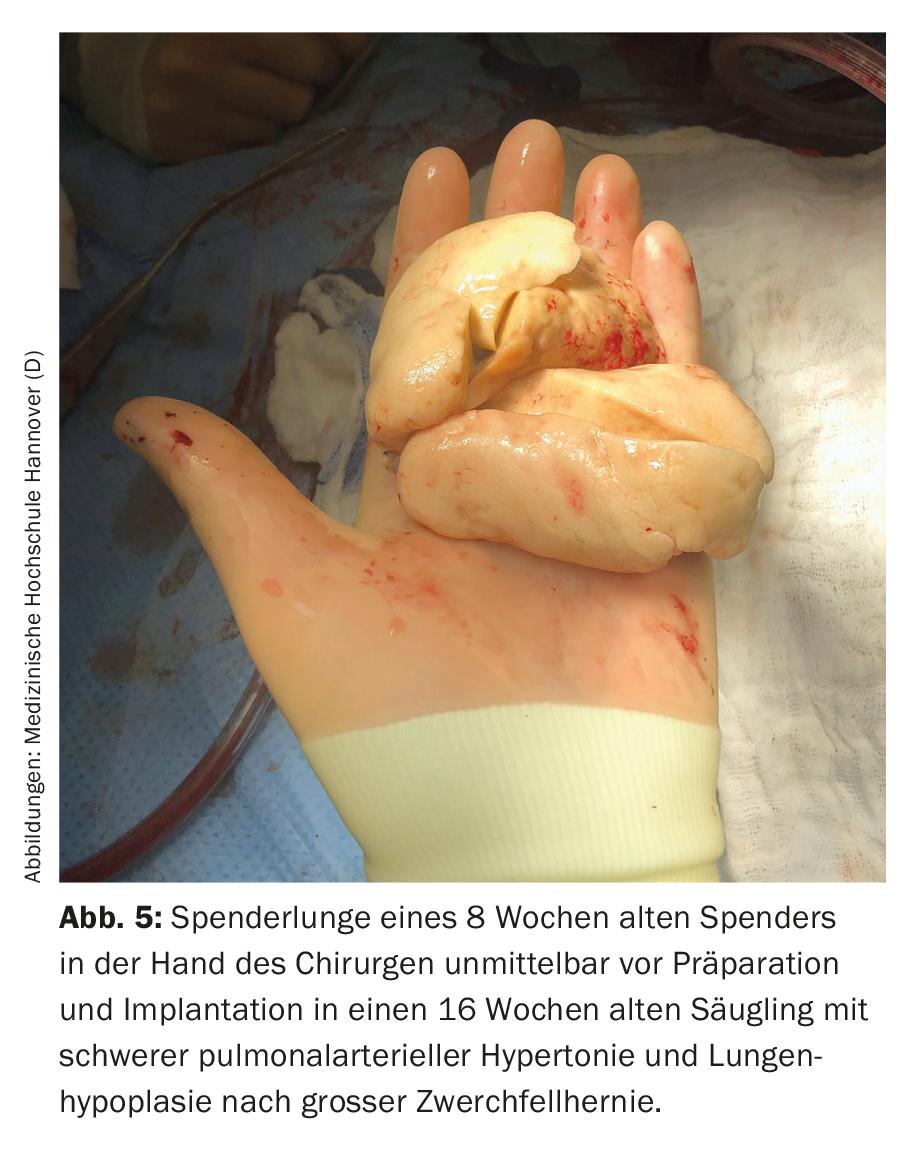
Les principales indications de transplantation pulmonaire dans ce groupe d’âge sont les maladies pulmonaires parenchymateuses diffuses et l’HTAP. Les parents et le personnel médical sont confrontés à des défis particuliers avant même la transplantation. Dans la plupart des cas, les enfants se trouvent dans un état où leur vie est gravement menacée, ils doivent souvent être placés sous respiration artificielle, il n’est pas rare qu’ils soient complètement immobilisés et ils doivent s’attendre à de longs délais d’attente (hospitaliers) en raison de la pénurie d’organes disponibles. Outre le stress psychologique des parents, la longue période d’attente est également associée à des problèmes organisationnels flagrants et est très éprouvante pour les éventuels frères et sœurs en bonne santé. En effet, il arrive souvent que l’un des parents, la mère dans la plupart des cas, ne soit pas présent à la maison pendant des semaines, voire des mois, car l’une des personnes doit s’occuper en priorité de l’enfant malade à l’hôpital, qui n’est presque jamais situé dans la ville d’origine de la famille. En Allemagne, par exemple, ces dernières années, presque tous les enfants de moins de 16 ans ont été transplantés à la Faculté de médecine de Hanovre et peu d’entre eux vivent en Basse-Saxe ou même à Hanovre (Fig. 4). Les conséquences qui en découlent sont probablement à peine imaginables pour nous, personnel médical. En raison de leur mauvais état avant la transplantation, de leur manque de réserves physiques, de leur jeune âge et des procédures chirurgicales (Fig. 5) et de soins intensifs qui en découlent, le risque de complications pré- et postopératoires est élevé. En raison de leur âge, les enfants sont souvent incapables d’articuler leurs souhaits et leurs craintes, même s’ils sont conscients. Les parents sont partagés entre la peur pour la vie de leur enfant et l’inquiétude que la transplantation ne soit pas atteinte ou que l’enfant décède après la transplantation et doive endurer un lourd calvaire en attendant. En raison du faible nombre total de patients transplantés à cet âge, il n’est pas possible de fournir des informations concrètes et fiables sur le pronostic. Le contact avec les enfants et leurs parents, ainsi que la conduite des entretiens, exigent donc un haut degré de sensibilité, d’empathie, d’honnêteté, de connaissance des personnes et surtout du temps.
Nous, les médecins, ne sommes pas préparés à de tels scénarios pendant nos études et avons donc impérativement besoin du soutien, entre autres, des psychologues, des psychothérapeutes et du personnel soignant. Un autre problème est le manque de temps dû à la pression financière croissante, au manque flagrant de personnel et à l’augmentation constante des tâches bureaucratiques du personnel médical. De plus, en Allemagne du moins, de plus en plus de postes non médicaux sont supprimés. Pourtant, les professions qui ne sont tout simplement pas “rentables” dans une société hospitalière axée sur la performance, comme les art-thérapeutes, les musicothérapeutes, les psychothérapeutes, les physiothérapeutes ou les clowns hospitaliers, sont à bien des égards beaucoup plus importantes pour les enfants et leurs parents que les médecins et contribuent de manière essentielle au bien-être des patients et donc au succès d’une transplantation. Un changement de mentalité de la part des institutions serait non seulement souhaitable, mais aussi, à mon avis, impératif. Malheureusement, les études contrôlées ne permettent pas de prouver l’efficacité du travail des groupes professionnels susmentionnés. Le calcul des besoins en personnel sur la base de données solides constitue donc un problème majeur de la “médecine fondée sur les preuves” et n’a pas de sens dans des domaines aussi marginaux que la médecine de transplantation pédiatrique. Souvent, les parents trouvent très utiles les discussions avec d’autres familles dont l’enfant a été transplanté à un âge similaire avec la même indication ou une indication similaire. C’est pourquoi nous proposons toujours, lors de la prise de décision, une mise en relation avec de telles familles. Mais la période post-transplantation représente également un défi particulier dans ce groupe d’âge. D’une part, la faible marge thérapeutique ainsi que les nombreux effets secondaires des immunosuppresseurs nécessitent des analyses sanguines rapprochées et contraignantes pour l’enfant. Au début, tous les jours, puis toutes les semaines et ensuite toutes les 4 semaines. L’examen le plus important pour détecter précocement un dysfonctionnement d’organe est la fonction pulmonaire mesurée quotidiennement (à domicile). Mais cela n’est pas encore possible chez les nourrissons et les jeunes enfants. D’autres examens de contrôle, tels que la fréquence respiratoire et la saturation en oxygène, sont ici les seules (mauvaises) alternatives. En raison du risque élevé d’infection, les enfants ne peuvent pas aller à l’école maternelle. Cela a à son tour des conséquences psychosociales importantes pour l’enfant et représente un fardeau pour la famille, en particulier si l’enfant est élevé par une personne seule.
Souvent, la protection vaccinale n’est pas encore complète au moment de la transplantation et la réponse vaccinale sous immunosuppression est nettement limitée. En outre, les vaccins vivants sont contre-indiqués chez les enfants après Lutx. Cela augmente à son tour le risque d’infection et nécessite des mesures préventives particulières. Les restrictions que nous subissons douloureusement dans le cadre de la pandémie de SRAS-CoV-2 ont toujours été et sont toujours vécues comme normales, en particulier pour les jeunes enfants selon Lutx. Souvent, les familles rencontrent des difficultés financières en raison des circonstances susmentionnées et ont donc besoin d’un soutien supplémentaire. Heureusement, nous avons pu montrer que la survie des jeunes enfants transplantés dans notre centre n’est pas moins bonne que celle des adolescents, et qu’elle a même tendance à être meilleure [1]. Outre une possible plasticité plus élevée du système immunitaire avec un taux de rejets aigus et chroniques plus faible (malgré une immunosuppression moindre), cela s’explique à mon avis essentiellement par une bien meilleure adhérence au traitement (les parents administrent encore eux-mêmes les médicaments à cet âge) par rapport aux adolescents. Le bon pronostic encourageant, avec un pourcentage de survie à 5 ans de plus de 80% [1], implique toutefois de nouveaux défis et obligations, à savoir prévenir autant que possible les lésions iatrogènes à long terme. C’est pourquoi la nécessité de chaque médicament, de chaque examen invasif et de chaque diagnostic par imagerie nécessitant une exposition aux radiations ou une sédation/anesthésie doit toujours faire l’objet d’un examen critique. En outre, des études contrôlées sur l’efficacité et la sécurité des médicaments utilisés chez les enfants transplantés pulmonaires seraient extrêmement importantes, mais elles ne sont malheureusement pas disponibles en raison du petit nombre de patients, du manque d’intérêt de la part de l’industrie pharmaceutique et du manque de financement public.
Aspects spécifiques aux enfants d’âge préscolaire et scolaire
Une grande partie de ce qui a été mentionné précédemment pour les nourrissons et les jeunes enfants s’applique également aux enfants d’âge préscolaire et scolaire et ne sera donc pas répété. Cependant, dans ce groupe d’âge, la mucoviscidose est l’indication la plus fréquente. Contrairement aux nourrissons et aux jeunes enfants, les enfants plus âgés sont rarement dans un état de danger de mort imminent au moment du référencement, ce qui permet de consacrer plus de temps aux entretiens et à une évaluation suffisante. En outre, les enfants peuvent presque toujours attendre un organe de donneur à la maison s’ils sont inscrits sur la liste. Il est toutefois important, à cet âge, d’impliquer activement les enfants dans les entretiens d’information, de répondre à leurs questions de manière suffisante et compréhensible et, en particulier, de prendre leurs souhaits et leurs craintes très au sérieux. Je sais par expérience que même les enfants plus jeunes sont beaucoup plus à l’aise avec les complications et les examens ou traitements désagréables après une transplantation pulmonaire s’ils y ont été suffisamment préparés avant la transplantation. Très souvent, dans le cadre des entretiens d’éducation sexuelle, j’ai le sentiment que les enfants ne peuvent ou ne veulent pas verbaliser leurs peurs et leurs inquiétudes et que, comme les adolescents, ils veulent être “forts” pour leurs parents. Il est donc d’autant plus important pour ces enfants de bénéficier, en plus des entretiens d’information, d’un accompagnement psychologique et d’une art-thérapie. Les couleurs, les formes et les images leur permettent souvent d’exprimer leurs pensées, leurs peurs, leurs attentes et leurs espoirs bien mieux qu’ils ne pourraient le faire avec des mots (figure 6). En outre, la thérapie par la peinture a manifestement un effet thérapeutique pertinent. En règle générale, les enfants peuvent aller à l’école 6 mois après la transplantation et ne sont guère limités dans leur vie quotidienne, hormis la prise régulière de médicaments et les contrôles de l’évolution.

Aspects spécifiques aux adolescents
Les patients adolescents peuvent déjà bien comprendre l’importance d’une transplantation pulmonaire, avec tous ses avantages et inconvénients potentiels, et devraient donc être les premiers interlocuteurs dans le cadre des entretiens d’information. Leur décision, pour ou contre une transplantation, est en premier lieu déterminante et doit donc être acceptée. Souvent, les jeunes ont déjà un long parcours de souffrance derrière eux et n’ont pas pu vivre une enfance insouciante comme leurs camarades en bonne santé. Pour cette raison, leurs attentes en matière de transplantation pulmonaire sont très élevées. Or, il n’est souvent pas possible de les satisfaire en totalité. Il est donc important ici de faire comprendre que si la transplantation représente une réelle chance de vivre plus longtemps et mieux, on n’est pas en bonne santé après et que la prise régulière des médicaments, la réalisation d’examens de contrôle quotidiens et l’évitement de comportements potentiellement nocifs pour la santé, comme la consommation excessive d’alcool ou le tabagisme, sont extrêmement importants et constituent donc une condition de base pour l’inscription sur la liste d’attente. Il faut informer les jeunes filles qu’elles ne doivent pas avoir d’enfants plus tard en raison des effets secondaires tératogènes potentiellement graves des immunosuppresseurs et assurer une consultation gynécologique détaillée sur la contraception.
D’après ce que je ressens, le suivi des adolescents après une transplantation pulmonaire est souvent beaucoup plus difficile que celui des enfants plus jeunes. Le problème principal, et à mon avis la cause de décès la plus fréquente dans ce groupe d’âge, est le manque d’adhésion au traitement. Parfois, les jeunes investissent plus de temps à “dissimuler” des mesures thérapeutiques et/ou des examens de contrôle non effectués qu’à les effectuer systématiquement. Intuitivement, cela déclenche régulièrement chez moi de la colère et de la frustration (Fig. 7). Mais en réagissant de la sorte, on n’aide pas les personnes concernées et on se facilite la tâche de manière inadéquate en transférant la responsabilité. Tous ceux d’entre nous qui ont des enfants de cet âge savent à quel point la période de l’adolescence est difficile, mais aussi importante. Elle se caractérise par des conflits d’identification, un désir d’autonomie et d’autodétermination et un rejet intérieur des conseils ou des injonctions des adultes. Les interdictions, les menaces et les commandements incitent plutôt à faire le contraire. Du moins, c’est ce qui s’est passé pour moi pendant cette période. A cela s’ajoutent également la pression sociale du groupe de pairs et le désir “d’appartenir”, même s’il s’agit de tester les limites et les interdits. La manière dont les jeunes gèrent cette situation dépend bien sûr aussi en grande partie du soutien et de l’intégrité de l’environnement social. Notre tâche est donc de bien communiquer sur ces sujets dans le cadre de l’éducation, d’établir une relation de confiance et, avec l’aide des parents, des psychologues et des travailleurs sociaux, d’identifier le plus tôt possible les points de conflit et de trouver des solutions individualisées d’égal à égal avec les jeunes patients.

Enfin, je voudrais aborder le sujet important de la transition. Les jeunes devraient être préparés de manière intensive à leur vie de patient “adulte” au plus tard à partir de l’âge de 16 ans. Les soins guidés bien intentionnés et la diminution des tâches et des responsabilités sont, à mon avis, des erreurs que nous, pédiatres, commettons encore trop souvent, en particulier avec les patients atteints de maladies chroniques. Nous devons être conscients que nous ne favorisons pas l’autonomie des patients. C’est pourquoi un programme de transition structuré est important pour l’évolution à long terme au-delà de l’âge de 18 ans.
Résumé
La transplantation pulmonaire offre aux enfants et aux adolescents, quel que soit leur âge, la possibilité de vivre plus longtemps et mieux. Mais elle s’accompagne également de complications et d’obligations à vie, très différentes d’une vie normale, qui exigent beaucoup des patients et de leurs familles. C’est pourquoi il est toujours indispensable de procéder à une évaluation détaillée, à une information approfondie, à l’identification sélective des candidats appropriés qui en résulte et à un suivi multidisciplinaire avant et après la transplantation. La prise en charge individualisée des patients requise à cet effet nécessite beaucoup de temps et de personnel. Le système de santé actuel n’en tient pas suffisamment compte. Pour améliorer la survie à long terme et la qualité de vie des enfants qui nous sont confiés, nous ne devrions pas nous lasser de lutter contre ce phénomène.
Messages Take-Home
- L’âge moyen au moment de la transplantation se situe entre 12 et 15 ans, la fibrose kystique (CF) représente l’indication la plus fréquente (environ 60%), suivie par l’hypertension artérielle pulmonaire (HTAP).
- Chaque phase de la vie avant et après la transplantation pulmonaire comporte des défis médicaux et psychosociaux particuliers, qui peuvent varier d’un individu à l’autre, mais dont il faut absolument tenir compte.
- Un suivi psychosocial étroit et individualisé des enfants transplantés et de leurs proches est extrêmement important.
- Le manque d’adhésion au traitement chez les adolescents ayant subi une transplantation pulmonaire est un facteur de risque majeur de rejet d’organe chronique.
- Les conséquences graves à long terme du traitement immunosuppresseur sont notamment l’insuffisance rénale sévère (environ 6%), le diabète sucré (environ 30%) et les tumeurs malignes (environ 10%). Les patients pédiatriques sont principalement atteints de lymphomes associés à l’EBV.
- L’une des principales raisons de ce mauvais pronostic par rapport à d’autres greffes d’organes solides est probablement l’exposition nettement plus élevée des poumons à l’environnement, avec la stimulation constante du système immunitaire qui en résulte.
Littérature :
- Iablonskii P, Carlens J, Mueller C, et al : Indications et résultats après transplantation pulmonaire chez les enfants de moins de 12 ans : une expérience de 16 ans dans un seul centre. J Heart Lung Transplant 2021 Oct 28.
- Schmid FA, Inci I, Burgi U, et al : Favorable outcome of children and adolescents undergoing lung transplantation at a European adult center in the new era. Pediatr Pulmonol 2016 ; 5(11) : 1222-1228.
- Khush KK, Cherikh WS, Chambers DC, et al : The International Thoracic Organ Transplant Registry of the International Society for Heart and Lung Transplantation : Thirty-sixth adult heart transplantation report – 2019 ; focus theme : Donor and recipient size match. J Heart Lung Transplant 2019 ; 38(10) : 1056-1066.
- Hayes D Jr AD, The International Society for Heart and Lung Transplantation – International Thoracic Organ Transplant Registry, Dallas,Texas, Harhay MO, et al : The International Thoracic Organ Transplant Registry of the International Society for Heart and Lung Transplantation : Twenty-fourth pediatric lung transplantation report – 2021 ; Focus on recipient characteristics. J Heart Lung Transplant 2021 ; 40(10) : 1023-1034.
- Leard LE, Holm AM, Valapour M, et al : Consensus document for the selection of lung transplant candidates : An update from the International Society for Heart and Lung Transplantation. J Heart Lung Transplant 2021 ; 40(11) : 1349-1379.
- Solomon M, Mallory GB.. : Lung transplant referrals for individuals with cystic fibrosis : A pediatric perspective on the cystic fibrosis foundation consensus guidelines. Pediatr Pulmonol 2021 ; 56(2) : 465-471.
- Huddleston CB : Transplantation pulmonaire pour l’hypertension pulmonaire chez les enfants. Pediatr Crit Care Med 2010 ; 11(2 Suppl) : S53-S56.
- Tudorache I, Sommer W, Kuhn C, et al : Transplantation pulmonaire pour hypertension pulmonaire sévère – oxygénation par membrane extracorporelle au repos pour le remodelage du ventricule gauche postopératoire. Transplantation 2015 ; 99(2) : 451-458.
- Goldfarb SB, Hayes DJ, Levvey BJ, et al : The International Thoracic Organ Transplant Registry of the International Society for Heart and Lung Transplantation : Twenty-first Pediatric Lung and HeartLung Transplantation Report-2018 ; Focus Theme : Multiorgan Transplantation. J Heart Lung Transplant 2018 ; 37(10) : 1196-1206.
- Verleden GM, Raghu G, Meyer KC, et al : A new classification system for chronic lung allograft dysfunction. J Heart Lung Transplant 2014 ; 33(2) : 127-133.
- Khan MS, Zhang W, Taylor RA, et al : Survival in pediatric lung transplantation : The effect of center volume and expertise. J Heart Lung Transplant 2015 ; 34(8) : 1073-1081.
- Gorler H, Struber M, Ballmann M, et al : Lung and heart-lung transplantation in children and adolescents : a long-term single-center experience. J Heart Lung Transplant 2009 ; 28(3) : 243-248.
InFo PNEUMOLOGIE & ALLERGOLOGIE 2022 ; 4(1) : 12-18