Dans le cas du mélanome malin, de nouvelles connaissances sur les facteurs pronostiques et les risques ont été publiées récemment. Les lignes directrices modifiées apportent quelques nouveautés au quotidien et visent à établir une distinction aussi précise que possible entre les mélanomes à haut risque et les mélanomes à faible risque. Les changements les plus importants concernent surtout les mélanomes minces, entre 0,75 et 1 mm, pour lesquels de nouveaux critères ont été créés. Mais l’avenir du diagnostic du mélanome impliquera sans aucun doute de travailler avec des marqueurs et des analyses de mutations du mélanome, qui sont déjà utilisés en routine pour le traitement des mélanomes métastatiques avancés.
Le taux d’incidence du mélanome est très élevé, en particulier dans la population jeune. De plus, les métastases apparaissent relativement tôt et aucun traitement n’a encore été trouvé. Le mélanome malin est la tumeur mortelle la plus fréquente chez les jeunes adultes, ce qui en fait la troisième cause de décès après les accidents et les suicides. A l’avenir, l’accent devrait donc être mis non seulement sur le traitement du mélanome, mais aussi sur la prévention et l’identification des groupes à risque qui méritent un examen et un dépistage réguliers.
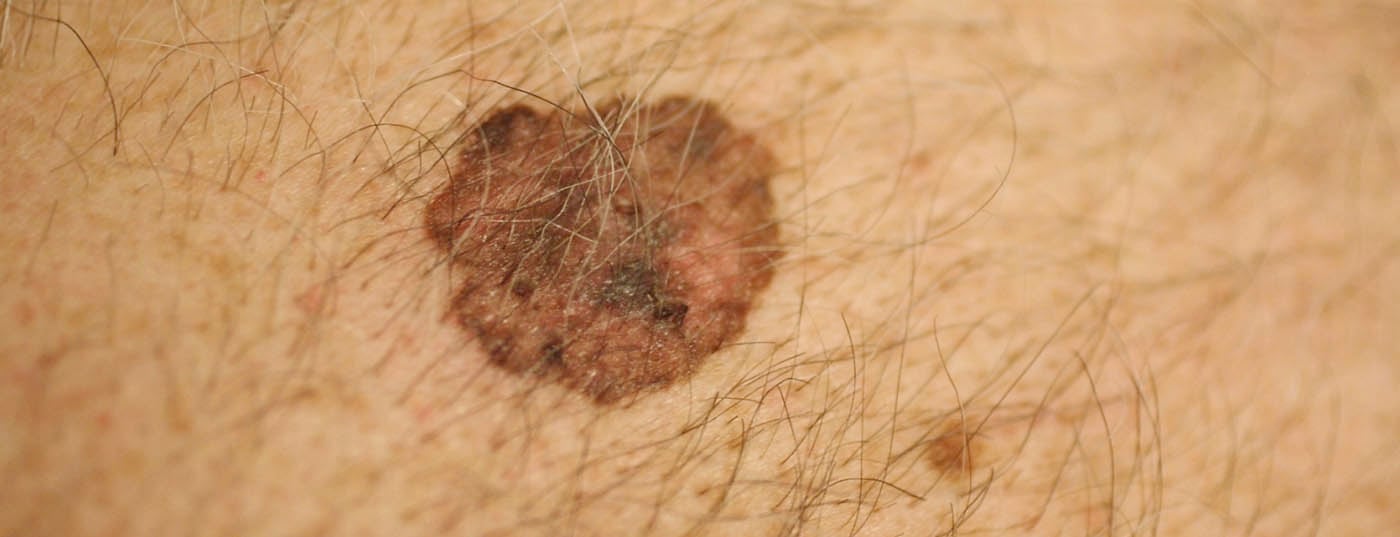
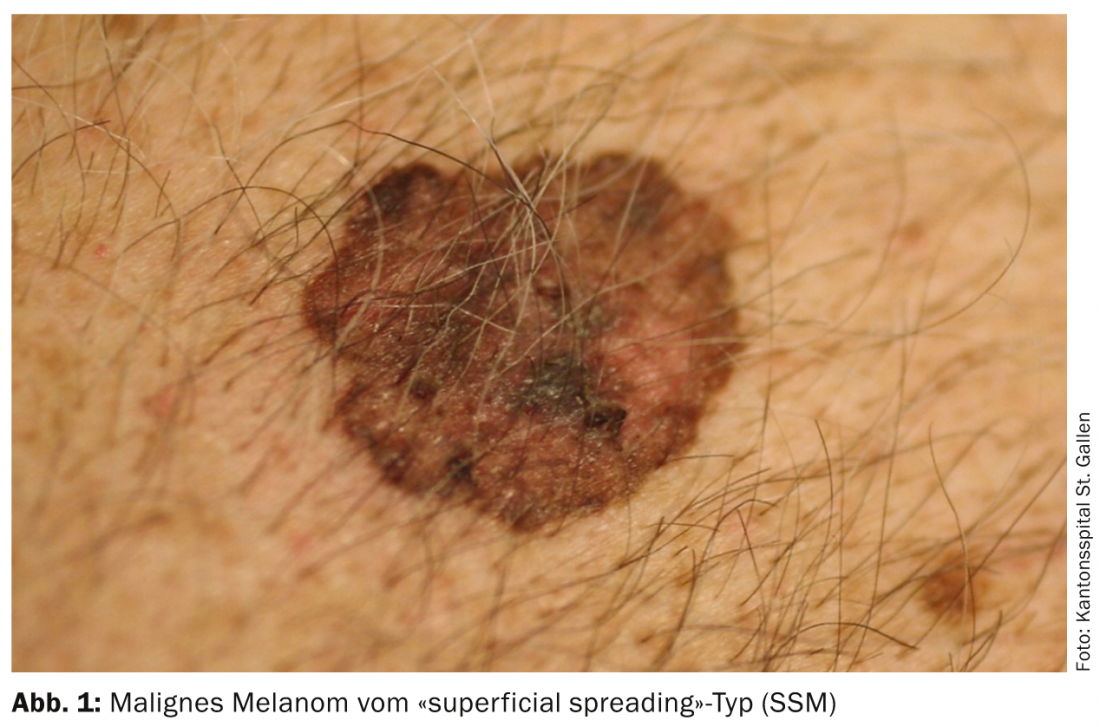
L’énorme augmentation des mélanomes est en grande partie liée à l’évolution des habitudes de loisirs. Ainsi, les peaux jeunes sont exposées plus tôt et plus intensément au soleil, notamment lors des vacances à la mer, dans les bandes de plage, les solariums, etc. Il en résulte notamment ce que l’on appelle des “mélanomes superficiaux étalés” (SSM) (ill.1) et les mélanomes nodulaires sur les parties du corps qui ne sont même pas exposées de manière cumulative à beaucoup de soleil, mais qui subissent une irradiation switch-on et switch-off du soleil. En outre, le mélange plus important d’ethnies dans les latitudes sud a également son importance, car les Caucasiens vivant près de l’équateur ont une incidence de mélanome nettement plus élevée, en particulier chez les personnes d’origine européenne centrale et septentrionale. Le taux d’incidence en Suisse est de plus de 220 personnes par million d’habitants et par an, le taux le plus élevé d’Europe.
Groupes à risque
Jusqu’à présent, les campagnes de prévention visaient davantage les peaux à risque, c’est-à-dire les peaux de type I et II, qui sont plus susceptibles de prendre des coups de soleil sans protection solaire suffisante. Cependant, les véritables patients à risque, qui figurent dans le tableau 1 , ont été plutôt négligés jusqu’à présent. C’est pourquoi les mesures de prévention concernant la protection solaire devraient être appliquées à tous, car il n’est pas possible de distinguer les personnes à faible risque de celles à risque élevé dans la population générale.

En particulier, le nombre de nævus dysplasiques, surtout dans la région glutéale, indique un risque de mélanome jusqu’à neuf fois plus élevé que dans la population normale. Les autres groupes à risque énumérés dans le tableau 1 ont également un risque de mélanome 2,3 à 18 fois plus élevé. Il est donc important de prendre en compte les patients (groupe 5 de la liste des patients) qui ne sont pas encore en bonne santé. Tab. 1), qui ont déjà été traités pour une autre tumeur doivent également être informés du risque de mélanome et être suivis régulièrement. Il est également important d’attirer l’attention sur un risque dès le plus jeune âge et certainement d’effectuer un examen physique complet y compris. de la région glutéale et génitale.
Les hommes courent un risque supplémentaire. Quelle que soit l’épaisseur du mélanome, ils ont un moins bon pronostic et une mortalité plus élevée. D’autres facteurs de risque se trouvent du côté de la génétique ; en particulier dans le cas des mélanomes familiaux, on postule des mutations héréditaires de deux gènes ayant un rôle critique dans le cycle cellulaire, à savoir CDKM2A et CDK4. Cependant, même dans ce cas, des facteurs déclencheurs supplémentaires tels que l’exposition au soleil et d’autres facteurs environnementaux jouent un rôle. De nombreux autres loci sont également impliqués et diffèrent selon le type de mélanome, qu’il s’agisse par exemple d’un mélanome lentigo-malin ou d’un mélanome uvéal.
Le mélanome lentigo-malin est en outre davantage associé à un âge avancé et à l’exposition solaire totale cumulée. Il se produit précisément sur le visage, le haut du dos et les membres supérieurs.
Une consommation d’aspirine de plus de cinq ans a été identifiée comme un facteur de protection faible, de même que la consommation de nicotine pour le mélanome malin du lentigo. L’utilisation d’inhibiteurs du TNF-α (produits biologiques) dans le traitement des maladies inflammatoires de l’intestin entraîne une augmentation de l’incidence du mélanome par rapport aux patients exempts de TNF-α. Ces patients ont un risque plus élevé de développer un mélanome que, par exemple, les membres de la famille de patients atteints de mélanome qui ne présentent pas de facteurs de risque supplémentaires.
Classification du mélanome et modifications
Jusqu’à présent, l’épaisseur du mélanome est le facteur pronostique le plus important et conduit aux décisions thérapeutiques. Cette approche, essentiellement chirurgicale, n’a pas beaucoup changé en ce qui concerne la ré-excision. La règle est toujours la même : en dessous de 1 mm d’épaisseur selon Breslow, on retaille 1 cm, au-delà de 2 mm d’épaisseur, on retaille 2 cm. Pour le mélanome in situ, on choisit une marge de sécurité de 0,5 cm.
Désormais, l’évaluation de l’indice mitotique est déterminante pour d’autres examens tels que l’ablation du ganglion sentinelle. Désormais, pour les mélanomes d’une épaisseur comprise entre 0,75 mm et 1 mm, le taux de mitose en millimètre carré est également pris en compte. Si elle est supérieure à 1, il faut également procéder à un examen du ganglion sentinelle, comme pour un mélanome plus épais de plus de 1 mm. Celle-ci n’a toutefois aucune influence sur la survie globale et l’absence de récidive, mais sert à détecter les micrométastases et donc à poser l’indication d’une lymphadénectomie. De plus, il est possible que dans de futures études, ces patients à risque avec micrométastases puissent également être traités de manière prospective et/ou adjuvante selon l’analyse mutationnelle du mélanome.
Il est toutefois important que la ré-excision soit effectuée dans un délai d’un mois, car cela a également une influence sur la survie globale du patient. L’exérèse primaire doit être réalisée de manière succincte, l’exérèse complémentaire éventuellement en même temps que le ganglion sentinelle, mais dans un délai d’un mois.
La nouvelle classification TNM (tableaux 2 et 3) prend ici en compte le taux de mitose, qui doit être évalué pour les mélanomes de moins de 1 mm d’épaisseur.

Un facteur supplémentaire important est l’ulcération, qui pourrait éventuellement indiquer un autre immunotype de défense tumorale et justifier un traitement adjuvant par interféron-α en cas de tumeur de stade IIb, c’est-à-dire supérieure à 2 mm Breslow avec ulcération.

Qui doit prendre en charge les patients à haut risque ?
Aujourd’hui, il est déjà certain qu’une formation dermatologique spécialisée de trois ans est décisive pour la détection d’un mélanome. De plus, les patients à haut risque devraient également se faire examiner au moins une fois par an, en incluant l’examen dermatoscopique. Il convient de réaliser des photographies du corps entier et des photos comparatives, voire d’utiliser des supports de stockage numériques tels que Molemax.
Un dépistage peut-il également être effectué par le médecin généraliste ?
Il ne fait aucun doute que la population à risque est trop importante pour être examinée dans son ensemble par des spécialistes, ce qui est pourtant recommandé. En fait, il est plus important que les personnes à risque, surtout les hommes d’âge moyen entre 40 et 60 ans, se rendent même au contrôle. Cela devrait être l’objectif premier de toute campagne sur le mélanome. En outre, il faudrait également développer et proposer davantage de formations pour les médecins généralistes concernant les normes de dermatoscopie. Un diplôme d’aptitude spécifique serait utile, y compris pour les non-dermatologues.
Diagnostic supplémentaire en cas de mélanome existant
Selon la ligne directrice S3 de l’ADO, un bilan d’extension initial est utile pour les mélanomes jusqu’au stade IIb, c’est-à-dire les mélanomes jusqu’à 4 mm avec ou sans ulcération, sans métastases ganglionnaires ou à distance, sont évalués selon le staging, y compris les métastases. biopsie du ganglion sentinelle chaque année et la protéine S-100 est analysée chaque année pendant cinq ans. Les examens cliniques sont effectués tous les six mois. En outre, les patients au stade Ib, c’est-à-dire les mélanomes de moins de 1 mm avec toutefois une ulcération et un taux de mitose plus élevé de ≥1/mm2, sont également candidats à une échographie annuelle et à la mesure de S-100 dans le sérum. L’IRM, le scanner, la radiographie thoracique, l’échographie abdominale et la scintigraphie du squelette ne sont pas recommandés dans le suivi de ces mélanomes jusqu’à 4 mm d’épaisseur.
Examen TEP-TDM : à partir de mélanomes de 4 mm d’épaisseur et dans des situations sélectionnées, ainsi que chez les patients très jeunes, un examen TEP-TDM peut être recommandé en tant que diagnostic primaire avant de procéder à la dissection ou à l’ablation du ganglion sentinelle. L’utilité d’une IRM supplémentaire de la tête est discutable si le PET-CT est négatif. En revanche, le PET-CT révèle toujours des métastases solitaires qui peuvent être abordées de manière curative (par exemple, récidive dans la cicatrice, les ganglions lymphatiques, métastase solitaire des tissus mous entre la tumeur primaire et la station ganglionnaire).
Ganglion lymphatique sentinelle : Pour tout mélanome de plus de 1 mm de diamètre (et dans des situations spéciales, même à 0,75 mm, tab. 4) , il est utile de rechercher et d’enlever sélectivement le ganglion sentinelle (si aucune accumulation n’est trouvée au PET-CT pour un mélanome de plus de 4 mm Breslow).

Le traitement des ganglions lymphatiques sentinelles est recommandé dans le guide S3 selon des protocoles nationaux ou internationaux. Il est utile ici de procéder à un traitement avec au moins huit coupes de tissus et de définir si des micrométastases (conglomérats de cellules de mélanome, indication en dixièmes de millimètres) ou des macrométastases sont présentes. Les facteurs supplémentaires auxquels il faut répondre sont la profondeur de pénétration des cellules de mélanome dans le parenchyme du ganglion lymphatique, l’infiltration de la capsule du ganglion lymphatique, sa percée et la lymphangiose. La signification des différentes indications concernant la charge tumorale n’est pas encore claire sur le plan pronostique, mais elles devraient être indiquées sur le plan histopathologique.
Recommandations en cas de métastases à partir du stade IIc (patients à haut risque de récidive) : Ces patients doivent subir une IRM de la tête, un PET-CT de tout le corps, une échographie des ganglions lymphatiques, le marqueur tumoral S-100 dans le sérum et le marqueur tumoral LDH. En cas de détection de métastases locorégionales, une échographie abdominale doit être réalisée, ainsi qu’une radiographie du thorax. Les patients présentant des micrométastases ou des macrométastases avérées doivent être présentés au tumorboard interdisciplinaire. Le consensus est qu’une lymphadénectomie élective n’est pas effectuée en premier lieu, sauf si des macrométastases ont été trouvées dans le ganglion sentinelle ou si des accumulations ont été observées au PET-CT. La lymphadénectomie prophylactique en présence de micrométastases doit être discutée au cas par cas. A ce moment-là, il est également nécessaire d’informer activement le patient et de lui fournir un entretien/un suivi détaillé. En outre, il détermine si les thérapies adjuvantes, par exemple, sont utiles ou non.
La radiothérapie adjuvante est recommandée après une lymphadénectomie, à condition que trois ganglions lymphatiques soient atteints, qu’il y ait eu une rupture capsulaire ou qu’il y ait une métastase ganglionnaire de plus de 3 cm. Dans le cas de toute métastase, il est également utile de faire analyser les prélèvements dans un institut de pathologie qui peut effectuer des analyses de génétique moléculaire. L’analyse de la mutation BRAF est particulièrement recommandée, ainsi que l’analyse de la mutation NRAS si elle est négative et, dans le cas des mélanomes des muqueuses, l’examen concernant c-Kit. Cela revêt une grande importance aujourd’hui, non seulement pour les études adjuvantes en cours, mais aussi pour le traitement ultérieur d’éventuelles métastases, contre lesquelles des médicaments ciblés peuvent être utilisés en cas de mutations.
Dr. med. Mark David Anliker
Littérature :
- Nikolaou V, Stratigos AJ : Tendances émergentes dans l’épidémiologie du mélanome. Br J Dermatol 2014 ; 170 : 11-19.
- Fong ZV, Tanabe KK : Comparaison des lignes directrices sur le mélanome aux États-Unis, au Canada, en Europe, en Australie et en Nouvelle-Zélande : une évaluation critique et une revue complète. Br J Dermatol 2014 ; 170 : 20-30.
- Vredenborg A, et al : Nævi mélanocytaires acquis dans l’enfance et le mélanome familial. JAMA Dermatol 2014 ; 150 : 35-40.
- Programme de lignes directrices en oncologie, ligne directrice S3, mélanome, version 1.0, janvier 2013.
CONCLUSION POUR LA PRATIQUE
- La nouvelle classification TNM ne distingue pas seulement selon l’épaisseur du mélanome, mais aussi selon le taux de mitose, qui influence fortement la procédure de staging et définit mieux le risque de métastases, même pour les mélanomes minces.
- Il appartient à chaque médecin d’orienter les patients à risque vers un dépistage régulier et d’attirer l’attention sur les mesures de prévention dès l’enfance.
- Les mélanomes minces nécessitent moins d’imagerie pour le diagnostic primaire, mais l’exérèse du ganglion sentinelle est déjà recommandée pour les mélanomes d’une épaisseur de 0,75 mm ou plus, lorsqu’il existe un taux de mitose plus élevé, ce qui pourrait être important en ce qui concerne le traitement adjuvant et les approches thérapeutiques futures impliquant par exemple l’inhibition de BRAF, de NRAS et l’inhibition de nouvelles cibles moléculaires.
- Des normes devraient être introduites pour les médecins généralistes et les dermatologues, éventuellement des cours avec des certificats d’aptitude à la dermatoscopie et à la détection du mélanome.
A RETENIR
- La nouvelle classification TNM fait la différence non seulement en fonction de l’épaisseur du mélanome, mais également en fonction du taux de mitoses qui a des répercussions importantes sur la classification et également définit mieux le risque de métastase dans le mélanome de faible épaisseur.
- Tout médecin se doit de proposer aux patients à risque des contrôles réguliers et de les informer des mesures de prévention dès l’enfance.
- L’imagerie est peu utilisée pour le diagnostic initial dans les mélanomes de faible épaisseur, cependant l’exérèse des ganglions sentinelles est recommandée dès l’épaisseur de 0,75 mm des mélanomes, en présence d’un taux de mitose élevé, ce qui peut être pertinent en ce qui concerne le traitement adjuvant et les futures approches thérapeutiques englobant par exemple l’inhibition de BRAF, NRAS et l’inhibition de nouvelles cibles thérapeutiques.
- Des normes doivent être définies pour les médecins généralistes et les dermatologues, au mieux également des enseignements avec attestation de capacité pour la dermatoscopie et la reconnaissance des mélanomes.
DERMATOLOGIE PRATIQUE 2014 ; 24(3) : 6-10