Les programmes de dépistage augmentent l’incidence des stades précoces du cancer du poumon. La chirurgie reste le premier choix thérapeutique. En cas de lymphadénectomie approfondie, la résection anatomique de segment constitue une alternative équivalente à la lobectomie.
Le cancer du poumon est le deuxième cancer le plus fréquent en Suisse avec une incidence de 11,9% chez les hommes et le troisième chez les femmes avec une incidence de 8,7%. La mortalité est la plus élevée chez les hommes (21,9%) et la deuxième plus élevée chez les femmes (15,4%), et la tendance est à la hausse [1]. Cela s’explique notamment par le fait que le premier diagnostic est souvent posé à un stade avancé et de mauvais pronostic. C’est pourquoi les programmes de dépistage ont été mis en avant.
L’I-ELCAP (International Early Lung Cancer Action Program), le programme international de dépistage du cancer du poumon, existe depuis 1992. En Suisse, le Programme national de dépistage du cancer du poumon fait partie de l’I-ELCAP et est mis en œuvre par la Fondation pour le diagnostic pulmonaire, créée en 2011 [2]. L’outil principal de ce programme de dépistage est la réalisation d’un scanner “à faible dose” chez les patients à risque ne présentant pas de symptômes tels que toux, hémoptysie, dyspnée, enrouement, dysphagie ou douleurs thoraciques. Il s’agit de tous les patients qui ont déjà eu un cancer du poumon et qui sont maintenant considérés comme guéris, de tous les fumeurs de plus de 50 ans et des ex-fumeurs ayant au moins 20 packyears (py). En outre, tous les patients de plus de 50 ans qui ont déjà souffert de tumeurs du nez et de la gorge ou qui ont été exposés à des substances cancérogènes (amiante, tabagisme passif, chrome, arsenic, etc.) ou qui ont au moins deux parents du premier degré atteints de cancer du poumon (tableau 1) [3].

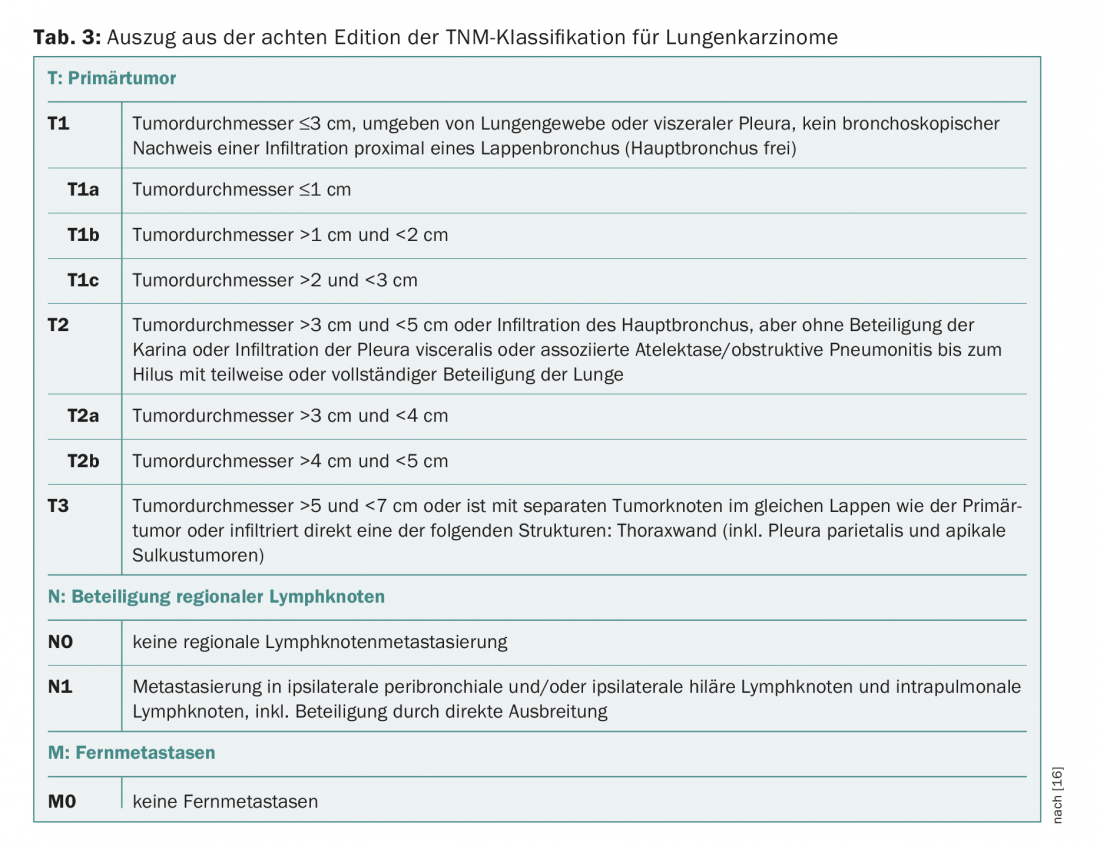
Si un cancer du poumon non à petites cellules (NSCLC) est suspecté dans le cadre de ce programme de dépistage, des examens complémentaires tels qu’une bronchoscopie avec EBUS et un PET-CT sont effectués. Les résultats obtenus sont utilisés pour la classification TNM (“tumor node metastasis”). Selon le stade TNM, le stade clinique est IA, IB, IIA, IIB, IIIA, IIIB ou IV, selon la huitième édition de l’AJCC.
Le présent article étant consacré au traitement des stades précoces du cancer du poumon, nous nous limiterons ci-après à un aperçu des stades IA, IB, IIA et IIB et de leur classification TNM correspondante (tab. 2 et 3).

Options thérapeutiques
Sur la base de cette classification, les étapes thérapeutiques suivantes peuvent être planifiées dans le cadre de la réunion de concertation pluridisciplinaire obligatoire. Pour les stades précoces I et II, il existe deux options thérapeutiques différentes : La chirurgie et la radiothérapie ou la non-chirurgie. Afin de trancher entre les deux, des examens tels que l’épreuve fonctionnelle respiratoire, l’ergométrie et, dans les cas critiques, la spiroergométrie combinée à la scintigraphie de perfusion sont réalisés pour évaluer l’état général du patient. Il est recommandé de suivre les directives de l’ESMO [4].
Radiothérapie
La radiothérapie est recommandée pour les patients qui ne sont pas éligibles aux options chirurgicales en raison de comorbidités ou d’une fonction pulmonaire réduite (VEMS postopératoire minimal <1 litres). Dans ce spectre thérapeutique, il existe la radiothérapie stéréotaxique (SBRT), la radiothérapie stéréotaxique par ablation (SABR) et l’ablation par radiofréquence (RFA).
La radiothérapie a certes gagné en précision et en exactitude ces dernières années grâce aux progrès techniques, mais elle présente un inconvénient majeur en plus de son profil d’effets secondaires bien connu : le traitement est uniquement basé sur la classification clinique sans confirmation patho-anatomique ou diagnostique. N’oubliez pas que le staging clinique est souvent incorrect et que le stade clinique ne correspond souvent pas au stade pathologique [5] : Dans 11 à 14% des cas, on trouve des ganglions lymphatiques occultes atteints qui ne sont pas détectés par la radiothérapie seule [6]. Sans résection chirurgicale et sans échantillonnage des ganglions lymphatiques ou lymphadénectomie radicale, ces patients ne bénéficient pas d’une prise en charge correcte et, par conséquent, d’une prise en charge thérapeutique insuffisante. C’est pourquoi la chirurgie reste le moyen de premier choix pour les patients atteints de NSCLC dont l’état général est opérable.
Chirurgie
En ce qui concerne les options chirurgicales, les lobectomies et les résections sous-lobaires (résection de segment anatomique et résection de Wedger) peuvent être envisagées (Fig. 1). En général, on choisit une approche peu invasive (VATS) ou ouverte (thoracotomie) en fonction de la localisation de la tumeur et des conditions peropératoires. Dans notre propre patientèle, une technique mini-invasive est choisie dans 70% des cas et offre ainsi éventuellement des possibilités thérapeutiques pour les patients dont l’état général est réduit.
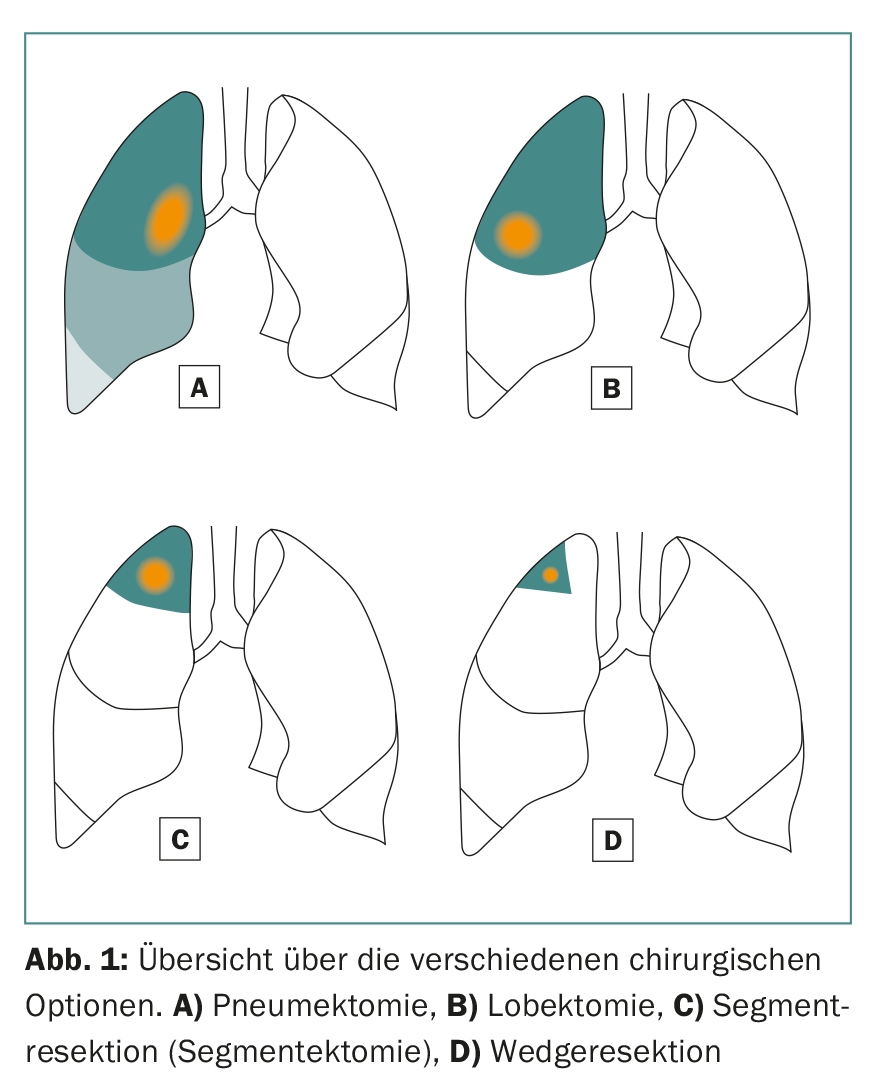
La lobectomie, comme son nom l’indique, consiste à retirer au moins un lobe entier du poumon droit ou gauche. Ceci est recommandé pour les tumeurs de plus de 3 cm. Cette procédure présente également un inconvénient majeur : elle entraîne la perte d’une grande quantité de tissu pulmonaire sain et vital.
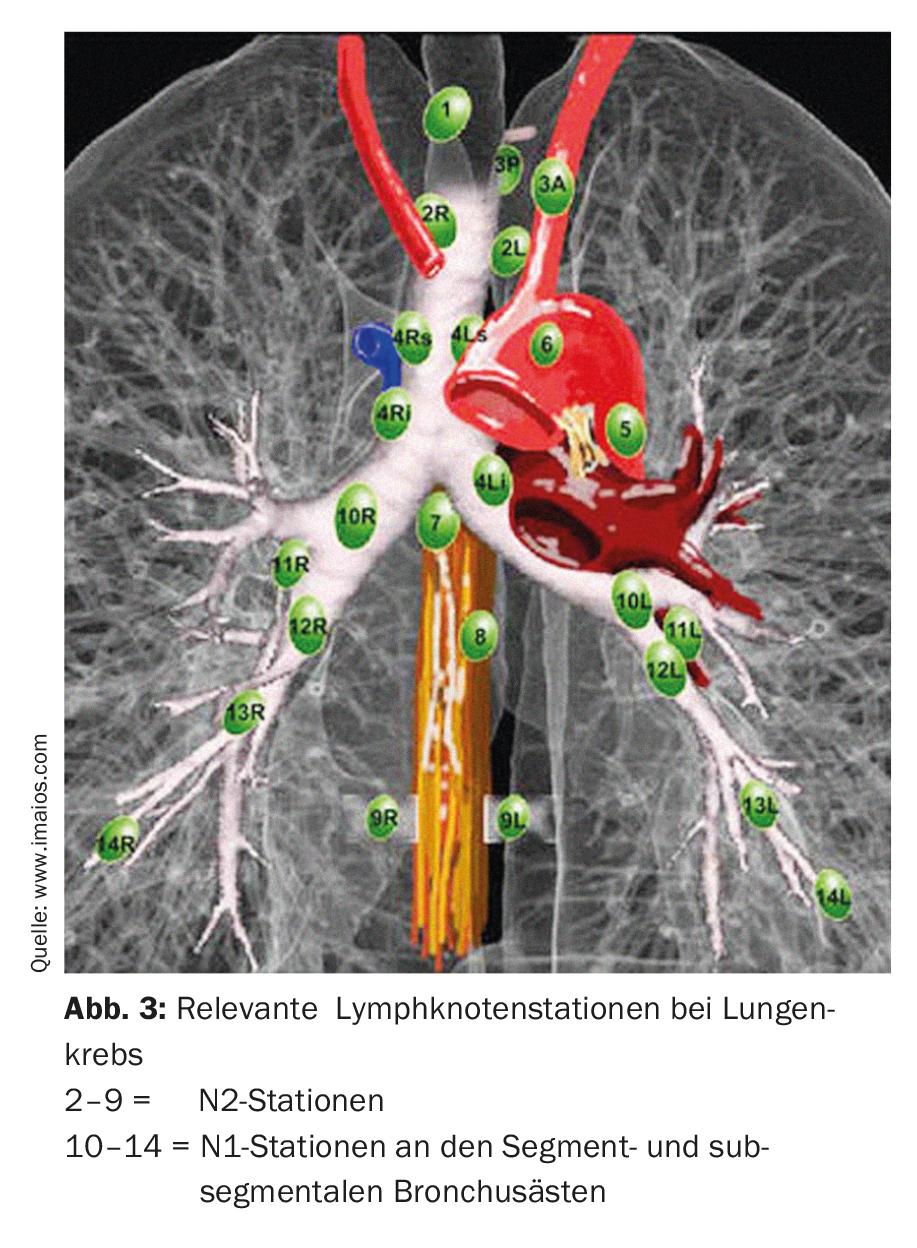
La résection segmentaire anatomique (segmentectomie) consiste à réséquer un seul ou jusqu’à trois segments (résection trisegmentaire) de lobes individuels, ce qui permet de conserver beaucoup plus de tissu pulmonaire vital qu’avec une lobectomie. Ceci est particulièrement important pour les patients dont la fonction pulmonaire est réduite ou pour d’éventuelles résections supplémentaires en cas de deuxième ou troisième cancer du poumon primaire [7]. Pour réussir une résection segmentaire anatomique, il est important pour le chirurgien de connaître les conditions anatomiques exactes, c’est-à-dire le poumon et sa division en dix ou neuf segments par poumon (Fig. 2).
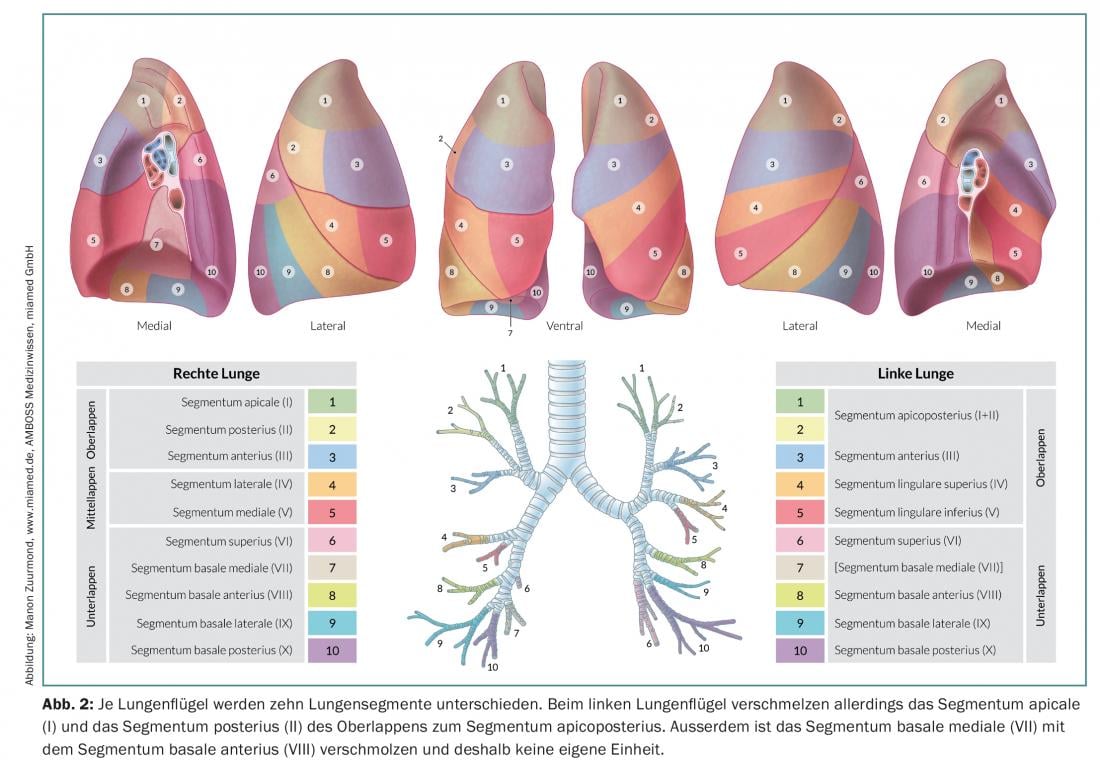
Selon la localisation et la taille de la tumeur, le choix se porte sur une segmentectomie ou une lobectomie. Dans tous les cas, il s’agit de confirmer le statut N0 par une dissection médiastinale approfondie des ganglions lymphatiques (du hile à la branche bronchique segmentaire et sous-segmentaire) avec une analyse extemporanée. Si une atteinte N1 ou N2 est détectée en peropératoire, le traitement chirurgical doit être immédiatement modifié et une lobectomie de complétion avec lymphadénectomie radicale doit être réalisée. Il faut également tenir compte de l’âge et de l’état général du patient. En outre, le chirurgien doit connaître les facteurs pronostiques pour le traitement chirurgical du NSCLC. Dans l’état actuel des connaissances, les facteurs suivants sont des facteurs pronostiques indépendants (pondérés par leur importance) [8] :
- Nombre de stations de ganglions lymphatiques atteintes
- Grading et différenciation histologique
- Invasion de la lymphangie dans l’histologie définitive
- Nombre total de ganglions lymphatiques atteints
- Réponse au traitement néoadjuvant
- Sexe et âge du patient
- taille de la tumeur.
Si un patient a subi une résection segmentaire et qu’il s’avère en postopératoire qu’un grand nombre des facteurs de risque pronostiques mentionnés précédemment sont présents, une lobectomie de complément dans le sens d’une deuxième intervention est nécessaire et une chimiothérapie additive doit être discutée en tumorboard.
Comparaison lobectomie vs segmentectomie et lymphadénectomie
Par le passé, la question de savoir si la résection segmentaire anatomique pouvait remplacer la lobectomie en tant que gold standard pour le traitement des carcinomes de stade IA a été discutée à plusieurs reprises. Le plus grand avantage de la segmentectomie anatomique est la possibilité de réséquer la tumeur tout en préservant la réserve fonctionnelle du patient, ce qui pourrait aussi et surtout supplanter les options non chirurgicales comme traitement du cancer du poumon chez les patients ayant une faible fonction pulmonaire. Des études antérieures ont montré des taux de survie inférieurs en cas de résection sublobaire par rapport à la lobectomie [9]. Il convient toutefois de noter que ces études ont regroupé les résections non anatomiques et anatomiques et que la collecte des données remonte à 25 ans.
Des études antérieures ont montré qu’un avantage de survie est associé à un nombre croissant de ganglions lymphatiques réséqués : Ludwig et al. ont montré que le bénéfice en termes de survie atteignait son maximum à 13-16 ganglions lymphatiques réséqués et Gulack et al. ont trouvé des résultats similaires (onze ganglions lymphatiques réséqués) [10,11].
Un travail récent de Stiles et al. a étudié le rôle de la lymphadénectomie dans les CBNPC de stade IA et a montré un avantage significatif en termes de survie à long terme et d’absence de récidive locale chez les patients ayant subi une résection sous-lobaire (segmentectomie ou wedgeresectomie) et une lymphadénectomie par rapport à une résection sous-lobaire sans lymphadénectomie [12].
Par conséquent, si l’on opte pour une résection sublobaire, une lymphadénectomie systématique est essentielle pour les résultats postopératoires et la survie à long terme.
Radiothérapie vs. chirurgie
La radiothérapie peut être considérée comme une procédure de choix dans les cas de cancer du poumon de stade I et II chez les patients qui ne sont pas éligibles à une résection chirurgicale en raison de comorbidités ou d’une fonction pulmonaire réduite.
L’inconvénient majeur de la radiothérapie est l’absence de diagnostic histologique et de lymphadénectomie de staging avant la décision thérapeutique. Cela peut être fatal pour l’avenir de la santé du patient, car le stade clinique et le stade pathologique divergent, comme l’a montré une étude de près de 3000 patients réalisée par López-Encuentra et al. a montré. Là, la concordance n’était que de 47% [5]. Les ganglions lymphatiques occultes ne sont pas détectés lors de l’ablation stéréotaxique, bien qu’ils soient présents dans 11 à 14% des cas, comme indiqué précédemment [6]. Cela a pour conséquence d’attribuer un TNM erroné et finalement un stade clinique erroné.
D’autre part, presque tous les stades précoces sont aujourd’hui traités chirurgicalement par des méthodes mini-invasives (avec thoracoscopie et/ou procédures assistées par robot). Une histologie est toujours obtenue, une résection anatomique du segment et une lymphadénectomie N1/N2 sont systématiquement réalisées. De plus, un diagnostic peropératoire rapide (tumeur primaire et ganglions lymphatiques) permet d’adapter – si nécessaire – la stratégie thérapeutique optimale au cours de la même anesthésie (extension de la résection en cas d’atteinte ganglionnaire). De même, tous les facteurs importants et déterminants pour le pronostic seront disponibles pour la procédure postopératoire et la présentation à la réunion de concertation postopératoire, ce qui n’est pas le cas avec les procédures de radio-abrasion stéréotaxique.
Procédure postopératoire
Si l’histologie définitive révèle T1a/b/c N0 M0 ou T2a N0 M0 et, en conséquence, un stade IA ou IB, aucun autre traitement adjuvant n’est recommandé. Des examens physiques et des tomodensitogrammes “à faible dose” sont prévus à des intervalles de six mois au cours des deux premières années postopératoires à titre de suivi. Par la suite, les contrôles sont effectués chaque année. A partir du stade II, les possibilités de traitement adjuvant doivent être discutées dans le cadre d’une réunion de concertation tumorale interdisciplinaire [13].
Thérapies adjuvantes
Les traitements à base de cisplatine se sont révélés être des adjuvants efficaces en termes de survie à long terme au stade II dans trois études cliniques. Ces avantages n’ont pas été démontrés pour les patients de stade I, au contraire, la chimiothérapie adjuvante s’est avérée plutôt nocive dans ce cas [14].
Les nouvelles thérapies systémiques, telles que les thérapies anticancéreuses ciblées avec des anticorps monoclonaux, ne sont pas encore établies en dehors des essais cliniques. Actuellement, quelques essais cliniques randomisés évaluent le rôle des thérapies ciblant l’EGFR ou l’ALK dans le cadre d’un traitement adjuvant pour les patients EGFR ou ALK positifs. Jusqu’à présent, il existe des preuves que les patients présentant des mutations EGFR ont une survie sans récidive plus longue sous erlotinib. Il n’est toutefois pas encore clair si cela augmente également la survie à long terme ou si cela prolonge seulement le temps avant la récidive.
La radiothérapie postopératoire n’est recommandée que dans les cas où la chirurgie n’a pas permis d’obtenir une situation R0 [15].
Résumé
Dans le cadre du dépistage, de plus en plus de cancers du poumon ont été diagnostiqués à un stade précoce au cours des dernières années. En fonction du stade clinique et de l’état général du patient, la décision thérapeutique entre radiothérapie et chirurgie doit être mûrement réfléchie. La chirurgie reste le traitement de première intention des stades précoces du NSCLC. Dans ce domaine, avec l’expérience et l’expertise croissantes, la résection segmentaire anatomique avec lymphadénectomie complète prend une place de plus en plus importante en raison de sa précision anatomique et de la préservation de la réserve fonctionnelle du patient. Elle constitue une alternative équivalente à la lobectomie et un meilleur traitement par rapport à la radiothérapie, à condition que la lymphadénectomie soit suffisamment approfondie.
Messages Take-Home
- Les programmes de dépistage augmentent l’incidence des stades précoces du cancer du poumon. La mortalité peut ainsi être réduite de manière significative.
- Le taux de survie à 5 ans pourrait passer d’environ 17% actuellement (tous les stades du cancer du poumon) à plus de 50%.
- La chirurgie reste le premier choix pour le traitement des stades précoces du cancer du poumon, à condition que le chirurgien soit compétent.
- près des trois quarts des interventions peuvent être réalisées à l’aide des techniques mini-invasives les plus modernes.
- En raison de la préservation des tissus pulmonaires vitaux, la résection segmentaire anatomique est parfaitement adaptée à la résection chez les patients dont la fonction pulmonaire est réduite.
- Si la lymphadénectomie est suffisamment approfondie, la résection anatomique de segment constitue une alternative équivalente à la lobectomie.
- La radiothérapie stéréotaxique et les autres procédures ablatives sont des procédures de second choix en raison de l’absence habituelle de diagnostic patho-anatomique.
Littérature :
- Ligue contre le cancer : Le cancer en Suisse : chiffres clés. 2016. www.krebsliga.ch/ueber-krebs/zahlen-fakten/-dl-/fileadmin/downloads/sheets/zahlen-krebs-in-der-schweiz.pdf.
- I-ELCAP : Fondation pour le diagnostic pulmonaire. %C3%diagnostic.
- Fondation pour le diagnostic pulmonaire : questions fréquentes. www.lungendiagnostik.ch/index.php/haufige_fragen.html.
- Vansteenkiste J, et al : 2nd ESMO Consensus Conference on Lung Cancer : early-stage non-small-cell lung cancer consensus on diagnosis, treatment and follow-up. Ann Oncol 2014 ; 25(8) : 1462-1474.
- López-Encuentra A, et al. : Comparaison entre le staging clinique et pathologique dans 2,994 cas de cancer du poumon. Ann Thorac Surg 2005 ; 79(3) : 974-979.
- Stiles BM, et al : Point : Clinical stage IA non-small cell lung cancer determined by computed tomography and positron emission tomography is frequently not pathologic IA non-small cell lung cancer : the problem of understaging. J Thorac Cardiovasc Surg 2009 ; 137(1) : 13-19.
- Hattori A, et al : Résultats oncologiques de la résection sublobaire pour les patients atteints de cancer du poumon non à petites cellules à haut risque au stade clinique IA avec une apparence radiologiquement solide sur la tomographie informatisée. Gen Thorac Cardiovasc Surg 2016 ; 64(1) : 18-24.
- Schöb O : Traitement chirurgical du cancer du poumon. La stadification, l’opérabilité et les facteurs pronostiques déterminent l’indication. InFo ONKOLOGIE & HÄMATOLOGIE 2015 ; 3(1) : 13-17.
- Ginsberg RJ, et al : Essai randomisé de lobectomie versus résection limitée pour le cancer du poumon T1 N0 non à petites cellules. Ann Thorac Surg 1995 ; 60(3) : 615-622.
- Ludwig MS, et al : La survie postopératoire et le nombre de ganglions lymphatiques prélevés lors de la résection d’un cancer du poumon non à petites cellules à ganglion négatif. Chest 2005 Sep ; 128(3) : 1545-1550.
- Gulack BC, et al : The Impact of Tumor Size on the Association of the Extent of Lymph Node Resection and Survival in Clinical Stage I Non-Small Cell Lung Cancer. Lung Cancer 2015 ; 90(3) : 554-560.
- Stiles BM, et al : The importance of lymph node dissection accompanying wedge resection for clinical stage IA lung cancer†. Eur J Cardiothorac Surg 2017 ; 51(3) : 511-517.
- Pas d’auteurs listés : Chemotherapy in non-small cell lung cancer : a meta-analysis using updated data on individual patients from 52 randomised clinical trials. Groupe de collaboration sur le cancer du poumon non à petites cellules. BMJ 1995 ; 311(7010) : 899-909.
- Pignon JP, et al : Lung adjuvant cisplatin evaluation : a pooled analysis by the LACE Collaborative Group. J Clin Oncol 2008 ; 26(21) : 3552-3559.
- Wang EH, et al : La radiothérapie postopératoire est associée à une amélioration de la survie globale dans les cancers du poumon non à petites cellules de stade II et III incomplètement réséqués. J Clin Oncol 2015 ; 33(25) : 2727-2734.
- Thomas KW, Gould MK : Système de stagnation des tumeurs, des nodules et des métastases (TNM) pour le cancer du poumon non à petites cellules. UpToDate 2017 Jan 16.
InFo ONKOLOGIE & HÉMATOLOGIE 2017 ; 5(3) : 8-12