Les inhibiteurs de points de contrôle immunitaires sont de plus en plus utilisés en oncologie, avec parfois des succès retentissants. Cependant, l’activation du système immunitaire déclenche également un large éventail d’effets secondaires. Des effets secondaires neurologiques sont également observés – bien que rares, ils sont alors potentiellement graves. Une bonne gestion est alors nécessaire.
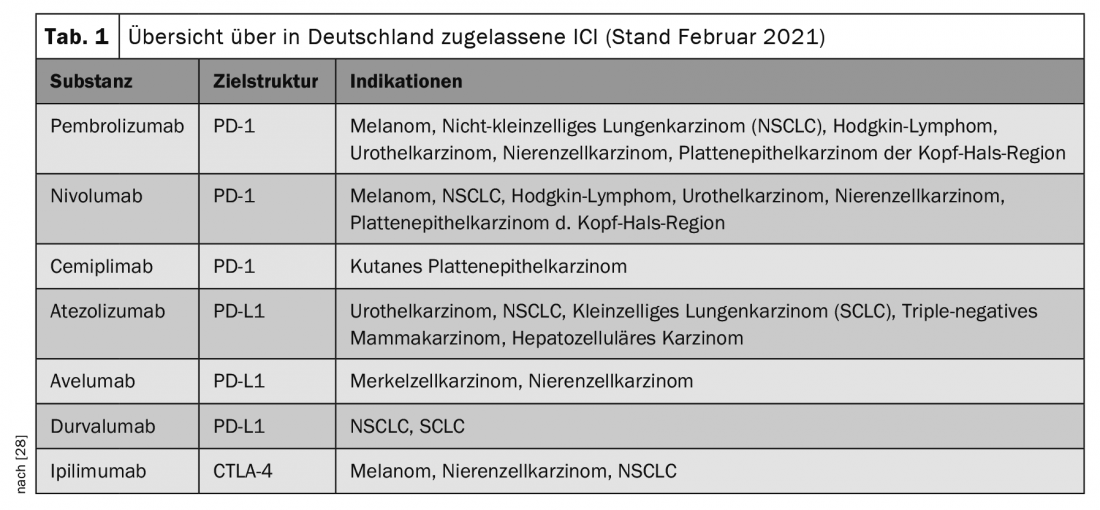
Ces dernières années, les inhibiteurs de points de contrôle immunitaires (ICI) ont été de plus en plus utilisés dans le traitement oncologique et ont permis une percée dans le traitement de différentes tumeurs malignes, avec parfois des rémissions de longue durée ou permanentes. Les indications sont constamment élargies et de nouvelles substances sont autorisées, de sorte que les ICI sont utilisés dans le traitement d’un nombre croissant de types de tumeurs (tableau 1).
Les ICI sont des anticorps spécifiques dirigés contre des points de contrôle immunitaires. Des exemples de telles molécules de checkpoint sont le récepteur de mort cellulaire programmée 1 (PD-1), le ligand du PD-1 (PD-L1) ou l’antigène cytotoxique T-lymphocyte 4 (CTLA-4) [1].
Dans des conditions physiologiques, les points de contrôle immunitaires dans la maturation des cellules T et B occupent une position clé pour l’autotolérance et la modulation du système immunitaire. Ainsi, CTLA-4 a surtout une fonction inhibitrice dans l’amorçage des cellules T, tandis que PD-1 et PD-L1, en tant que couple récepteur/ligand, jouent un rôle inhibiteur dans la phase effectrice, c’est-à-dire lors de l’attaque de la cellule tumorale par la cellule T ayant déjà un récepteur de cellule T spécifique [2]. Les cellules tumorales utilisent ces molécules de contrôle pour l’invasion immunitaire en inhibant, par leur activation, le système immunitaire de l’organisme dirigé contre elles. Par exemple, de nombreuses cellules tumorales expriment PD-L1 et peuvent, par ce mécanisme, inhiber les cellules T spécifiques dirigées contre les cellules tumorales en se liant à leur récepteur PD-1 et échapper à la destruction par le système immunitaire de l’organisme. Cette invasion immunitaire doit être empêchée en bloquant les récepteurs susmentionnés avec l’ICI et en favorisant ainsi la réaction immunitaire anti-tumorale.
Des recherches sont en cours sur les combinaisons de chimiothérapie conventionnelle, d’inhibiteurs de tyrosine kinase, de radiothérapie et d’ICI, ainsi que sur d’autres points de contrôle en tant que structures cibles ou sur la combinaison de différents ICI. Des études ont mis en évidence un effet synergique de la radiothérapie locale suivie de l’administration systémique d’ICI. On suppose que le tissu tumoral désintégré par la radiothérapie, avec les antigènes libérés et les néo-antigènes spécifiques de la tumeur, favorise l’amorçage des cellules T et peut ainsi provoquer une réaction antitumorale plus forte au niveau systémique [2].
Il n’est toutefois pas surprenant que l’activation du système immunitaire par l’ICI puisse déclencher un large éventail d’événements indésirables liés à l’immunité (irAE) ou déclencher des maladies auto-immunes et paranéoplasiques existantes en tant qu’effets secondaires. Selon le point de contrôle inhibé, des irAE ont été observés dans 70 à 90% des cas, la plupart d’entre eux étant de gravité légère (grade 1 ou 2 selon les CTCAE (Common Terminology Criteria for Adverse Events)) [1]. Les organes les plus fréquemment touchés par l’irAE sont les intestins, la peau, les poumons, le foie et les organes endocriniens. En revanche, les irAE neurologiques (nirAE), qui peuvent affecter le système nerveux central et périphérique, la plaque terminale neuromusculaire et les muscles, sont rares [3]. En raison de l’utilisation croissante des ICI, les connaissances sur les nirAE ne cessent d’augmenter, même si la plupart des preuves ont jusqu’à présent été générées principalement par des rapports de cas, des séries de cas rétrospectives et des méta-analyses ; les grandes études prospectives sur les effets secondaires font jusqu’à présent défaut. Par conséquent, les fréquences indiquées pour nirAE varient considérablement. Des nirAE de grade 1-2 ont été observés chez 6 à 12% des patients traités, des nirAE graves de grade 3-4 chez 0,1 à 1% des patients traités [4]. Une maladie auto-immune préexistante ne semble pas entraîner un risque nettement accru de développer de nouvelles irAE sous traitement par ICI [5]. Toutefois, cette question est controversée en raison du nombre encore très limité de données disponibles. Les irAE sous traitement ICI apparaissent en moyenne dans les 12 semaines suivant le début du traitement ICI [6]. Cependant, dans certains cas, la durée peut varier considérablement, de quelques jours après la première administration d’ICI à plus d’un an après le début du traitement, voire même après l’arrêt de l’administration d’ICI.
Il va de soi que les autres diagnostics neurologiques différentiels doivent être exclus par des moyens diagnostiques appropriés. Les éventuels nirAE doivent être identifiés et traités rapidement car, bien que rares, ils sont parfois associés à une morbidité et une mortalité élevées [7,8].
Il s’agit ici de donner un aperçu des nirAE actuellement connus. Les maladies associées à l’ICI imitent parfois des pathologies neurologiques bien connues, mais apparaissent dans des combinaisons inhabituelles ou constituent un nouveau type de phénomène. Cependant, la gravité, la prise en charge thérapeutique et l’évolution diffèrent considérablement des pathologies neurologiques classiques.
Système nerveux périphérique
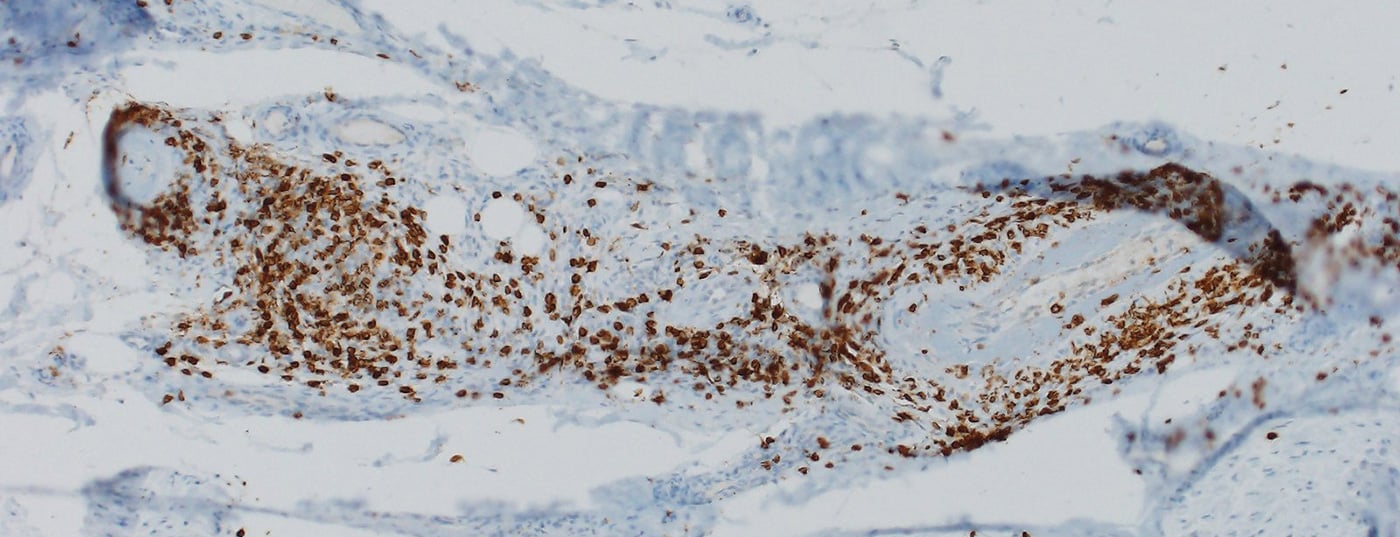
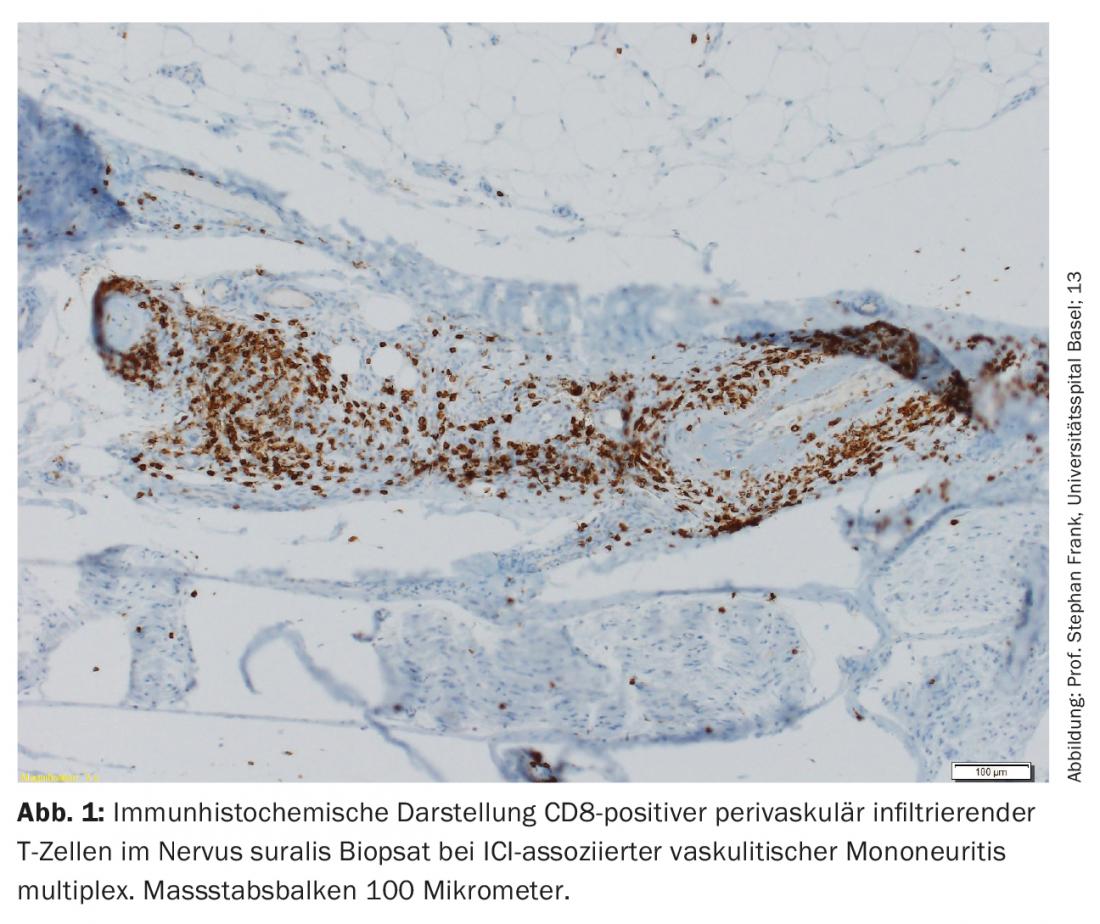
La majorité des nirAE concerne le système nerveux périphérique [9]. Des polyneuropathies ont été observées chez environ 3% des patients traités par ICI. Les neuropathies associées à l’ICI peuvent être à la fois axonales et démyélinisantes et avoir différents schémas de distribution, y compris la mononeuropathie, la mononévrite multiplex, la polyneuropathie symétrique, la neuropathie des petites fibres, la neuropathie autonome, l’amyotrophie névralgique, la méningoradiculite et l’implication des nerfs crâniens [10,11]. Des polyneuropathies périphériques d’origine vasculaire et des mononévrites multiplexes p-ANCA-positives ont également été décrites (figure 1) [12,13]. Selon la gravité, il faut envisager une pause de l’ICI, l’administration de stéroïdes et/ou une séparation du plasma (pour éliminer les anticorps encore actifs sur le plan thérapeutique). Cependant, les symptômes sont souvent légers et le traitement de l’ICI peut être poursuivi en fonction du contexte global [9,10]. La réponse des neuropathies associées à l’ICI aux stéroïdes est bonne.
Le paradigme est une polyneuropathie inflammatoire démyélinisante aiguë (PIDA), dont le LCR présente moins l’image classique d’une dissociation cytalbumine avec un taux élevé de protéines et un faible nombre de cellules, mais qui se caractérise par une pléocytose légère (jusqu’à 15 cellules/μl) en plus de l’augmentation des protéines [9]. L’évolution chronique (CIDP) est rare. En cas d’AIDP (Guillain-Barré-like Syndrome), compte tenu de la menace potentielle pour la vie, l’administration d’ICI doit être arrêtée définitivement et une administration de stéroïdes à haute dose doit être commencée en combinaison avec des immunoglobulines intraveineuses (IVIG) ou une plasmaphérèse [14].
Des myosites douloureuses, dont le principal symptôme est une parésie avec accentuation du tronc, ont également été décrites, en particulier sous traitement anti-PD-1 [15]. Elles sont parfois isolées, mais souvent associées à un syndrome myasthénique ou à une maladie de type AIDP. Une myocardite concomitante est fréquente et doit toujours être prise en compte, car elle a une mortalité élevée (environ 1/3 des cas) [16]. On connaît aussi bien la dermatomyosite, la polymyosite que les myosites aiguës nécrosantes avec un phénotype histopathologique caractéristique [9]. Des anticorps spécifiques paranéoplasiques ou auto-immuns n’ont pas été détectés à ce jour. Dans la plupart des cas, l’arrêt de l’ICI et l’immunosuppression ont entraîné une amélioration des symptômes.
Une myasthénie grave a été diagnostiquée chez environ 0,1 à 0,2% des patients sous traitement par ICI, avec des anticorps anti-AChR positifs dans 60% des cas [17]. Le plus souvent, les régions oculaires et bulbaires étaient principalement touchées, suivies par les extrémités proximales. Dans une grande partie des cas, la créatine kinase (CK) était élevée, signe d’une myosite (cardiaque) concomitante [15]. L’évolution était souvent grave avec une mortalité élevée. En conséquence, il est recommandé d’arrêter définitivement l’ICI et de suivre un traitement immunosuppresseur. Contrairement à la myasthénie grave classique, l’utilisation précoce (bien surveillée) de stéroïdes à fortes doses est également recommandée en raison de la bonne réponse obtenue [14]. Comme les stéroïdes peuvent entraîner une aggravation temporaire de la faiblesse musculaire avec un risque d’insuffisance respiratoire, il faut envisager d’administrer des IgIV ou de réaliser une plasmaphérèse avant les stéroïdes [3]. La réponse à un traitement symptomatique, par exemple à la pyridostigmine, est variable.
Système nerveux central
Des encéphalites associées ont été observées chez 0,1 à 0,2% des patients traités par ICI. Des anticorps paranéoplasiques tels que les anticorps anti-Ma-2, anti-Hu, anti-CASPR2 ou antirécepteur NMDA ont été fréquemment retrouvés [18,19]. Les résultats pathologiques du LCR avec pléiocytose lymphocytaire sont typiques, les résultats de l’IRM varient de discrets à des hyperintensités T2 et des cas isolés avec prise de contraste régionale dans le neurocrâne [20]. L’évolution est généralement favorable en cas d’arrêt de l’ICI et d’utilisation de stéroïdes, même si des cas mortels ont été rapportés [21,22].
Des troubles endocrinologiques sont diagnostiqués dans 4,9 à 17% des cas dans le cadre d’une hypophysite, notamment sous traitement par l’anticorps anti-CTLA-4 ipililumab à une dose supérieure à 3 mg/kg. A plus faible dose, l’incidence est nettement plus faible [23]. Comme la réaction immunitaire endommage rapidement l’hypophyse de manière irréversible, une substitution hormonale à long terme est généralement nécessaire. En conséquence, la recommandation thérapeutique actuelle est de substituer les hormones appropriées, de transmettre l’ICI et de n’administrer des stéroïdes que dans des cas isolés, car cela conduit rarement à une amélioration pertinente [24].
Des méningites aseptiques ont été observées chez 0,1 à 0,2% des patients, en particulier sous inhibition CTLA-4. Outre l’augmentation du nombre de cellules en l’absence d’identification de l’agent pathogène, le liquide céphalorachidien présentait souvent une augmentation des protéines. Sous corticothérapie et suspension de l’administration d’ICI, la symptomatologie était généralement régressive [3].
Des exacerbations associées à l’ICI de maladies inflammatoires du SNC préexistantes, telles que la sclérose en plaques, ont été décrites dans certains cas, de même que le développement de novo d’une sclérose en plaques. Cependant, le traitement peut être effectué sous surveillance neurologique étroite dans la sclérose en plaques [25,26]. Des cas de neuromyélite optique médiée par les anticorps anti-aquaporine 4 et de myélites transversales séronégatives ont également été rapportés. Des cas isolés de syndrome de Tolosa Hunt associé à l’ICI, de neurosarcoïdose, de syndromes de type PRES ou de vascularite du SNC ont également été décrits [27,28].
Résumé des recommandations thérapeutiques
En l’absence de données prospectives, les recommandations thérapeutiques sont basées sur l’expérience des experts et sur des rapports de cas. En règle générale, en cas d’irAE sévère, le traitement par ICI doit être immédiatement interrompu. En cas d’irAE léger (grade 1-2), l’administration d’ICI peut souvent être reprise. Il s’agit généralement de décisions prises au cas par cas, en tenant compte de la gravité de l’EInt et du risque de progression de la tumeur à l’arrêt de l’administration de l’ICI. Dans le cas des irAE non neurologiques, pour lesquels on dispose de plus de données en raison de leur fréquence plus élevée, la réponse aux stéroïdes est généralement bonne. Cela s’applique également à nirAE. L’utilité d’une combinaison avec des immunoglobulines et/ou une séparation du plasma dépend de la gravité de l’EI nir et du type d’ICI (par ex. monothérapie versus thérapie combinée). Il est remarquable que les PIDA associés à l’ICI répondent souvent bien aux stéroïdes, contrairement au syndrome de Guillain-Barré classique. En raison de la longue demi-vie de l’ICI (2 à 4 semaines selon le produit), il est recommandé d’administrer de la prednisolone à raison de 0,5 à 2 mg/kgKG pendant 2 à 4 semaines, en fonction de la gravité de l’EI nir, puis de diminuer progressivement la dose de stéroïdes. Les récidives de l’irAE lors de la réduction des stéroïdes sont fréquentes, c’est pourquoi ces derniers ne doivent être réduits que progressivement sur quelques semaines [24]. Si la symptomatologie n’est pas sensible aux stéroïdes, les immunoglobulines intraveineuses (IVIG) ou la plasmaphérèse peuvent être utilisées [3]. Des études prospectives sont nécessaires pour optimiser les schémas thérapeutiques et sélectionner les patients pour différentes options thérapeutiques (monothérapie versus thérapie combinée). La coopération interdisciplinaire entre neurologues et oncologues est une contribution essentielle à la sécurité du traitement de ces patients souvent très complexes et multimorbides. Des interlocuteurs concrets devraient être définis à cet égard.
Messages Take-Home
- nirAE en tant que complications rares mais potentiellement graves du traitement par ICI
- Tout type de maladie auto-immune possible en tant que nirAE, touchant plus souvent le système nerveux périphérique
- Selon la gravité, arrêt thérapeutique de l’ICI et/ou stéroïdes en traitement primaire
Littérature :
- Heinzerling L, De Toni E, Schett G, et al. (2019) : Inhibiteurs de point de contrôle. Allemand Revue médicale. Int. 116 : 119-126
- Riggenbach E, Ermiş E, Elicin O, et al. (2021) : Combinaison de la radiothérapie et de l’immunothérapie. Swiss Med Forum 21(5-6) : 78-82.
- Astaras C, de Micheli R, Moura B, et al. (2018) : Neurological Adverse Events Associated with Immune Checkpoint Inhibitors : Diagnosis and Management. Curr. Neurol. Neurosci. Rep. 18
- Martins F, Sofiya L, Sykiotis GP, et al. (2019) : Effets indésirables des inhibiteurs de points de contrôle immunitaires : épidémiologie, gestion et surveillance. Nat. Rev. Clin. Oncol. 16 : 563-580
- Menzies AM, Johnson DB, Ramanujam S, et al. (2017) : Traitement anti-PD-1 chez les patients présentant un mélanome avancé et des troubles auto-immuns préexistants ou une toxicité majeure avec l’ipilimumab. Ann Oncol 28(2) : 368-376.
- Weber JS, Hodi FS, Wolchok JD, et al. (2017) : Safety profile of nivolumab monotherapy : A pooled analysis of patients with advanced melanoma. J Clin Oncol 35(7) : 785-792.
- Hottinger AF (2016) : Complications neurologiques des inhibiteurs de points de contrôle immunitaires. Curr. Opin. Neurol. 29 : 806-812
- Kao JC, Liao B, Markovic SN, et al. (2017) : Complications neurologiques associées aux anticorps anti-décès programmé 1 (PD-1). JAMA Neurol 74(10) : 1216-1222.
- Harrison RA, Tummala S, de Groot J (2020) Neurologic Toxicities of Cancer Immunotherapies : a Review. Curr. Neurol. Neurosci. Rep. 20
- Gu Y, Menzies AM, Long GV, et al (2017) : Neuropathie à médiation immunitaire suite à une immunothérapie par points de contrôle. J. Clin. Neurosci. 45 : 14-17
- McNeill CJ, Fehmi J, Gladwin J, Price C (2019) : Un cas rare de variante de Miller Fisher du syndrome de Guillain-Barr é (GBS) induite par un inhibiteur de point de contrôle. BMJ Case Rep 12(8).
- Daxini A, Cronin K, Sreih AG : Vascularite associated with immune checkpoint inhibitors – a systematic review. Rhumatologie clinique 2018 ; 37 : 2579-2584.
- Baldauf MC, Kapauer M, Joerger et al. (sous presse, accepté pour publication en février 2021) : Pembrolizumab-associated CD8+ vasculitic mononeuritis multiplex in a patient with mesothelioma. Neurologie : Neuroimmunologie & Neuroinflammation.
- Thompson JA, Schneider BJ, Brahmer J, et al. (2020) : Management of immunotherapy-related toxicities, version 1.2020 featured updates to the NCCN guidelines. JNCCN J Natl Compr Cancer Netw 18(3) : 231-241.
- Touat M, Maisonobe T, Knauss S, et al. (2018) : Myosite et myocardite liées à un inhibiteur de point de contrôle immunitaire chez les patients atteints de cancer. Neurologie 91(10) : e985-e994.
- Moreira A, Loquai C, Pföhler C, et al. (2019) : Myosite et effets secondaires neuromusculaires induits par les inhibiteurs de points de contrôle immunitaires. Eur J Cancer 106:12-23.
- Makarious D, Horwood K, Coward JIG (2017) : Myasthenia gravis : An emerging toxicity of immune checkpoint inhibitors. Eur J Cancer 82 : 128-136
- Mongay-Ochoa N, Vogrig A, Muñiz-Castrillo S, Honnorat J (2020) : Syndromes paranéoplasiques associés aux anti-Hu déclenchés par un traitement par un inhibiteur de point de contrôle immunitaire. J Neurol 267 : 2154-2156
- Nowosielski M, Di Pauli F, Iglseder S, et al. (2020) : Encéphalomyélonévrite et arthrite après traitement par des inhibiteurs de points de contrôle immunitaires. Neurol Neuroimmunol neuroinflammation 7(4).
- Nishijima H, Suzuki C, Kon T, et al. (2021) : Bilateral Thalamic Lesions Associated With Atezolizumab-Induced Autoimmune Encephalitis (Lésions thalamiques bilatérales associées à une encéphalite auto-immune induite par l’atezolizumab). Neurology 96(3) : 126-127.
- Touat M, Talmasov D, Ricard D, Psimaras D (2017) : Toxicités neurologiques associées aux inhibiteurs de points de contrôle immunitaires. Curr. Opin. Neurol. 30 : 659-668
- Johnson DB, McDonnell WJ, Gonzalez-Ericsson PI, et al. (2019) : A case report of clonal EBV-like memory CD4+ T cell activation in fatal checkpoint inhibitor-induced encephalitis. Nat Med 25(8) : 1243-1250.
- Maker AV, Yang JC, Sherry RM, et al. (2006) : Intrapatient dose escalation of anti-CTLA-4 antibody in patients with metastatic melanoma. J Immunother 29(4):455-463.
- Haanen JBAG, Carbonnel F, Robert C, et al. (2017) : Management of toxicities from immunotherapy : ESMO Clinical Practice Guidelines for diagnosis, treatment and follow-up. Ann Oncol 28(suppl_4) : iv119-iv142.
- Donia M, Pedersen M, Svane IM (2017) : Immunothérapie du cancer chez les patients présentant des troubles auto-immuns préexistants. Semin. Immunopathologie. 39 : 333-337.
- Hasan Ali O, Berner F, Ackermann CJ, et al. (2020) : Fingolimod and tumor-infiltrating lymphocytes in checkpoint-inhibitor treated cancer patients. Cancer Immunol Immunother 70(2).
- Narumi Y, Yoshida R, Minami Y, et al. (2018) : Trouble du spectre de la neuromyélite optique secondaire au traitement par nivolumab, un anticorps anti-PD-1 : le premier rapport. BMC Cancer 18(1).
- Fan S, Ren H, Zhao L, et al. (2020) : Neurological immuno-related adverse events associated with immune checkpoint inhibitors : A review of the literature. Asia Pac J Clin Oncol. 16 : 291-298.
- Rote Liste® Service GmbH Liste rouge. www.rote-liste.de. Date d’entrée en vigueur 27 février 2021
InFo NEUROLOGIE & PSYCHIATRIE 2021 ; 19(2) : 6-9