Après l’implantation d’un stent, la thrombose du stent est l’une des principales complications aiguës. Une inhibition efficace de l’agrégation plaquettaire est donc indiquée. Mais à quoi ressemble-t-elle ?
Au début de l’angiographie coronaire, les lésions étaient d’abord traitées par dilatation au ballonnet seul. Ce n’est qu’au milieu des années 1980 que les premiers stents ont été développés [1,2]. Depuis lors, la technologie des stents mais aussi les possibilités dans le domaine de la prévention de l’agrégation plaquettaire n’ont cessé d’évoluer.
Rôle de la double inhibition plaquettaire (DAPT) et son développement
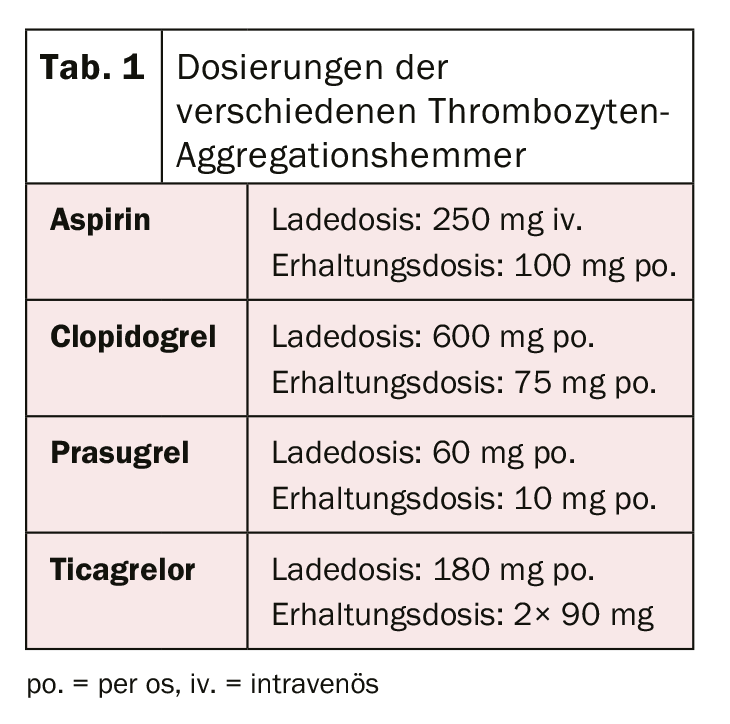
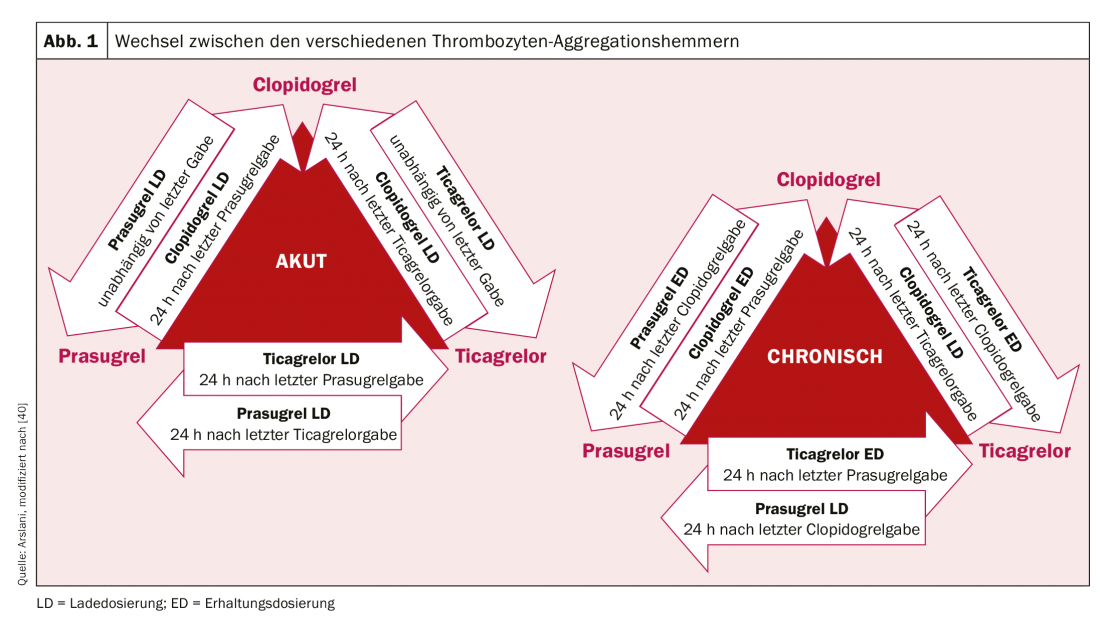
Après la révolution de la première implantation de stent en 1986 par Sigwart et al. [2], les premières difficultés et complications sont apparues assez rapidement. La principale complication aiguë après l’implantation d’un stent est et reste la thrombose du stent, qui a atteint un taux de près de 20% au début. Pour éviter cela, différents traitements visant à fluidifier le sang ou à empêcher l’agrégation des plaquettes après l’implantation d’un stent ont été évalués. Un traitement par dextran de faible poids moléculaire, aspirine (ASS), dipyridamole et héparine intraveineuse n’ayant pas donné les résultats escomptés, les patients ont été systématiquement anticoagulés par voie orale avec de la warfarine après l’implantation d’un stent. Si cela a permis de réduire considérablement le taux de thrombose aiguë et subaiguë de stent à 3,5%, cela s’est accompagné d’une augmentation significative des complications hémorragiques. [3–5]. Dans la recherche de l’équilibre idéal entre la prévention de la redoutable thrombose de stent et l’augmentation du risque hémorragique, plusieurs autres régimes thérapeutiques ont été étudiés par la suite. La double inhibition de l’agrégation plaquettaire semblait être la plus efficace. Ainsi, une étude de Leon et al. a montré qu’une réduction significative de la thrombose de stent et des complications associées pouvait être obtenue par un traitement combiné par ASA et ticlopidine. [6,7]. En raison de l’apparition d’effets secondaires graves sous ticlopidine (notamment allergies, ulcères, diarrhée, troubles de la fonction hépatique et neutropénie), ce médicament a été rapidement remplacé par le clopidogrel, nettement mieux toléré [8]. L’ASA empêche l’activation plaquettaire médiée par le thromboxane et le clopidogrel celle médiée par l’ADP, les deux blocages agissant de manière additive, ce qui rend l’inhibition et donc la réduction de la formation de thrombus nettement plus efficace qu’avec une monothérapie. Le clopidogrel est une prodrogue qui est d’abord métabolisée dans le foie par le cytochrome P450 2C19 et d’autres enzymes CYP, et dont le métabolite actif se lie ensuite de manière irréversible aux récepteurs P2Y12 des plaquettes, réduisant ainsi l’activation des plaquettes par la médiation de l’ADP. Comme les enzymes qui activent le clopidogrel dans le foie sont génétiquement différentes, l’effet antiplaquettaire du clopidogrel n’est pas le même chez tous les individus. Après des patients ayant reçu une endoprothèse élective, l’efficacité de la double inhibition de l’agrégation plaquettaire par ASA et clopidogrel a également été démontrée chez des patients ayant subi un infarctus aigu du myocarde sans élévation du segment ST, par une réduction significative des événements cardiovasculaires [9]. Une optimisation supplémentaire de l’inhibition de l’agrégation des thrombocytes a été réalisée grâce à l’utilisation de nouveaux inhibiteurs du récepteur P2Y12. Le prasugrel est également un promédicament du groupe des thiénopyridines, il est également métabolisé (ou activé) dans le foie et se lie également de manière irréversible, mais plus rapidement et plus fortement, auxdits récepteurs. De plus, contrairement au clopidogrel, il n’y a pas de différences génétiques dans l’activation du prasugrel. L’étude TRITON-TIMI 38 [10] a montré que le prasugrel entraînait une réduction supplémentaire des événements cardiovasculaires par rapport au clopidogrel. Malgré une augmentation des complications hémorragiques, le bénéfice clinique a été clairement démontré en faveur du prasugrel, avec une réduction significative des critères d’évaluation ischémiques (sauf chez les patients âgés de ≥75 ans, de faible poids corporel (<60 kg) et chez les patients ayant subi des événements cérébrovasculaires). De plus, en raison du risque accru de saignement, l’état des coronaires doit être connu avant l’administration de prasugrel ou l’intention de mettre en place un stent doit être établie. Le chargement pré-interventionnel n’est actuellement recommandé qu’en cas d’infarctus avec sus-décalage du segment ST [11]. Le ticagrelor appartient à la classe des cyclopentylriazolopyrimidines et est un inhibiteur compétitif et donc réversible de la P2Y12, qui est pris sous forme de métabolite actif (sans activation enzymatique). Dans l’étude PLATO [12], le ticagrelor s’est également révélé supérieur au clopidogrel. Une réduction des décès d’origine cardiovasculaire, des infarctus du myocarde et des thromboses de stents a été démontrée et rien n’indique que les complications hémorragiques augmentent. Toutefois, par rapport à d’autres études, les définitions des saignements utilisées étaient parfois différentes. Contrairement au prasugrel, l’effet positif a également été observé chez les patients traités de manière conservatrice (sans intervention ni pose de stent) ou par pontage chirurgical [12,13]. Chez les patients présentant un infarctus du myocarde avec sus-décalage du segment ST, il a également été démontré qu’un prétraitement par ticagrelor avant la coronarographie entraînait des taux plus faibles de thrombose de stent [14]. Malheureusement, aucune comparaison entre le ticagrelor et le prasugrel n’a encore été effectuée. La dose de charge initiale et la dose d’entretien des différents médicaments sont résumées dans le tableau 1. Dans la pratique clinique quotidienne, il peut être nécessaire de passer d’une préparation à l’autre (par exemple en cas d’intolérance à un médicament). L’algorithme pour passer d’une préparation à l’autre en fonction du cadre clinique (chronique versus aigu) est présenté dans la figure 1 .
Développement des stents
Comme nous l’avons déjà mentionné, aux débuts de l’intervention coronarienne, le vaisseau était simplement traité par dilatation au ballonnet. Cependant, en raison de dissections, d’un recul élastique en cas de surdilatation et d’un remodelage tardif avec prolifération intimale, il y a souvent eu de nouvelles occlusions vasculaires et des resténoses. Pour contrer ce phénomène et maintenir les vaisseaux ouverts après la dilatation, des grilles vasculaires (stents) expansibles par ballonnet ou auto-expansibles ont été développées et implantées après un traitement préalable par dilatation au ballonnet. Au début, ces stents étaient difficiles à utiliser en raison de leur nature, du matériau utilisé et de la technique d’implantation encore récente (généralement en acier inoxydable avec des entretoises de stent épaisses). Avec le temps, ces stents métalliques (également connus aujourd’hui sous le nom de “bare metal stents”, BMS) ont été améliorés et sont devenus beaucoup plus faciles à utiliser (implantation par expansion du ballon, entretoises de stent plus fines, alliages plus légers). Dès le début, il a été démontré que les BMS étaient supérieurs à la simple dilatation au ballonnet [3,4], mais à long terme, des taux importants de resténose des instants ont été observés en raison d’une prolifération excessive de l’intima. Pour contrer cette prolifération, des stents recouverts de médicaments (drug-eluting-stents, DES) ont été développés. Les DES de première génération étaient composés des mêmes alliages que les BMS, mais étaient recouverts d’un médicament antiprolifératif délivré par un polymère, comme le sirolimus ou le paclitaxel. Cela a entraîné une réduction de la formation de néo-intima et, par conséquent, une diminution significative des resténoses d’instent [15–17]. Cependant, en raison de l’endothélialisation tardive provoquée par les médicaments antiprolifératifs, et donc d’un contact prolongé des endoprothèses avec le flux sanguin, plusieurs études ont montré une augmentation significative du taux de thromboses tardives des endoprothèses et d’infarctus du myocarde [18,19]. En réponse, non seulement l’inhibition de l’agrégation plaquettaire, mais aussi la composition du stent ont été développées. Dans la deuxième et la troisième génération de DES, des polymères biocompatibles et des médicaments plus efficaces, tels que l’évérolimus, ont été utilisés pour le revêtement à des doses plus faibles, ce qui a permis une endothélialisation plus rapide et plus efficace des stents. Associés à la DAPT améliorée, les DES utilisés aujourd’hui ont permis de démontrer une sécurité nettement améliorée par rapport aux DES de première génération, tout en conservant la même efficacité [20,21], ce qui a pratiquement entraîné la disparition des BMS non enrobés. En plus des nouveaux stents, la dilatation par ballonnet s’est également développée et il est désormais possible de traiter les petits vaisseaux au moyen de ballonnets recouverts de médicaments (drug-coated-balloon, DCB) sans implantation de stents [22].
Durée de la DAPT après l’implantation d’un stent
En ce qui concerne la durée du DAPT, il convient de faire une distinction claire entre les patients ayant subi un infarctus aigu du myocarde et ceux souffrant d’une maladie coronarienne stable. Chez les patients atteints d’une maladie coronarienne stable, il a été démontré qu’il n’y avait pas de différence en termes d’événements cardiovasculaires et de décès entre une durée de traitement de 6 mois et de ≥12 mois [23,24]. En revanche, une durée de traitement de plus de 12 mois a entraîné une augmentation significative des complications hémorragiques pertinentes et des preuves d’une mortalité accrue [25,26]. Étant donné qu’aucune étude n’a été menée à ce jour sur un DAPT associant ASA et ticagrelor ou prasugrel chez des patients souffrant d’une maladie coronarienne stable, un DAPT avec clopidogrel est recommandé dans ce contexte. Toutefois, chez certains patients sélectionnés présentant un risque ischémique élevé, l’un des autres médicaments peut être choisi. En résumé, chez les patients atteints d’une maladie coronarienne stable après une intervention, quel que soit le type de stent, et même après un traitement par DCB seul, une double antiagrégation plaquettaire par ASA et clopidogrel est recommandée pendant 6 mois [27]. S’il existe un risque accru de saignement (Precise-DAPT-Score ≥25, www.precisedaptscore.com) [28], la durée du traitement peut être réduite à 3 mois [29,30] et, dans certains cas sélectionnés, à 1 mois [31,32]. Toutefois, en cas de réduction de la durée du traitement (notamment en cas de réduction à 1 mois), il convient d’évaluer soigneusement le risque de récidive d’événements cardiovasculaires par rapport au risque de saignement.
Les recommandations pour les patients ayant subi un syndrome coronarien aigu sont basées sur les études comparatives du prasugrel ou du ticagrelor avec le clopidogrel. Ces études sont à la base de la recommandation actuelle selon laquelle les patients doivent recevoir un double traitement antiplaquettaire par ASA et ticagrelor ou prasugrel après un événement aigu, également indépendamment du type de stent, pendant 12 mois [9,10,12]. Selon les données actuelles, notamment l’étude PEGASUS [33] une double antiagrégation plaquettaire prolongée ne doit être utilisée que chez les patients présentant un risque ischémique élevé (âge ≥50 ans et plus d’un des facteurs suivants : >65 ans, diabète sucré nécessitant un traitement, autre infarctus du myocarde, maladie coronarienne multiviscérale ou insuffisance rénale avec une clairance de <60 ml/min) et sans complications hémorragiques antérieures doivent être envisagées. Dans ce cas, un traitement par ticagrelor 60 mg deux fois par jour est préférable [27]. Une réduction de la durée du traitement à 6 mois est également possible avec un risque acceptable en cas de risque accru de saignement (Precise-DAPT-Score ≥25) [28]. Dans les données précédentes, seule une réduction à <6 mois a montré une augmentation substantielle des événements cardiovasculaires.
Anticoagulation et DAPT
Les patients ayant une indication d’anticoagulation orale représentent un autre défi. Il s’agit ici aussi de trouver l’équilibre idéal entre le risque de saignement et les dangers de thrombose de stent ou d’événements cardiovasculaires. Il est recommandé de suivre une trithérapie comprenant l’ASA, le clopidogrel et l’anticoagulation orale établie, soit avec un antagoniste de la vitamine K (AVK), soit avec l’un des nouveaux anticoagulants oraux (NOAK). L’INR à viser est plutôt à la limite inférieure (INR 2-2,5) et, pour les NOAK, le dosage le plus faible autorisé pour la prévention des événements cérébrovasculaires doit être choisi (dabigatran 110 mg 2× par jour, rivaroxaban 15 mg 1× par jour, apixaban 5 mg 2× par jour ou 2,5 mg si 2 des facteurs de risque suivants s’appliquent : âge ≥80 ans, poids ≤60 kg, créatinine ≥133 umol/l) [27]. L’anticoagulation orale est combinée avec l’ASA et le clopidogrel [34], car il existe peu de données sur les autres inhibiteurs de P2Y12 et les données des registres ont décrit un risque accru de saignement [35]. Lors de la détermination de la durée de la trithérapie, le risque de saignement (score HAS-BLED [hypertension, fonction rénale/ hépatique anormale, antécédents d’accident vasculaire cérébral, antécédents d’hémorragie, INR instable, âge supérieur à 65 ans, abus d’alcool/médicaments tels que les AINS ; risque de saignement élevé si ≥3 points) [36] doit à nouveau être mis en balance avec le risque de thrombose. En cas de risque hémorragique élevé, la trithérapie doit être limitée à un mois, puis une bithérapie (ASA ou clopidogrel + anticoagulation orale à dose normale) doit être poursuivie pendant un an au total [34,37]. En cas de risque important de thrombose, il est recommandé de prolonger la trithérapie jusqu’à 6 mois [38], puis d’ajouter également une bithérapie par ASA ou clopidogrel pendant 6 mois supplémentaires. Après un an, il est alors possible dans la plupart des cas de poursuivre une monothérapie avec l’anticoagulation orale [39].
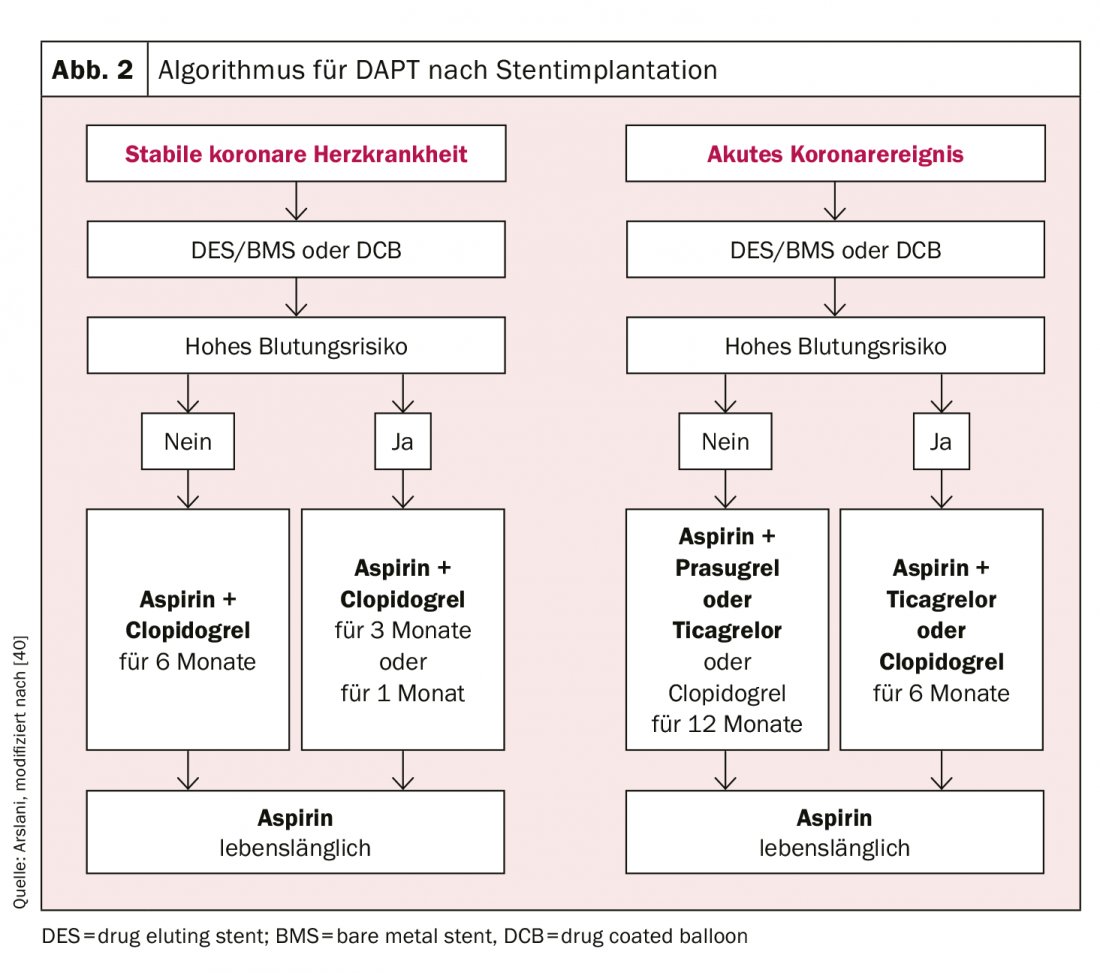
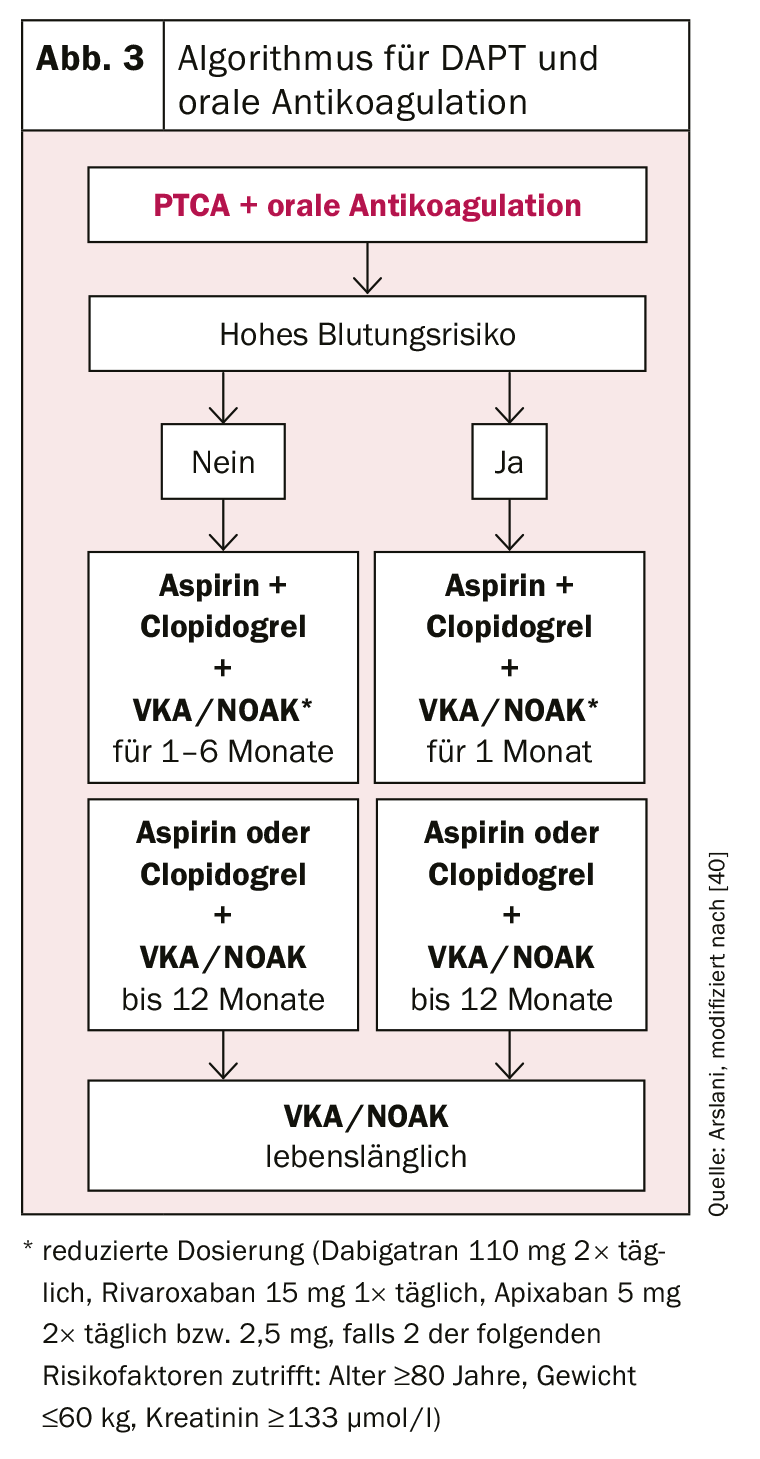
L’utilisation des différents antiagrégants plaquettaires selon les recommandations actuelles de la Société européenne de cardiologie est résumée dans les figures 2 et 3 .
Littérature :
- 1. Gruntzig A : Dilatation transluminale de la sténose de l’artère coronaire. Lancet, 1978. 1(8058): 263.
- 2. Sigwart U, et al : Stents intravasculaires pour prévenir l’occlusion et la resténose après angioplastie transluminale. N Engl J Med, 1987. 316(12) : 701-706.
- Fischman DL, et al : A randomized comparison of coronary-stent placement and balloon angioplasty in the treatment of coronary artery disease. Investigateurs de l’étude sur la resténose des stents. N Engl J Med, 1994. 331(8) : 496-501.
- Serruys PW, et al : A comparison of balloon-expandable-stent implantation with balloon angioplasty in patients with coronary artery disease. Benestent Study GrouN Engl J Med, 1994. 331(8) : 489-495.
- Cohen DJ, et al : Résultats économiques à l’hôpital et à un an après la pose d’un stent coronaire ou d’une angioplastie par ballonnet. Résultats d’un essai clinique randomisé. Investigateurs de l’étude sur la resténose des stents. Circulation, 1995. 92(9) : 2480-2487.
- Leon MB, et al : A clinical trial comparing three antithrombotic-drug regimens after coronary-artery stenting. Investigateurs de l’étude Stent Anticoagulation Restenosis. N Engl J Med, 1998. 339(23) : 1665-1671.
- Schomig A, et al : A randomized comparison of antiplatelet and anticoagulant therapy after the placement of coronary-artery stents. N Engl J Med, 1996. 334(17) : 1084-1089.
- Bertrand ME, et al : Étude en double aveugle de la sécurité du clopidogrel avec et sans dose de charge en association avec l’aspirine par rapport à la ticlopidine en association avec l’aspirine après la pose d’un stent coronaire : l’étude coopérative internationale sur le clopidogrel et le stent (CLASSICS). Circulation, 2000. 102(6) : 624-629.
- Yusuf S, et al : Effets du clopidogrel en plus de l’aspirine chez les patients atteints de syndromes coronariens aigus sans élévation du segment ST. N Engl J Med, 2001. 345(7) : 494-502.
- Wiviott SD, et al : Prasugrel versus clopidogrel chez les patients atteints de syndromes coronariens aigus. N Engl J Med, 2007. 357(20) : 2001-2015.
- Montalescot G, et al : Pretreatment with prasugrel in non-ST-levation acute coronary syndromes. N Engl J Med, 2013. 369(11) : 999-1010.
- Wallentin L, et al : Ticagrelor versus clopidogrel chez les patients atteints de syndromes coronariens aigus. N Engl J Med, 2009. 361(11) : 1045-57.
- Roe MT, et al : Prasugrel versus clopidogrel pour les syndromes coronariens aigus sans revascularisation. N Engl J Med, 2012. 367(14) : 1297-1309.
- Montalescot G, et al : Prehospital ticagrelor in ST-segment elevation myocardial infarction. N Engl J Med, 2014. 371(11) : 1016-1027.
- Morice MC, et al : A randomized comparison of a sirolimus-eluting stent with a standard stent for coronary revascularization. N Engl J Med, 2002. 346(23) : 1773-1780.
- Moses JW, et al : Stents à élution de sirolimus versus stents standard chez des patients présentant une sténose dans une artère coronaire native. N Engl J Med, 2003. 349(14) : 1315-1323.
- Stone GW, et al. : Un stent à base de polymère et à élution de paclitaxel chez les patients atteints d’artériopathie coronarienne. N Engl J Med, 2004. 350(3) : 221-231.
- McFadden EP, et al : Thrombose tardive dans les stents coronaires à élution de médicaments après l’arrêt du traitement antiplaquettaire. Lancet, 2004. 364(9444) : 1519-1521.
- Lagerqvist B, et al : Thrombose de stent en Suède : un rapport du registre suédois de l’angiographie coronaire et de l’angioplastie. Circ Cardiovasc Interv, 2009. 2(5) : 401-408.
- Stone GW, et al : Everolimus-eluting versus paclitaxel-eluting stents in coronary artery disease. N Engl J Med, 2010. 362(18) : 1663-1674.
- Planer D, et al : Comparaison des stents à élution d’évérolimus et de paclitaxel chez les patients atteints de syndromes coronariens aigus et stables : résultats groupés des essais SPIRIT (A Clinical Evaluation of the XIENCE V Everolimus Eluting Coronary Stent System) et COMPARE (A Trial of Everolimus-Eluting Stents and Paclitaxel-Eluting Stents for Coronary Revascularization in Daily Practice). JACC Cardiovasc Interv, 2011. 4(10) : 1104-1115.
- Jeger RV, et al : Drug-coated balloons for small coronary artery disease (BASKET-SMALL 2) : an open-label randomised non-inferiority trial. Lancet, 2018. 392(10150) : 849-856.
- Gwon HC, et al : Six-month versus 12-month dual antiplatelet therapy after implantation of drug-eluting stents : the Efficacy of Xience/Promus Versus Cypher to Reduce Late Loss After Stenting (EXCELLENT) randomized, multicenter study. Circulation, 2012. 125(3) : 505-513.
- Valgimigli M, et al : Short- versus long-term duration of dual-antiplatelet therapy after coronary stenting : a randomized multicenter trial. Circulation, 2012. 125(16) : 2015-2026.
- Costa F, et al : Impact de la présentation clinique sur les résultats ischémiques et hémorragiques chez les patients recevant une durée de 6 ou 24 mois de la bithérapie antiplaquettaire après l’implantation d’un stent : une analyse pré-spécifiée de l’essai PRODIGY (Prolonging Dual-Antiplatelet Treatment After Grading Stent-Induced Intimal Hyperplasia). Eur Heart J, 2015. 36(20) : 1242-1251.
- Bittl JA, et al : Duration of Dual Antiplatelet Therapy : A Systematic Review for the 2016 ACC/AHA Guideline Focused Update on Duration of Dual Antiplatelet Therapy in Patients With Coronary Artery Disease : A Report of the American College of Cardiology/American Heart Association Task Force on Clinical Practice Guidelines. J Am Coll Cardiol, 2016. 68(10) : 1116-1139.
- Valgimigli M, et al. : [2017 ESC focused update on dual antiplatelet therapy in coronary artery disease developed in collaboration with EACTS.]. Cardiol Pol, 2017. 75(12) : 1217-1299.
- Costa F, et al. : Derivation and validation of the predicting bleeding complications in patients undergoing stent implantation and subsequent dual antiplatelet therapy (PRECISE-DAPT) score : a pooled analysis of individual-patient datasets from clinical trials. Lancet, 2017. 389(10073) : 1025-1034.
- Kim BK, et al : Une nouvelle stratégie pour l’interruption de la bithérapie antiplaquettaire : l’essai RESET (REal Safety and Efficacy of 3-month dual antiplatelet Therapy followin Endeavor zotarolimus-eluting stent implantation). J Am Coll Cardiol, 2012. 60(15) : 1340-1348.
- Feres F, et al : Trois mois contre douze mois de bithérapie antiplaquettaire après stents à élution de zotarolimus : l’essai randomisé OPTIMIZE. JAMA, 2013. 310(23) : 2510-2522.
- Urban P, et al : Polymer-free Drug-Coated Coronary Stents in Patients at High Bleeding Risk. N Engl J Med, 2015. 373(21) : 2038-47.
- Valgimigli M, et al : Zotarolimus-eluting versus bare-metal stents in uncertain drug-eluting stents candidates. J Am Coll Cardiol, 2015. 65(8) : 805-815.
- Bonaca MP, Braunwald E, Sabatine MS : Long-Term Use of Ticagrelor in Patients with Prior Myocardial Infarction. N Engl J Med, 2015. 373(13) : 1274-1275.
- Dewilde WJ, et al : Use of clopidogrel with or without aspirin in patients taking oral anticoagulant therapy and subgoing percutaneous coronary intervention : an open-label, randomised, controlled trial. Lancet, 2013. 381(9872) : 1107-1115.
- Sarafoff N, et al. : Triple thérapie avec aspirine, prasugrel, et antagonistes de la vitamine K chez les patients avec implantation de stent à élution de médicament et une indication d’anticoagulation orale. J Am Coll Cardiol, 2013. 61(20) : 2060-2066.
- Roldan V, et al : The HAS-BLED score has better prediction accuracy for major bleeding than CHADS2 or CHA2DS2-VASc scores in anticoagulated patients with atrial fibrillation. J Am Coll Cardiol, 2013. 62(23) : 2199-2204.
- Gibson, C.M, et al. : Prevention of Bleeding in Patients with Atrial Fibrillation Undergoing PCI. N Engl J Med, 2016. 375(25) : 2423-2434.
- Fiedler KA, et al. : Duration of Triple Therapy in Patients Requiring Oral Anticoagulation After Drug-Eluting Stent Implantation : The ISAR-TRIPLE Trial. J Am Coll Cardiol, 2015. 65(16) : 1619-1629.
- Lamberts M, et al : Antiplatelet therapy for stable coronary artery disease in atrial fibrillation patients taking an oral anticoagulant : a nationwide cohort study. Circulation, 2014. 129(15) : 1577-1585.
- Valgimigli M, et al : 2017 ESC focused update on dual antiplatelet therapy in coronary artery disease developed in collaboration with EACTS. European Heart Journal, 2018 ; 39 : 213-254.
CARDIOVASC 2019 ; 18(4) : 16-18