Le 25e cours de formation continue des médecins en oncologie clinique à Saint-Gall s’est déroulé sous un soleil radieux, ce qui a rendu difficile le fait de rester dans les amphithéâtres sans lumière, mais le jeu en valait la chandelle. PD Dr. med. Markus Jörger, Oncologie et Hématologie, St. Gallen, a donné des informations complètes sur les interactions médicamenteuses dans les thérapies oncologiques.
La définition des interactions médicamenteuses (IMA) est la suivante : “Une modification mesurable de l’effet spécifique d’un médicament (en termes d’ampleur ou de durée) due à l’administration préalable ou simultanée d’un autre médicament”. Dans la pratique, les IAM peuvent toutefois être causées non seulement par des médicaments, mais aussi par des aliments, des substances végétales, des substances toxiques telles que l’alcool et le tabac, ainsi que d’autres substances chimiques. Le risque d’IMA augmente avec le nombre de médicaments administrés, l’utilisation de médicaments à faible marge thérapeutique, une réduction croissante des fonctions organiques (foie, reins) et les comorbidités. En outre, les personnes présentant des sensibilités particulières (obésité, cachexie, âge avancé) sont davantage touchées par l’IMA.
Pharmacologie, cinétique et dynamique des médicaments
En principe, on distingue trois formes d’AMI :
- Les interactions pharmaceutiques sont dues aux propriétés chimiques des substances actives. Par exemple, la dépendance au pH de l’absorption gastrique d’un médicament est cliniquement importante.
- Dans les interactions pharmacocinétiques, un médicament influence l’absorption, la distribution, le métabolisme ou l’élimination (ADME) d’un autre médicament. Les modifications des concentrations plasmatiques ont un impact sur l’activité ou la toxicité d’une autre substance active, ce qui peut nécessiter une réduction ou une augmentation de la dose. Les enzymes hépatiques CYP-P450 et l’élimination rénale des médicaments sont importantes.
- En cas d’interactions pharmacodynamiques, un médicament modifie l’efficacité d’un second médicament sans en diminuer ou en augmenter la concentration plasmatique. Ces interactions peuvent également être utilisées à des fins thérapeutiques : Des exemples typiques sont la combinaison de différents antihypertenseurs, l’administration d’antagonistes en cas d’intoxication ou la combinaison de cytostatiques en oncologie.
Attention aux aliments
Les IMA sont fréquents : Selon les estimations, 7% de tous les effets indésirables médicamenteux (EIM) chez les patients hospitalisés et 30% de tous les EIM mortels sont dus à des IMA. Plus un patient prend de médicaments, plus le risque est élevé.
En principe, la plupart des IMA peuvent être évités si l’on est conscient du risque et des situations à risque particulier (tableau 1). Les médicaments à haut risque ne comprennent pas seulement les groupes de substances connus (oncologues, AINS, anticoagulants, etc.), mais aussi des préparations à base de plantes comme l’échinacée et le millepertuis. Ce dernier est un puissant inducteur du CYP et peut donc réduire l’efficacité d’autres médicaments. Les deux effets les plus significatifs du millepertuis sont l’action de la ciclosporine (crises de rejet chez les transplantés d’organes) et celle des contraceptifs (saignements intercurrents et grossesses non désirées). Le soja contient des flavonoïdes à effet pro-œstrogène, les patientes atteintes d’un cancer du sein et suivant un traitement au tamoxifène doivent donc être prudentes lorsqu’elles consomment des produits à base de soja.
Les interactions entre les médicaments et les aliments peuvent également jouer un rôle important, en particulier pour les médicaments oncologiques oraux. Un repas riche en graisses augmente l’absorption des inhibiteurs de tyrosine kinase (ITK) et donc le risque d’effets secondaires. Pour la plupart des ITK, il est donc recommandé de prendre le médicament à jeun, bien qu’il existe des exceptions comme l’imatinib ou le dasatinib. “Pour éviter autant que possible les IMA, il faut informer les patients du moment où ils doivent prendre leurs médicaments”, a souligné le Dr Jörger. “A Saint-Gall, le personnel soignant, qui distribue également les médicaments, dispose de fiches d’information appropriées afin de pouvoir transmettre les informations détaillées aux patients”. Les jus de fruits (jus de pomme, jus de pamplemousse, jus d’orange, etc.) peuvent également poser problème : Ils ralentissent l’excrétion et augmentent ainsi le risque d’IMA et de complications telles que l’allongement de l’intervalle QT, les troubles du rythme ou la myélosuppression.
Dans la deuxième partie de son exposé, le Dr Jörger a présenté différents cas d’AMI.

Capécitabine et Marcoumar
Une patiente de 66 ans atteinte d’un cancer du sein métastatique recevait du Marcoumar depuis janvier 2007 en raison d’embolies pulmonaires bilatérales. A partir de janvier 2008, un traitement par capézitabine (Xeloda®) a été mis en place. En novembre, la patiente a développé un hématome sous-dural chronique. La raison en a été rapidement trouvée : La capézitabine est un puissant inhibiteur du CYP2C9 et empêche ainsi la dégradation du marcoumar. Le Dr Jörger a déclaré que les patientes sous traitement par Xeloda® devraient passer du Marcoumar à une héparine de bas poids moléculaire (HBPM) afin d’éviter les complications hémorragiques.
Erlotinib et simvastatine
Une patiente de 75 ans atteinte d’un adénocarcinome du poumon a été traitée par erlotinib (Tarceva®) en deuxième ligne. Au bout de six semaines, elle a été hospitalisée en urgence pour des douleurs musculaires et une asthénie, et le diagnostic de rhabodmyolyse aiguë a été posé. En raison des comorbidités correspondantes, la patiente avait pris pendant des années de l’aspirine, de l’aténolol, de l’amlodipine et, sans complication, de la simvastatine. L’inhibition du CYP3A4 par l’erlotinib avait augmenté la concentration plasmatique de simvastatine, ce qui a entraîné une rhabdomyolyse. L’arrêt de la simvastatine a permis de poursuivre sans problème le traitement par erlotinib après la phase de récupération.
L’erlotinib, un EGFR-TKI oral, interagit avec toute une série de substances. En raison de l’induction du CYP3A4, il existe un risque de moindre efficacité en cas d’association avec des substances actives telles que la phénytoïne, le millepertuis, la dexaméthasone, etc. Ce problème se pose également chez les fumeurs, qui présentent des taux plasmatiques nettement inférieurs à ceux des non-fumeurs à la posologie standard de 150 mg/j. En revanche, il existe un risque de toxicité accrue en cas d’association d’erlotinib et d’azoles, de jus de pamplemousse, de macrolides, d’antagonistes du Ca, de nelfinavir, etc. La prise simultanée d’erlotinib et d’inhibiteurs de la pompe à protons (IPP) doit être évitée dans la mesure du possible ou les prises doivent être séparées dans le temps (erlotinib le matin, IPP le soir).
Sunitinib et carbamazépine
Chez un patient de 76 ans atteint d’un carcinome métastatique des cellules rénales et traité par carbamazépine et phénytonine, un traitement par sunitinib (Sutent®) était en discussion. Le sunitinib est un substrat du CYP3A4, la carbamazépine et la phénytoïne sont de puissants inducteurs du CYP3A4. Dans cette situation, il est recommandé au neurologue de passer à un antiépileptique non inducteur enzymatique (non EIAED) (tableau 2). Si l’association du sunitinib et d’un EIAED est inévitable, il faut au moins envisager une augmentation progressive de la dose de sunitinib si celui-ci est bien toléré, afin d’éviter une perte d’efficacité.
Capécitabine et diclofénac
Un patient de 62 ans atteint d’un cancer du rectum a reçu une chimiothérapie adjuvante à base de capécitabine (Xeloda®). Cinq mois plus tard, il a été admis en urgence pour une fièvre neutrogène, une diarrhée, un rash et un érythème sur la paume des mains et la plante des pieds. Le diagnostic de syndrome main-pied et de dysfonctionnement rénal subaigu a été posé. Le patient avait pris de fortes doses de diclofénac en raison d’une lombalgie aiguë.
AMI avec méthotrexate
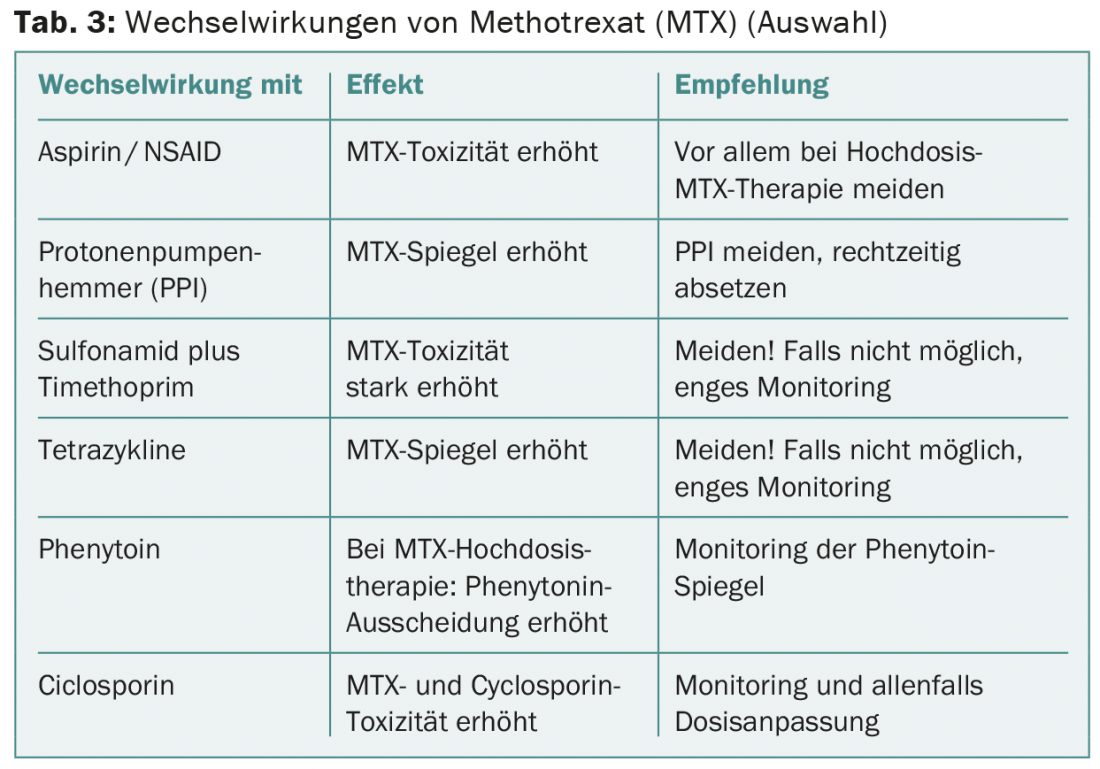
Le méthotrexate (MTX) interagit avec de nombreux autres médicaments (tab. 3). Un patient de 65 ans atteint d’un cancer du larynx a été traité par MTX 60 mg i.v. après une récidive locale. Une semaine plus tard, il souffrait d’une stomatite sévère, d’exanthèmes ulcératifs et d’une neutropénie sévère. A cela s’est ajoutée une pneumonie, dont le patient est finalement décédé. Il avait pris du méfénazide par intermittence, ce qui avait probablement entraîné dans ce cas une dysfonction rénale subaiguë et une élimination rénale très retardée du MTX.
AMI avec imatinib
Un patient de 75 ans atteint de leucémie myéloïde chronique (LMC) a commencé un traitement par imatinib (Glivec®). Un an plus tard, il a été admis en urgence pour des douleurs dans la partie supérieure de l’abdomen, un ictère et des valeurs hépatiques très élevées. Le diagnostic d’hépatite lobulaire subaiguë a été posé, le plus probable étant une hépatite toxique médicamenteuse. Deux mois plus tôt, le patient avait commencé à prendre une préparation à base de ginseng. Cependant, le ginseng est un inhibiteur du système CYP3A4 et inhibe également la dégradation de l’imatinib, ce qui avait entraîné une augmentation des taux plasmatiques d’imatinib et une toxicité grave chez ce patient. Après l’arrêt des médicaments, les enzymes hépatiques se sont normalisées en trois semaines et l’imatinib a pu être réintroduit sans problème.
L’association de l’imatinib et de la simvastatine pose également problème. Avant de commencer un traitement par imatinib, il est donc recommandé de passer de la simvastatine à la pravastatine.
En outre, il convient d’être prudent en cas d’administration simultanée de paracétamol et d’imatinib, car cette combinaison peut également entraîner une toxicité hépatique. La dose quotidienne maximale correspondante de paracétamol est d’environ 1300 mg et ne doit pas être dépassée, si possible.
Conclusion pour la pratique
- Les IAM sont fréquentes et cliniquement significatives.
- De nombreux AMI peuvent être évités.
- Éviter la polypharmacie dans la mesure du possible : Examiner attentivement la liste des médicaments et évaluer s’il est possible d’en supprimer ou d’en changer.
- Il est important de connaître les médicaments et les suppléments spécifiques.
- Aide à l’observance des médicaments.
- Demander au patient de raconter s’il prend des produits supplémentaires (médicaments en vente libre, remèdes à base de plantes ou alternatifs).
Source : 25e cours de formation continue des médecins en oncologie clinique, Saint-Gall, 19-21 février 2015
InFo ONKOLOGIE & HÄMATOLOGIE 2015 ; 3(3-4), 30-32