L’objectif du traitement médicamenteux du cancer de la prostate (PCa) est de prolonger la survie avec des effets secondaires acceptables. Il existe aujourd’hui plusieurs médicaments permettant d’obtenir une déprivation androgénique (ADT) efficace. L’objectif est de faire baisser le taux de testostérone en dessous de 20 ng/dl. Il existe une indication pour l’initiation primaire d’un traitement ADT en cas de PCa métastatique symptomatique. Un patient asymptomatique peut également se voir proposer un TDA, mais dans ce cas, il convient d’évaluer en détail les avantages et les inconvénients possibles. Si une progression du PSA se produit malgré la manipulation hormonale, on parle de PCa résistant à la castration. Les options thérapeutiques pour ces patients sont la chimiothérapie (principalement le docétaxel), l’abiratérone et l’enzalutamide.
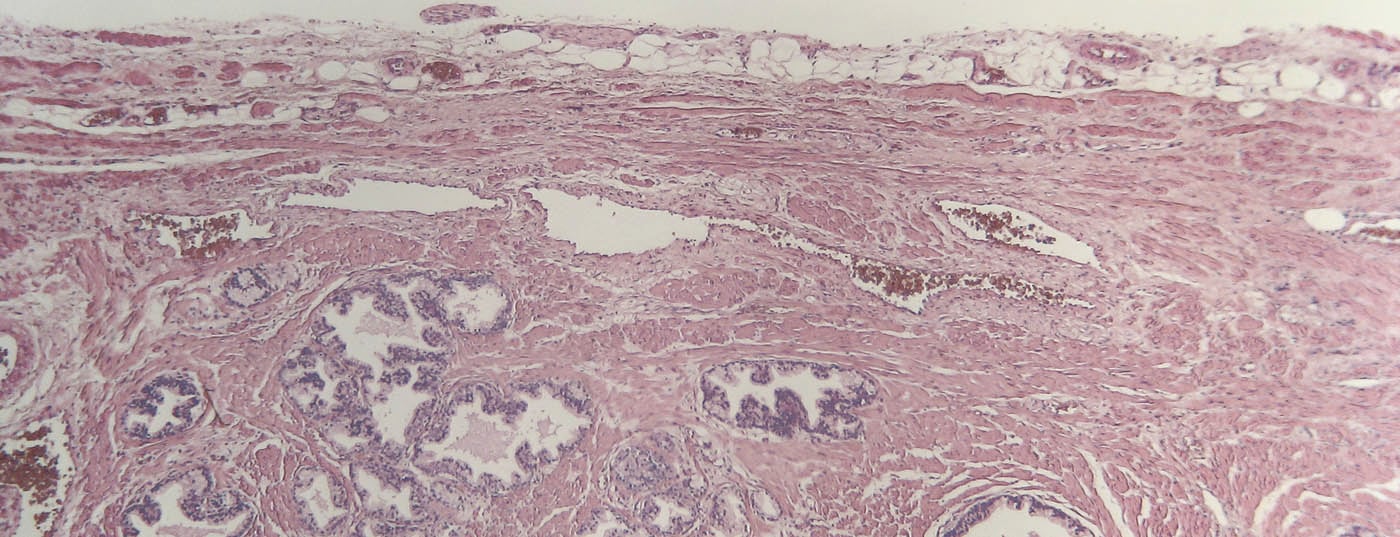
Avec environ 6000 nouveaux cas par an en Suisse, le cancer de la prostate (PCa) est la forme de cancer la plus fréquente. Avec un âge moyen de survenue de la maladie de 70 ans, le PCa est une maladie de l’homme âgé. L’évolution est souvent progressive, en fonction du stade de la tumeur et de sa différenciation, mais peut souvent être influencée favorablement par l’utilisation de médicaments [1]. Celles-ci sont brièvement résumées ci-dessous.
Traitement hormonal du cancer de la prostate
L’hormonothérapie est le premier traitement médicamenteux du PCa. En 1941, Huggins et Hodges ont décrit pour la première fois l’influence positive de la déprivation androgénique (ADT) par orchidectomie bilatérale sur le cancer de la prostate, ce qui leur a valu le prix Nobel en 1966 [2]. Aujourd’hui, plusieurs médicaments sont disponibles pour obtenir un TDA efficace (figure 1). Une réduction du taux de testostérone sérique en dessous de 50 ng/dl est considérée comme efficace [3]. Des données récentes montrent toutefois que la castration chirurgicale permet d’abaisser la testostérone à moins de 20 ng/dl, une valeur qui doit donc également être recherchée dans le cadre de la castration médicamenteuse [4].
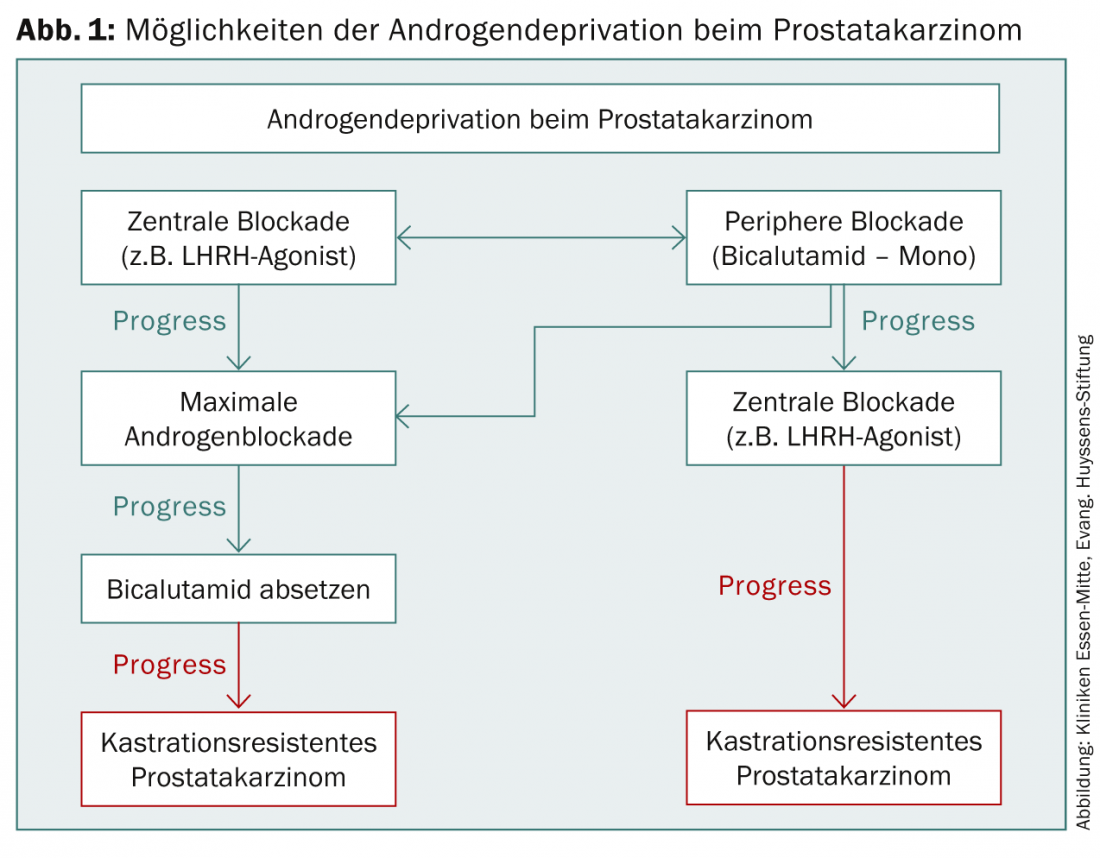
L’une des indications de l’introduction primaire d’un ADT est le PCa métastasé symptomatique. Un patient asymptomatique peut également se voir proposer un traitement ADT primaire, mais dans ce cas, il convient d’évaluer en détail les effets indésirables potentiels, l’impact éventuel sur la qualité de vie, le caractère palliatif du traitement et l’allongement de l’intervalle sans progression. En cas de progression de la tumeur après un traitement antérieur, un TDA doit être initié si le temps de doublement du PSA est inférieur à trois mois, si la progression locale est symptomatique ou si la présence de métastases à distance est avérée. L’ADT est également utilisé en péri-intervention chez les patients à haut risque dans le cadre d’une radiothérapie percutanée. Avant la curiethérapie, la cryothérapie ou les ultrasons focalisés de haute intensité (HIFU), l’ADT peut réduire le volume de la prostate [4].
Agonistes de la LHRH
Le plus souvent, un agoniste de la LHRH est utilisé pour l’ADT [3]. Ce dernier se lie aux récepteurs de la LHRH et stoppe la production de testostérone en régulant à la baisse les récepteurs de l’hypophyse. Initialement, on observe une augmentation de la testostérone, car la liaison de l’agoniste au récepteur entraîne une augmentation de la production de LH et donc de testostérone. Ceci doit être compensé par l’administration d’un bloqueur des récepteurs androgènes, tel que le bicalutamide 150 mg, pendant deux semaines avant et deux semaines après la première administration de l’agoniste de la LHRH. Le niveau de castration est généralement atteint dans ce délai [5,6]. Les agonistes de la LHRH sont injectés par voie sous-cutanée ou intramusculaire et sont disponibles sous forme de dépôts mensuels pendant 1 à 12 mois, selon la préparation. Les préparations les plus courantes sont la leuproréline, la goséréline et la buséréline. Les effets secondaires les plus fréquents sont les bouffées de chaleur, la perte de libido et l’impuissance, ainsi que l’ostéoporose et l’atrophie musculaire en cas d’administration prolongée.
Le blocage intermittent des androgènes comme alternative pour minimiser les effets secondaires de l’ADT n’est actuellement pas encore recommandé comme traitement de routine dans les directives de la société allemande d’urologie en raison du manque de données à long terme sur la survie spécifique et globale de la tumeur. Toutefois, après avoir été informé au préalable des données à long terme qui font encore défaut, le traitement ADT intermittent peut être utilisé pour réduire l’impact de la médication sur la qualité de vie. La durée la plus courante du traitement est de 6 à 9 mois, suivie d’une pause thérapeutique dont la durée peut varier en fonction de la dynamique du PSA [3,7].
Pendant l’ADT, outre les dosages réguliers du PSA, des contrôles réguliers du taux de testostérone doivent être effectués. Si le niveau de castration n’est pas atteint avec l’agent choisi, il convient de changer d’agent, d’ajouter un bloqueur des récepteurs aux androgènes (le plus souvent, le bicalutamide 50 mg) pour bloquer complètement les androgènes ou d’entamer une orchidectomie sous-capsulaire [3].
Antagonistes de la LHRH
Les antagonistes de la LHRH Abarelix ( non autorisé en Suisse) et Degarelix (Firmagon®) sont une alternative aux agonistes de la LHRH. Ces bloqueurs des récepteurs de la LHRH n’entraînent pas d’augmentation de la testostérone et abaissent la testostérone en dessous du niveau de castration en quelques jours seulement, ce qui constitue une alternative à la castration en cas de PCa métastatique hautement symptomatique. L’administration d’abarelix peut entraîner une réaction allergique pouvant aller jusqu’au choc anaphylactique. Cet effet secondaire n’est pas observé avec le degarelix [8,9].
Bloqueurs de récepteurs aux androgènes
Il existe de nombreux bloqueurs stéroïdiens (par exemple l’acétate de cyprotérone) et non stéroïdiens des récepteurs aux androgènes qui inhibent l’action de la dihydrotestostérone directement au niveau cellulaire. Cela ne fait pas baisser le taux de testostérone. Pour des raisons pratiques, nous n’aborderons ici que le produit le plus courant et présentant le moins d’effets secondaires, le bicalutamide non stéroïdien (Casodex® et génériques).
Le bicalutamide, administré par voie orale, est autorisé en monothérapie dans le traitement du cancer de la prostate non métastasé mais localement avancé. Il a été démontré qu’une dose de 150 mg par jour permettait d’obtenir des durées de survie similaires à celles obtenues par castration chirurgicale [10]. Chez les patients atteints de PCa métastasé avec un PSA > ng/ml, on a certes constaté une survie sans progression et une survie globale plus courtes, mais chez ces patients aussi, compte tenu de la meilleure qualité de vie par rapport à l’ADT, une monothérapie par bicalutamide peut être envisagée après une information appropriée [11]. L’un des effets secondaires les plus fréquents est une gynécomastie souvent douloureuse, c’est pourquoi l’irradiation prophylactique des glandes mammaires est recommandée avant le début du traitement.
Blocage maximal des androgènes
Si une augmentation du PSA se produit sous LHRH en monothérapie, un bloqueur des récepteurs aux androgènes est ajouté. On parle alors de blocage androgénique complet ou maximal. Elle est également utilisée lorsque la testostérone ne descend pas en dessous du niveau de castration sous monothérapie par LHRH ou lorsqu’il y a une augmentation du PSA sous monothérapie par bicalutamide. Toutefois, la possibilité d’une augmentation des effets secondaires doit être discutée en détail avec le patient. Chez un patient asymptomatique présentant une augmentation du PSA, il est également possible d’attendre dans un premier temps en maintenant la monothérapie et de ne commencer le blocage androgénique maximal que lorsque les symptômes apparaissent [3].
Manipulation hormonale secondaire
En cas de nouvelle augmentation du PSA sous blocage androgénique maximal, l’arrêt du blocage des récepteurs androgéniques peut entraîner une chute du PSA en raison d’une mutation ponctuelle en cours de développement dans le récepteur de la testostérone [12]. De nombreuses autres substances sont également disponibles pour la manipulation hormonale secondaire, par exemple les corticostéroïdes, le kétoconazole, l’aminoglutéthimide, les œstrogènes, la progestérone, le tamoxifène, les inhibiteurs de la somatostatine, les rétinoïdes et le calcitriol. Le kétoconazole, en particulier, peut prolonger le délai d’initiation de la chimiothérapie [13]. Avant de commencer le traitement, le patient doit être informé en détail de la nature palliative du traitement, des effets secondaires possibles et de l’absence de preuves d’une survie prolongée [3].
Chimiothérapie
Si une progression du PSA se produit malgré la manipulation hormonale secondaire, on parle de cancer de la prostate résistant à la castration. Si le patient est asymptomatique, il est possible de continuer à attendre. Les indications pour l’initiation d’une chimiothérapie sont une métastase progressive ou un temps de doublement rapide du PSA et un PSA >15 ng/ml (Fig. 2).
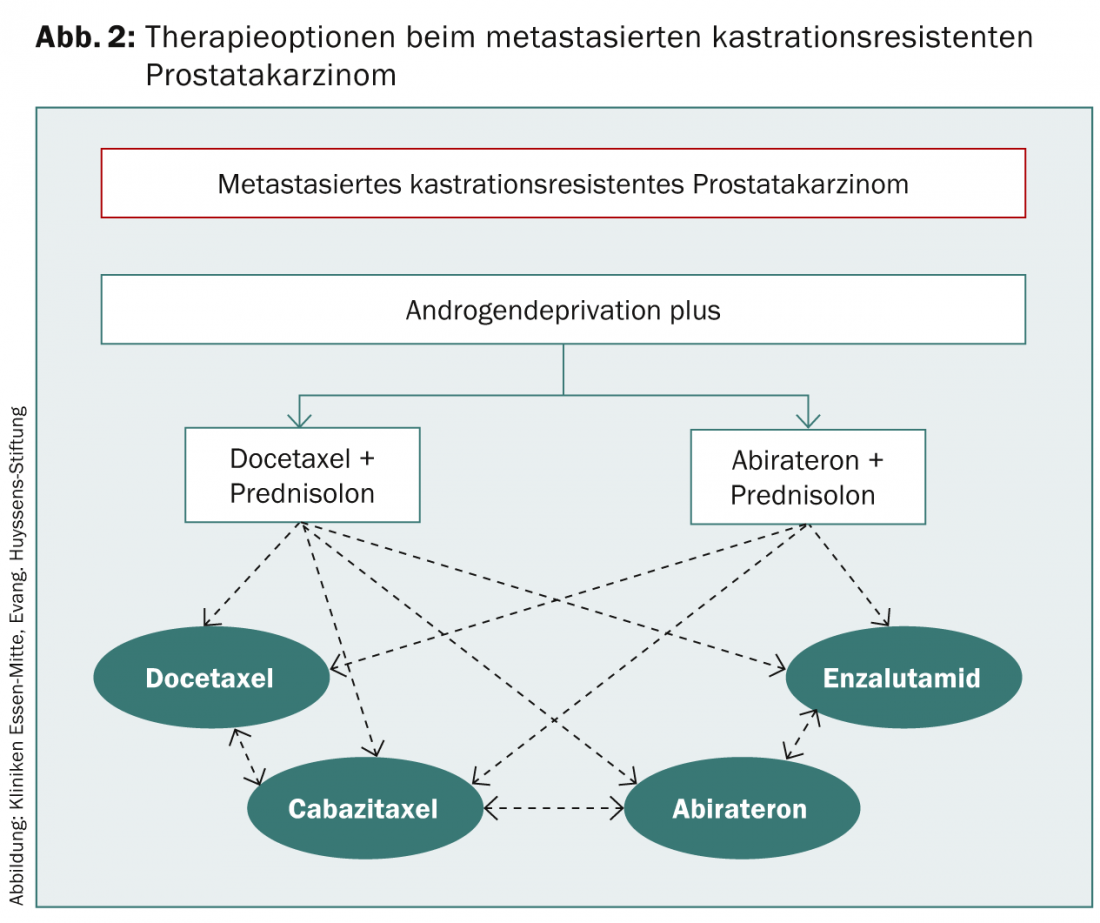
En raison des effets secondaires attendus, il convient d’évaluer soigneusement le moment où il est judicieux de commencer le traitement chez un patient asymptomatique.
Le docetaxel est utilisé comme chimiothérapie de première ligne. Le docétaxel est administré à raison de 75 mg/m² toutes les trois semaines avec 2× 5 mg de prednisolone par jour pendant 6 à 10 cycles. L’ADT préexistant doit être maintenu, mais les bloqueurs de récepteurs aux androgènes doivent être arrêtés au moins quatre semaines avant le début de la chimiothérapie [3]. Si la maladie progresse sous docétaxel, on peut envisager de passer au cabazitaxel 25 mg/m² toutes les trois semaines, en association avec la prednisolone. Dans les études, un avantage de survie n’est apparu qu’après avoir reçu au moins trois cycles de cabazitaxel. De nouvelles données montrent également un avantage de survie pour le docétaxel en première ligne avant l’ADT, ce qui conduira probablement à une modification de la séquence thérapeutique.
Abiratérone (Zytiga®)
L’abiratérone (Zytiga®), un inhibiteur du CYP17, réduit le taux de testostérone en inhibant la synthèse de la testostérone dans les testicules, la prostate et les glandes surrénales. Depuis octobre 2011, l’abiratérone est autorisée pour le traitement du PCa métastatique résistant à la castration après une progression tumorale après une chimiothérapie par docétaxel et est ainsi recommandée dans les directives des sociétés d’urologie. Entre-temps, l’abiratérone est également autorisée comme traitement de première ligne du PCa métastasé résistant à la castration, mais uniquement pour les patients asymptomatiques ou tout au plus légèrement symptomatiques. Il convient de noter que les patients traités par abiratérone avant docétaxel ont une progression plus rapide de la maladie après l’administration de docétaxel que les patients n’ayant pas reçu d’abiratérone [14].
L’abiratérone est prise sous forme de comprimés à raison de 1000 mg par jour en association avec la prednisolone ; le traitement ADT existant est poursuivi. Les effets secondaires pertinents sont principalement l’hypertension, l’hypokaliémie et la rétention de liquide due à un excès de minéralocorticoïdes.
Enzalutamide (Xtandi®)
L’enzalutamide (Xtandi®) a été approuvé en Europe en juin 2013 pour le traitement du PCa métastatique résistant à la castration après un traitement par docétaxel. L’inhibiteur du récepteur des androgènes est pris quotidiennement sous forme de comprimés, avec ou sans prednisolone. Les effets secondaires pertinents sont les maux de tête et les bouffées de chaleur. Il existe une contre-indication en cas de dysfonctionnement hépatique grave. Dans les études, l’administration orale de 160 mg d’enzalutamide par jour a entraîné une augmentation significative de la survie globale par rapport au placebo ; l’enzalutamide est donc une autre alternative thérapeutique au cabazitaxel et à l’abiratérone [15]. L’autorisation de l’enzalutamide avant une chimiothérapie par docétaxel est également attendue pour l’automne 2014.
Traitement des métastases osseuses
Pour le traitement des métastases osseuses, les lignes directrices recommandent actuellement le bisphopsphonate acide zolédronique (Zometa® et génériques) ou l’anticorps monoclonal dénosumab (Prolia®) [3]. En outre, le radium 223 est également disponible en cas d’indication stricte. Cependant, une étude détaillée de ces médicaments dépasserait le cadre de cet article, nous vous renvoyons donc à la littérature spécifique à ce sujet.
Conclusion
Il existe actuellement de nombreux médicaments différents pour traiter le PCa avancé. Dans le domaine du PCa métastatique résistant à la castration en particulier, l’autorisation de nombreux nouveaux médicaments a donné lieu à des alternatives thérapeutiques prometteuses. Cependant, d’autres études sont nécessaires de toute urgence pour développer un traitement séquentiel basé sur des preuves.
Take-home-messages
- L’objectif du traitement médicamenteux du PCa est de prolonger la survie avec des effets secondaires acceptables.
- L’ADT doit également être poursuivi au stade métastatique résistant à la castration.
- L’abiratérone est actuellement une alternative à la chimiothérapie primaire.
- L’enzalutamide est une autre alternative après (et, à partir de l’automne 2014, avant) le traitement par docétaxel.
- Il n’y a pas encore suffisamment de preuves pour développer un plan par étapes pour le choix des médicaments au stade métastatique résistant à la castration.
- Pour le traitement des métastases osseuses, il existe des médicaments efficaces tels que l’acide zolédronique, le dénosumab et le radium-223.
Littérature :
- Le cancer en Allemagne 2007/2008. 8e édition. Robert Koch-Institut (éd.) et la Gesellschaft der epidemiologischen Krebsregister in Deutschland e.V. (éd.). Berlin, 2012.
- Huggins C, et al. : Études sur le cancer de la prostate. II. les effets de la castration sur les carcinomes avancés de la glande prostatique. Arch Surg 1941 ; 43 : 209-223.
- Ligne directrice interdisciplinaire de qualité S3 sur le dépistage, le diagnostic et le traitement des différents stades du cancer de la prostate.
- Gomella LG : Suppression efficace de la testostérone pour le cancer de la prostate : existe-t-il un meilleur traitement de castration ? Rev Urol 2009 ; 11(2) : 52-60.
- www.awmf.org/uploads/tx_szleitlinien/043-022OLl_S3_Prostatakarzinom_2011.pdf. (Consulté le 11/08/2014)
- Auclair C, et al : Inhibition du niveau du récepteur de l’hormone lutéinisante testiculaire par traitement avec un agoniste puissant de l’hormone libérant l’hormone lutéinisante de la gonadotrophine chorionique humaine. Biochem Biophys Res Commun 1977 ; 76(3) : 855-862.
- Huhtaniemi I, et al : Réponse des niveaux de gonadotrophine circulante au traitement par agoniste de la GnRH dans le cancer de la prostate. J Androl 1991 ; 12(1) : 46-53.
- Tunn U : The current status of intermittent androgen deprivation (IAD) therapy for prostate cancer : putting IAD under the spotlight. BJU Int 2007 ; 99 Suppl 1 : 19-22 ; discussion 23-24.
- Trachtenberg J, et al : A phase 3, multicenter open label, randomized study of abarelix versus leuprolide plus daily antiandrogen in men with prostate cancer. J Urol 2002 ; 167 : 1670-1674.
- Van Poppel H, et al : Degarelix : a novel gonadotropin-releasing hormone (GnRH) receptor blocker – results from a 1-yr, multicentre, randomised, phase 2 dose-finding study in the treatment of prostate cancer. Eur Urol 2008 ; 54(4) : 805-813.
- Iversen P, et al : Casodex (bicalutamide) 150-mg monothérapie comparée à la castration chez les patients atteints de cancer de la prostate non métastatique précédemment non traité : résultats de deux essais randomisés multicentriques avec un suivi médian de 4 ans. Urologie 1998 ; 51(3) : 389-396.
- Kaisary AV, et al : Y a-t-il un rôle pour la monothérapie antiandrogène chez les patients atteints de cancer de la prostate métastatique ? Prostate Cancer Prostatic Dis 2001 ; 4(4) : 196-203.
- Small EJ, et al : L’hormonothérapie de deuxième ligne pour le cancer de la prostate avancé : un changement de paradigme. J Clin Oncol 1997 ; 15(1) : 382-388.
- Lam JS, et al : Traitement hormonal secondaire pour le cancer de la prostate en phase avancée. J Urol 2006 ; 175(1) : 27-34.
- Schweizer MT, et al : The Influence of Prior Abiraterone Treatment on the Clinical Activity of Docetaxel in Men with Metastatic Castration-resistant Prostate Cancer. Eur Urol 2014 ; pii : S0302-2838(14)00069-4. doi:10.1016/ j.eururo. 2014.01.018.
- Scher H, et al : Increased survival with enzalutamide in prostate cancer after chemotherapy. N Engl J Med 2012 ; 367 : 1187-1197.
InFo ONKOLOGIE & HÉMATOLOGIE 2014 ; 2(8) : 10-13