Les maladies mentales ont un impact sur la mère et le fœtus, ainsi que sur le développement ultérieur de l’enfant. Inversement, la grossesse peut également influencer la maladie. Ces interactions posent un défi particulier aux médecins traitants, qui doivent les aborder de manière interdisciplinaire.
La dépression pendant la grossesse n’est pas rare. Les causes sont multiples et sont influencées en amont par les changements hormonaux, les changements à venir dans les conditions de vie et la constellation psychologique, ainsi que par la prédisposition génétique. La prévalence est estimée jusqu’à 10% de toutes les grossesses. Il y a quelques années, une grande statistique des décès maternels en Angleterre a montré une augmentation des décès maternels liés au suicide pendant la grossesse ; entre 2000 et 2002, le suicide était même la cause la plus fréquente de mortalité maternelle – et donc plus fréquente que les événements cardiaques, les thromboembolies ou les hémorragies péripartum [1].
Matrice des interactions
Il existe de multiples interactions entre la maladie psychique, l’organisme maternel et le fœtus ou son environnement intra-utérin, qui sont en partie justifiées par un effet direct, en partie médiatisées indirectement par la thérapie médicamenteuse ou par une substance active dans le cadre d’un abus de substances. Ces interactions structurées comme des matrices ne peuvent souvent pas être clairement distinguées dans la pratique clinique quotidienne. Cependant, il est essentiel de prendre en compte les différents facteurs d’influence sur la femme enceinte et sur l’enfant lors du suivi de la grossesse afin d’obtenir le meilleur résultat possible pour la mère et l’enfant (figure 1). Les maladies mentales (par exemple la dépression, la schizophrénie, la toxicomanie) peuvent affecter la grossesse de différentes manières.
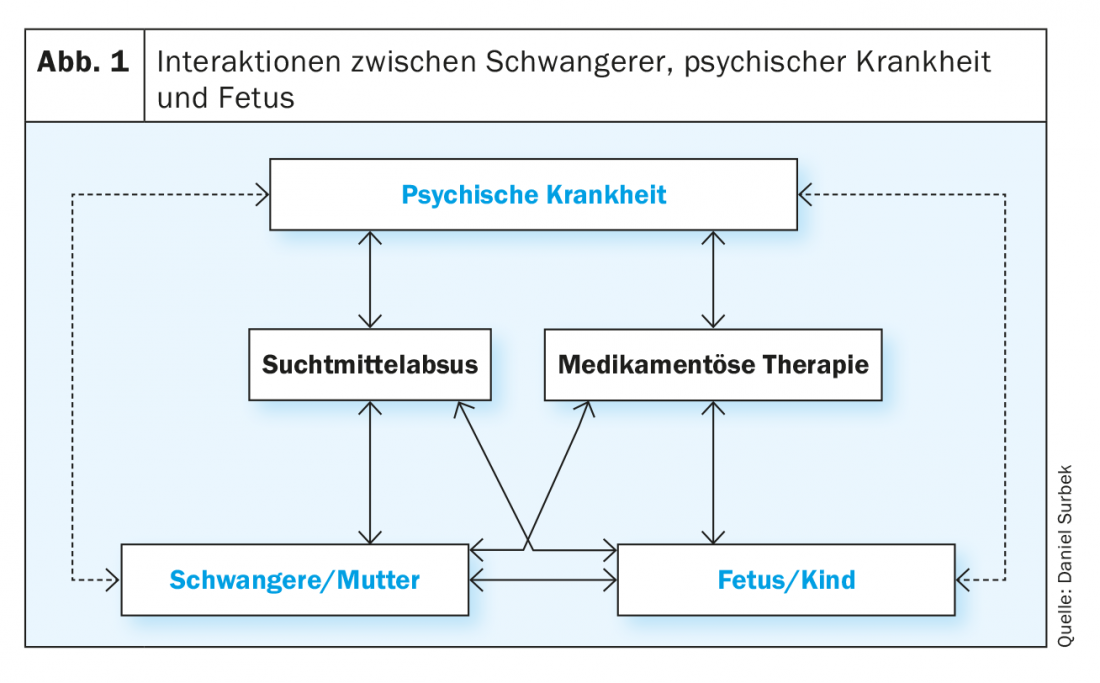
Atteinte directe par la maladie : elle peut être due à des troubles du sommeil, à des facteurs de stress psychologiques et/ou sociaux, à des troubles alimentaires, à l’anorexie ou à un manque de prise de poids, ou encore à un manque d’observance des soins prénataux. Les conséquences possibles sont
- Retard de croissance intra-utérin
- Naissance prématurée
- mort intra-utérine du fœtus
- Complications à l’accouchement
Le lien entre le stress psychologique et les complications de la grossesse est aujourd’hui bien étudié. Le principal médiateur est l’hormone de libération des corticotrophines (CRH), qui est également appelée dans ce contexte le “coordinateur de la réponse au stress” [2]. La CRH joue un rôle important non seulement en tant que médiateur dans le déclenchement d’un travail prématuré et, par conséquent, d’un éventuel accouchement prématuré, mais aussi dans la réduction de la perfusion placentaire, ce qui peut entraîner une insuffisance placentaire avec retard de croissance intra-utérin. Le retard de croissance n’apparaît souvent qu’au troisième trimestre et est parfois difficile à détecter. Il faut garder à l’esprit que la maladie mentale peut conduire au suicide en cas de dépression grave.
Influence indirecte de la médication : les maladies mentales ont également un impact sur la grossesse par un mécanisme indirect, par l’intermédiaire du traitement médicamenteux (voir ci-dessous). Il est donc important de réaliser que les maladies mentales ont une prévalence considérable pendant la grossesse. Des études récentes montrent que la dépression peut survenir jusqu’à 10% pendant la grossesse et que sa prévalence a tendance à augmenter [3,4]. Les épisodes dépressifs, qui ne répondent pas aux critères d’une dépression proprement dite mais qui sont néanmoins invalidants, sont même présents dans 70% des cas chez les femmes enceintes.
Influence d’une toxicomanie : il faut distinguer ici les différentes classes de substances, chacune ayant des effets très spécifiques sur la femme enceinte ou le fœtus. Les classes de substances et leurs effets potentiels sont examinés ci-dessous.
Recommandations en cas d’abus de substances psychoactives
Abus de nicotine : l’abus de nicotine, encore très répandu, entraîne typiquement deux pathologies importantes de la grossesse : La prématurité et le retard de croissance intra-utérin. Il est intéressant de noter que les femmes qui présentent un abus de nicotine ont une incidence légèrement plus faible de pré-éclampsie. Les mécanismes pathopysiologiques qui conduisent à la prématurité et au retard de croissance intra-utérin sont essentiellement liés aux substances vasoactives présentes dans la fumée de cigarette et aux conséquences du monoxyde de carbone sur l’apport transplacentaire du fœtus. En raison notamment de la prévalence élevée de l’abus de nicotine, les programmes de sevrage tabagique chez les femmes qui envisagent une grossesse ou qui sont en début de grossesse font partie des méthodes les plus efficaces pour réduire le taux élevé et toujours croissant de naissances prématurées dans la population. L’intervention médicale appropriée chez les fumeuses est donc l’une des mesures préconceptionnelles les plus importantes. En principe, la “tolérance zéro” doit s’appliquer à l’abus de nicotine pendant la grossesse [5].
Abus d’éthyle : l’abus d’alcool à des niveaux significatifs a des effets graves sur le fœtus. Contrairement à l’abus de nicotine, qui a des conséquences sur la grossesse principalement en raison de l’insuffisance placentaire, l’alcool a un effet toxique direct sur le fœtus. Les conséquences sont décrites par le syndrome d’alcoolisation embryofœtale. Celui-ci comprend, outre les stigmates typiques du nouveau-né (dysmorphie faciale avec philtrum haut et plat, etc.), une microcéphalie, des malformations cardiaques et un trouble grave du développement psychomoteur et psychosocial qui se prolonge souvent jusqu’à l’adolescence. Étant donné que l’alcool éthylique traverse facilement la barrière placentaire à tout moment de la grossesse et qu’il s’agit d’une substance lipophile directement toxique pour le cerveau du fœtus en développement, il existe une dépendance directe de la dose d’alcool par rapport aux troubles du développement à long terme pendant les trois trimestres. C’est pourquoi il faut dans tous les cas essayer de réduire la quantité d’alcool consommée par les alcooliques au cours de la grossesse, si possible avec des psychotropes si nécessaire. La question de savoir s’il existe un seuil inférieur de quantité d’alcool pouvant entraîner une toxicité pour le fœtus est controversée. Il est relativement bien établi que la consommation de petites quantités d’alcool (un verre de vin par semaine) n’a pas d’effet néfaste sur le fœtus. Néanmoins, la consommation d’alcool devrait être totalement déconseillée pendant la grossesse [5].
Consommation d’opiacés : la consommation d’opiacés par les personnes dépendantes peut prendre la forme d’un abus parentéral (morphine, héroïne) ou d’une substitution par voie entérale (méthadone, buprénorphine). Toutes les formes d’abus d’opiacés pendant la grossesse ont en commun une accoutumance transplacentaire à la substance par le fœtus, qui se manifeste en post-partum par un syndrome de sevrage néonatal aux opiacés. Cela comprend des tremblements, des cris stridents, de courtes périodes de sommeil et même des convulsions néonatales. Le traitement du nouveau-né comprend généralement une administration parentérale initiale d’opiacés, qui doit ensuite être réduite sur plusieurs semaines sous la forme d’un sevrage lent. La consommation d’opiacés par voie parentérale doit être évitée autant que possible pendant la grossesse. La substitution orale par la méthadone présente de nombreux avantages, bien qu’elle entraîne également (de manière non linéaire en fonction de la dose) un syndrome de sevrage néonatal. Des études sont en cours pour déterminer si la substitution par la buprénorphine au lieu de la méthadone présente un avantage en termes de syndrome de sevrage néonatal. Dans tous les cas, le principe thérapeutique ne devrait pas avoir pour objectif de réduire à zéro la substitution orale au cours de la grossesse, car l’expérience montre que le risque d’abus incontrôlé d’opiacés parentéraux (ou d’autres substances, parfois encore plus dangereuses pour la grossesse) augmente fortement.
Cocaïne, amphétamines : Dans cette classe de substances, dont l’effet vasoactif dépend de la dose, les complications de la grossesse sont principalement le retard de croissance intra-utérin, la pré-éclampsie et la prématurité. Les malformations fœtales sont fréquentes (par ex. gastroschisis). Une complication aiguë typique et grave est le décollement prématuré du placenta, qui entraîne souvent par la suite une mort intra-utérine ou des complications maternelles graves (choc hémorragique, troubles graves de la coagulation). Pour cette raison, ces substances sont parfois parmi les plus dangereuses pendant la grossesse et leur utilisation doit être évitée à tout prix pendant la grossesse.
Tétrahydrocannabinol : l’abus de cannabis pendant la grossesse est très répandu. Les conséquences possibles sont un retard de croissance intra-utérin et une naissance prématurée. Le tétrahydrocannabinol traverse également la barrière placentaire sans aucun obstacle, comme l’alcool éthylique. Les récepteurs cérébraux aux cannabinoïdes sont présents dès les premiers stades embryonnaires. Ce système endocannabinoïde joue un rôle essentiel dans la prolifération, la différenciation et la migration des cellules. Une exposition intra-utérine à des cannabinoïdes externes peut donc avoir un impact négatif sur le développement neuropsychologique. A cela s’ajoute l’influence de l’abus de cannabinoïdes sur le métabolisme endogène des opioïdes pendant la grossesse, ce qui a été démontré dans des modèles animaux. La question de savoir si un trouble du développement mental à long terme de l’enfant se produit, et à partir de quelles doses, est diversement discutée. Certaines études montrent un effet dans le sens d’une augmentation de l’impulsivité pendant l’enfance. Des symptômes de sevrage néonatal ont également été décrits.
Infections liées à la toxicomanie : des études cliniques confirment que les toxicomanes souffrent plus souvent d’infections qui peuvent avoir des conséquences sur la grossesse ou le fœtus. Ces infections comprennent typiquement les hépatites B et C, le VIH, la lèpre, l’infection génitale à chlamydia, l’herpès génital, la vaginose bactérienne et l’infection génitale à HPV. Les conséquences possibles de ces infections varient en fonction de l’agent pathogène. D’une part, ils peuvent entraîner un risque accru d’accouchement prématuré (par ex. chlamydia, vaginose bactérienne), d’autre part, ils peuvent entraîner une transmission verticale intra-utérine ou sub-partum au fœtus, avec les conséquences que cela implique pour l’enfant (par ex. infection par le VIH, hépatite C). Lors de la prise en charge des femmes enceintes souffrant d’addiction, les différentes infections doivent donc être activement recherchées et, le cas échéant, des mesures thérapeutiques ou prophylactiques doivent être prises pour éviter une transmission verticale.
Effets de la maladie mentale et de la médication sur le fœtus
En raison de la fréquence de la dépression pendant la grossesse, l’utilisation de psychotropes est au premier plan. Une statistique américaine montre que l’utilisation d’antidépresseurs pendant la grossesse (surtout les ISRS) est passée de 2% à environ 8% au cours des dix dernières années [4]. Il est possible que cette utilisation répandue de psychotropes ne reflète pas une augmentation générale de la dépression pendant la grossesse, mais plutôt la reconnaissance que les avantages des psychotropes pendant la grossesse sont souvent plus importants que leurs risques. Il est désormais prouvé que l’arrêt des antidépresseurs pendant la grossesse ou même en préconceptionnel entraîne un taux de récidive élevé, pouvant atteindre 75% [6,7]. En outre, des études ont montré que la dépression en soi entraînait un moins bon résultat de la grossesse, car elle provoque un retard de croissance intra-utérin plus fréquent et une augmentation de la prématurité. A cela s’ajoute un risque accru de suicide. En prévision d’une grossesse ou au début de celle-ci, il ne faut donc pas en premier lieu forcer l’arrêt des médicaments antidépresseurs, mais envisager le passage à un antidépresseur le plus compatible possible avec la grossesse. Les effets pharmacothérapeutiques sur le fœtus doivent être pris en compte et sont décrits ci-dessous.
La tératogénicité se caractérise par une induction exogène de malformations d’organes, l’exposition devant avoir lieu en premier lieu pendant le stade embryonnaire (phase délicate du développement des organes). Le stade embryonnaire est défini jusqu’à la fin de la huitième semaine de grossesse post-conceptionnelle (c’est-à-dire jusqu’à la dixième semaine de grossesse après les dernières règles). Au cours des deux premières semaines suivant la conception, l’embryon est au stade de blastocyste. Dans ce cas, on part généralement du principe du “tout ou rien” : Les éventuelles influences toxiques n’entraînent pas de malformations d’organes, mais une implantation perturbée des blastocystes dans l’endomètre et, par la suite, un avortement spontané.
La phase importante de tératogénicité s’étend donc de la deuxième à la huitième semaine de grossesse post-conceptionnelle. Au stade fœtal suivant, la plupart des organes ont achevé les principales étapes de leur différenciation. Il y a avant tout une croissance et éventuellement une maturation fonctionnelle. Cependant, certains organes continuent à se différencier pendant le stade fœtal. Il s’agit notamment du cerveau fœtal et du tractus urogénital fœtal.

Les encadrés de la page 8 expliquent deux exemples d’interaction entre la consommation de médicaments et le développement embryonnaire. Ils illustrent la complexité de cette relation et la nécessité d’une évaluation individuelle des risques et d’une adaptation du traitement psychopharmaceutique. En fin de compte, il convient de mettre en balance les éventuels effets secondaires indésirables et les effets bénéfiques (qui prédominent souvent dans le cas de la psychopharmacothérapie pendant la grossesse).

Effets à long terme de la maladie mentale sur l’enfant
Sur la base de l’hypothèse de Barker, il est désormais prouvé que les influences prénatales sur le fœtus (milieu intra-utérin) entraînent une programmation de certains systèmes d’organes ou processus métaboliques qui ont des répercussions sur l’enfant tout au long de sa vie (“fetal programming”). L’exemple le plus important est le lien entre un faible poids de naissance en cas de retard de croissance intra-utérin et le risque ultérieur de maladie cardiovasculaire. Aujourd’hui, il est également prouvé que l’exposition prénatale peut avoir des conséquences sur la santé mentale. Une étude a ainsi montré un risque accru de suicide à l’adolescence ou à l’âge adulte chez les personnes ayant un faible poids de naissance [8]. D’autres études montrent un risque nettement accru de dépression à l’âge adulte chez les prématurés et les nouveau-nés de faible poids de naissance [9,10]. On pense que la clé du lien physiopathologique entre l’exposition intra-utérine à certaines conditions et la maladie psychiatrique ultérieure est médiatisée par l’axe de stress du cortisol. Cela se manifeste déjà lors d’une exposition au stress intra-utérin à court terme, comme nous l’avons démontré dans notre étude récemment publiée sur la relation entre différents facteurs de stress liés au mode d’accouchement, le taux de cortisol et la douleur ressentie dans le post-partum [11]. Les enfants de mères souffrant de troubles psychiatriques ont un risque accru de développer la même maladie plus tard. Contrairement à une prédisposition génétique, l’exposition intra-utérine est en principe accessible à la thérapie.
Nos efforts dans la prise en charge des femmes enceintes souffrant de troubles mentaux doivent donc aller dans le sens d’une amélioration non seulement du résultat à court terme de la grossesse, mais aussi des conséquences possibles à long terme pour l’enfant et de leurs possibilités de prévention.
Comment prendre en charge ?
Lors de la prise en charge de la femme enceinte souffrant d’une maladie mentale, il faut tenir compte des éventuels effets réciproques. Elle comprend donc 1) la maladie mentale de la femme, 2) l’unité utéro-placentaire, et 3) le fœtus comme deuxième patient. La prise en charge des femmes enceintes dépendantes, en particulier, nécessite un concept de prise en charge globale qui intègre davantage l’environnement social et les ressources existantes de la patiente. Les soins obstétricaux ou prénataux spécifiques mettent l’accent sur la prévention, la détection précoce et le traitement des effets potentiels. Cela inclut les aspects centraux suivants :
Pilier I : le conseil préconceptionnel doit être donné par le spécialiste en gynécologie/obstétrique, en collaboration ou en accord avec le psychiatre qui suit la patiente. Idéalement, un plan de grossesse approprié devrait être mis en place avant l’arrêt de la contraception. Il convient également d’essayer de planifier la grossesse au moment le plus favorable possible compte tenu de la maladie mentale. En outre, les aspects thérapeutiques (choix des médicaments) et préventifs (prophylaxie multivitaminique/acide folique, réduction ou arrêt de l’abus de substances) doivent également être pris en compte. Si la grossesse a déjà débuté, la consultation doit commencer le plus rapidement possible au début de la grossesse.
Pilier II : l’élément le plus important du diagnostic des développements intra-utérins pathologiques est l’échographie prénatale spécialisée. Cela permet parfois de détecter des malformations fœtales à un stade précoce (12e semaine de grossesse). L’échographie spécialisée revêt une importance particulière, car de nombreuses malformations (cardiaques par exemple) sont difficiles à diagnostiquer et un diagnostic précoce peut améliorer considérablement les résultats ultérieurs de l’enfant. Un conseil détaillé et non directif concernant les possibilités de diagnostic prénatal doit être fourni au préalable, y compris le “droit de ne pas savoir”. Certaines malformations graves peuvent en outre être traitées en partie dès la période intra-utérine, alors qu’aucun traitement n’est possible en postnatal. Dans un tel cas de figure, où la patiente est gravement affectée sur le plan psychologique, il peut être nécessaire d’envisager une interruption de grossesse. Les autres points forts du diagnostic sont les échographies longitudinales rapprochées de la longueur du col, de la croissance intra-utérine et de l’hémodynamique fœtale et utéro-placentaire (examens Doppler). Aujourd’hui, il est possible de prédire un retard de croissance intra-utérin ou une pré-éclampsie dès le début de la grossesse grâce à la mesure du flux sanguin et à des analyses biochimiques supplémentaires. Les grossesses en cas de maladie mentale doivent être considérées comme des grossesses à risque, d’où l’urgence d’exiger un suivi prénatal spécialisé.
Pilier III : Les interventions thérapeutiques consistent, en cas de malformations fœtales, à prévenir la prématurité par des mesures médicamenteuses (p. ex. thérapie à la progestérone) ou chirurgicales (p. ex. cerclage) appropriées. En particulier en cas de risque accru de prématurité, un traitement fœtal par application transplacentaire de glucocorticoïdes correctement dosés (“induction de la maturation pulmonaire”) est souvent essentiel, car il permet de réduire de 50% la morbidité et la mortalité fœtales en cas d’accouchement prématuré. En cas de risque élevé de retard de croissance intra-utérin et de pré-éclampsie, une prophylaxie médicamenteuse (acide acétylsalicylique 100 mg par jour, supplémentation en calcium 1-2 mg par jour) est efficace si elle est administrée à temps. En cas de retard de croissance intra-utérin sévère avec modifications hémodynamiques correspondantes ou en cas de pré-éclampsie sévère, la prise en charge hospitalière correspondante avec surveillance intensive du fœtus et accouchement à temps en cas d’exacerbation est la mesure thérapeutique la plus importante. Dans tous les cas, en cas de maladie mentale de la femme enceinte et de complications de la grossesse, la grossesse doit impérativement faire l’objet d’une prise en charge interdisciplinaire dans un centre tertiaire afin d’obtenir le meilleur résultat pour la mère et l’enfant.
Messages Take-Home
- Les maladies mentales ont de multiples conséquences, tant sur le déroulement de la grossesse que sur le fœtus et le développement de l’enfant.
- Inversement, la grossesse peut agir sur une maladie mentale ou favoriser sa première manifestation clinique par le biais de différentes influences, parfois hormonales.
- La matrice multidimensionnelle des interactions représente un défi particulier pour la prise en charge interdisciplinaire des patientes, avec au premier plan les psychiatres et les gynécologues-obstétriciens.
- Les soins prénataux sont souvent complexes et exigeants et nécessitent donc une collaboration avec un centre spécialisé afin d’obtenir le meilleur résultat pour la mère et l’enfant.
Littérature :
- Hobel CJ, Goldstein A, Barrett ES : Stress psychosocial et issue de la grossesse. Clin Obstet Gynecol 2008 ; 51(2) : 333-348.
- Drife J : Pourquoi les mères meurent. J R Coll Physicians Edinb 2005 ; 35 : 332-336.
- Bennett HA, et al : Prevalence of depression during pregnancy : systematic review. Obstet Gynecol 2004 ; 103(4) : 698-709.
- Andrade SE, et al : Utilisation de médicaments antidépresseurs pendant la grossesse : une étude multisite. Am J Obstet Gynecol 2008 ; 198(2) : 194, e1-5.
- Bürki RE, et al. : Recommandations actuelles sur les conseils préconceptionnels. Lettre aux experts No. 33, Société suisse de gynécologie et d’obstétrique, 2010. www.sggg.ch/fileadmin/user_upload/33_Praekonzeptionsberatung_2010.pdf, dernière consultation 05.03.19.
- Cohen LS, et al : Relapse of depression during pregnancy following antidepressant discontinuation : a preliminary prospective study. Arch Womens Ment Health 2004 ; 7(4) : 217-221.
- Cohen LS, et al : Relapse of major depression during pregnancy in women who maintain or discontinue antidepressant treatment. JAMA 2006 ; 295(5) : 499-507. Erratum in : JAMA 2006 ; 296(2) : 170.
- Barker DJ, et al : Low weight gain in infancy and suicide in adult life. BMJ 1995 ; 311(7014) : 1203.
- Patton GC, et al : Prematurity at birth and adolescent depressive disorder. Br J Psychiatry 2004 ; 184(5) : 446-447.
- Thompson C, et al : Birth weight and the risk of depressive disorder in late life. Br J Psychiatry 2001 ; 179 : 450-455.
- Schuller C, et al : Stress et réponse à la douleur des nouveau-nés après une naissance spontanée, une délivrance sous vide et une délivrance par césarienne. Am J Obstet Gynecol 2012 ; 207(5) : 416.e1-6.
- Koren G, Nordeng H : Utilisation d’antidépresseurs pendant la grossesse : le rapport bénéfice-risque. Am J Obstet Gynecol 2012 ; 207(3) : 157-163.
- Hviid A, Melbye M, Pasternak B : Utilisation des inhibiteurs sélectifs du recaptage de la sérotonine pendant la grossesse et risque d’autisme. N Engl J Med 2013 ; 369 : 2406-2415.
InFo NEUROLOGIE & PSYCHIATRIE 2019 ; 17(2) : 6-12











