Avec la multiplication des options thérapeutiques personnalisées et immuno-oncologiques, l’importance des marqueurs prédictifs ne cesse de croître. Jusqu’à présent, il était nécessaire d’effectuer un diagnostic tissulaire, y compris une biopsie invasive, pour déterminer la nature de la maladie. Cela pourrait bientôt changer avec l’introduction de ce que l’on appelle la biopsie liquide. Toutefois, il reste encore quelques obstacles à surmonter avant un déploiement à grande échelle.
Là où l’analyse génétique nécessitait jusqu’à présent un prélèvement de tissu tumoral, une simple prise de sang pourrait bientôt suffire. Dans le cadre de l’analyse des acides nucléiques basée sur le sang par biopsie liquide , les cellules tumorales circulantes, l’ADN et l’ARN tumoraux sont isolés et analysés à partir du sang veineux. Il s’agit d’une méthode qui n’est rendue possible que par la détection très sensible des acides nucléiques. Si l’on parvient à le valider pour une application à grande échelle, on pourrait notamment simplifier considérablement le diagnostic des mutations pilotes et donc le choix du traitement. Bien que les procédures standardisées et les données à long terme fassent encore défaut, cette technique a connu un véritable essor au cours des dernières années. Cela se traduit par une augmentation impressionnante des contributions aux congrès et des publications. Si la recherche PubMed pour “liquid biopsy” fournit un maigre 21 articles publiés en 2013, ce chiffre passera à 1374 en 2020 [1]. Ce nouveau domaine de diagnostic semble également intéressant sur le plan économique. C’est ainsi qu’un grand nombre d’entreprises se consacrent exclusivement à la recherche et à la commercialisation de la biopsie liquide . La plus célèbre d’entre elles est sans doute la startup GRAIL, soutenue par Bill Gates, qui se consacre notamment à la détection précoce du cancer au moyen d’acides nucléiques tumoraux circulants sans cellules [2].
ADN tumoral dans le sang
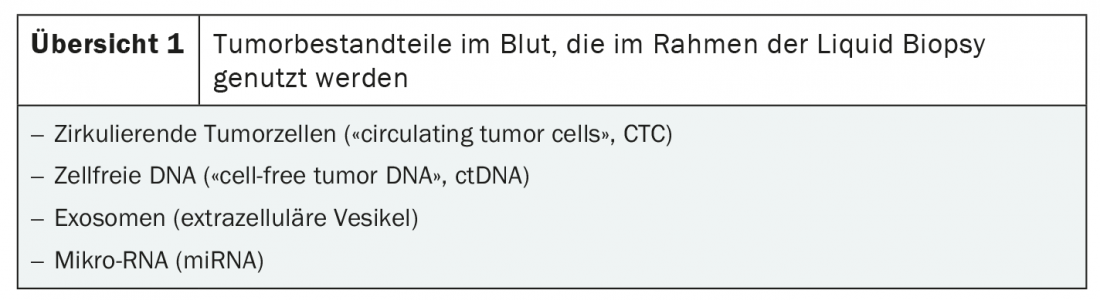
La condition préalable à la biopsie liquide est l’isolation des composants de la tumeur dans le sang. Il existe deux sources principales d’ADN malin : les cellules tumorales circulantes (“circulating tumor cells”, CTC) et l’ADN sans cellule (“cell-free tumor DNA”, ctDNA). En outre, les biopsies liquides permettent de détecter les tumeurs . exosomes et micro-ARN (miARN) sont détectés (aperçu 1) [3]. La méthode est basée sur des méthodes très sensibles de détection des acides nucléiques telles que le séquençage parallèle (NGS), la PCR et l’analyse de cellules individuelles [3,4].
Les différentes approches sont utilisées dans différents domaines sur la base de leurs avantages et inconvénients. Par exemple, l’hétérogénéité de la tumeur peut être représentée par l’analyse de l’ADNc, alors qu’il est plus difficile de se prononcer sur la composition de la tumeur dans son ensemble en utilisant des cellules tumorales circulantes. Dans les deux cas, une valeur pronostique de l’examen a été démontrée pour différentes malignités : Plus le nombre de cellules tumorales circulantes et d’ADN acellulaire détectés est élevé, plus le risque de récidive et de progression est important. En outre, le grade et le stade de la tumeur sont corrélés à la charge d’ADNc. Mais les possibilités de diagnostic vont bien au-delà de ces analyses quantitatives. Les changements qualitatifs ont également une importance pronostique et prédictive. Ils peuvent être utilisés non seulement pour identifier des cibles thérapeutiques et des aberrations génétiques, mais aussi comme paramètres d’évolution qui pourraient servir à évaluer la réponse thérapeutique à l’avenir. Par exemple, la persistance de l’expression de PD-L1 sur les cellules tumorales circulantes sous un blocage approprié du point de contrôle est considérée comme un facteur de mauvais pronostic [5]. Des conclusions similaires s’appliquent au traitement par inhibiteurs de tyrosine kinase chez les patients atteints de cancer du poumon : En cas de réponse, le taux d’ADNc pour les mutations du récepteur du facteur de croissance épidermique (EGFR) chute [6]. En général, il semble qu’une instabilité des microsatellites (MSI) dans l’ADNct, entre autres, indique un stade avancé de la tumeur. De nombreuses études dans ce domaine sont actuellement en cours et, avec le nombre croissant de cibles thérapeutiques et de marqueurs prédictifs, d’innombrables autres questions attendent d’être testées pour la biopsie liquide .
Des exosomes et des micro-ARN
Mais les cellules tumorales circulantes et l’ADNc ne sont pas les seuls sujets de recherche actuels. D’autres composants tumoraux peuvent également être détectés dans le sang : Les exosomes et le micro-ARN (miARN). Ce dernier est constitué de petits fragments d’ARN non codants. Ceux-ci sont impliqués dans la régulation de la prolifération, de la différenciation cellulaire et de l’apoptose et agissent donc comme des oncogènes ou des gènes suppresseurs de tumeurs [7]. En clinique, le miARN est surtout prometteur en tant que biomarqueur, car le niveau d’expression est corrélé à la transformation maligne. Et ce, souvent avant même que les changements phénotypiques ne soient perceptibles [8]. De plus, chaque tumeur maligne possède une signature miRNA caractéristique – un atout majeur lorsqu’il s’agit de déterminer l’origine tissulaire d’une tumeur mal différenciée. Que ce soit dans le cadre du dépistage ou de la clarification de l’identité de la tumeur, le miRNA fera probablement encore plus parler de lui dans les années à venir.
Dans ce cadre, l’analyse des exosomes, c’est-à-dire des vésicules extracellulaires, est également intéressante. En effet, ces derniers contiennent de fortes concentrations de miARN. Comme probablement toutes les cellules, les cellules tumorales sécrètent les vésicules d’origine endosomale. Leur rôle est encore largement inexpliqué, mais fait l’objet de recherches intensives. Il existe par exemple des indications selon lesquelles les exosomes tumoraux peuvent favoriser l’angiogenèse ou inactiver des anticorps thérapeutiques en exprimant des antigènes tumoraux.
Qu’il s’agisse d’ADNc, de cellules tumorales circulantes, de miARN ou d’exosomes, la biopsie liquide peut être utilisée dans de nombreux domaines. Cette méthode pourrait être particulièrement utile pour le dépistage précoce des tumeurs, la caractérisation génétique et comme paramètre d’évolution sous traitement [4]. Les avantages sont évidents : grâce à un diagnostic peu invasif, possible même en l’absence de tissu tumoral et, de surcroît, comparativement peu risqué, il est possible d’obtenir une image dynamique du profil génétique de la tumeur. D’une part, les récidives peuvent être détectées à un stade précoce et, d’autre part, leur profil moléculaire, souvent modifié, peut être décodé par prise de sang – et attaqué en conséquence. Si la biopsie liquide devait s’établir comme méthode standard, cela marquerait probablement une nouvelle étape dans l’ère de la planification thérapeutique personnalisée.
Développement nécessaire
Même si de nombreuses recherches ont déjà été effectuées, le processus n’en est qu’à ses débuts. En conséquence, il existe encore de grandes incertitudes en matière d’évaluation et même de mise en œuvre. L’applicabilité semble varier de manière significative entre les différents types et stades de tumeurs. Par exemple, l’ADNc n’est détecté que dans environ 70% des maladies malignes métastasées. Dans de nombreuses entités tumorales, une proportion significative de patients ne présente presque pas d’ADNc. Dans le cas des tumeurs cérébrales, l’utilisation de l’analyse de l’ADNc est discutable en raison de la barrière hémato-encéphalique, car très peu de fragments d’ADN parviennent dans le sang [3,4]. L’amélioration de la sensibilité des méthodes de mesure devrait permettre de remédier de plus en plus efficacement à ces limitations dans les années à venir. Cependant, certaines optimisations techniques doivent encore être réalisées avant l’introduction dans la pratique clinique quotidienne [4].
En outre, pour permettre une application plus large, il manque actuellement une standardisation et une gestion de la qualité des méthodes. Les experts s’accordent sur ce point et demandent, entre autres, la définition de valeurs de cut-off claires et de panels standardisés. Il faudrait également déterminer dans quelle mesure les différents marqueurs sont capables de refléter l’hétérogénéité des tumeurs. La possibilité de détecter les caractéristiques moléculaires d’une tumeur maligne de manière plus complète qu’avec une biopsie classique, par exemple, pourrait constituer un autre avantage décisif de la nouvelle méthode. L’importance de la biopsie liquide dans le dépistage du cancer, avec tous les dilemmes que cela implique, reste à démontrer. Dans ce cadre, la pertinence d’un résultat “pathologique” devrait être analysée avec précision, notamment en termes de risque réel de maladie, avant une utilisation plus large du diagnostic [4]. Il reste donc un long chemin à parcourir jusqu’à la pratique quotidienne, qui restera certainement passionnant au cours des prochaines années.
Source : Wallesch M, Wirth M, Wollenberg B : “Liquid biopsy”, un élément clé de l’immuno-oncologie. ORL. 2020 ; 68(12) : 899-904.
Littérature :
- www.ncbi.nlm.nih.gov/pubmed/ (consulté le 07.03.2021)
- https://grail.com/ (consulté le 07.03.2021)
- Nitz P : Biopsie liquide. Société allemande du cancer ; 2018. www.krebsgesellschaft.de/onko-internetportal/basis-informationen-krebs/diagnosemethoden/liquid-biopsy.html (consulté le 07.03.2021)
- Dahl E : Diagnostic : Liquid Biopsy – Status 2016. Dtsch Arztbl. 2016 ; 113(4). DOI: 10.3238/PersOnko/2016.09.30.01
- Hofman P, et al : Liquid biopsy in the era of immuno-oncology : is it ready for prime-time use for cancer patients ? Ann Oncol. 2019 ; 30(9) : 1448-1459.
- Thress KS, et al : Acquired EGFR C797S mutation mediates resistance to AZD9291 in non-small cell lung cancer harboring EGFR T790M. Nat Med. 2015 ; 21(6) : 560-562.
- Iorio MV, Croce CM : MicroRNA dysregulation in cancer : diagnostics, monitoring and therapeutics. A comprehensive review. EMBO Mol Med. 2017 ; 9(6) : 852.
- du Rieu MC, et al : MicroRNA-21 est induit précocement dans les lésions précurseurs d’adénocarcinome canalaire pancréatique. Clin Chem. 2010 ; 56(4) : 603-612.
InFo ONKOLOGIE & HÉMATOLOGIE 2021 ; 9(2) : 42-43