Les approches modernes de traitement des maladies inflammatoires chroniques de l’intestin (MICI) s’orientent vers la devise “Treat-to-target” (traitement vers la cible). Outre le soulagement des symptômes et l’induction d’une rémission de la maladie, on s’efforce aujourd’hui de préserver la muqueuse du côlon et de la rendre endoscopiquement normale. Les nouvelles molécules biologiques et les petites molécules, qui peuvent être utilisées en cas de réponse insuffisante aux médicaments conventionnels, sont porteuses d’un espoir important d’optimisation des résultats thérapeutiques.
Le paysage thérapeutique a évolué rapidement au cours des dernières années. Plusieurs nouvelles substances très efficaces issues des groupes de médicaments biologiques et des “petites molécules” sont apparues sur le marché, en particulier pour les formes modérées et sévères de la maladie. L’aperçu 1 présente les agents pharmacothérapeutiques actuellement autorisés en Suisse pour le traitement de la colite ulcéreuse et de la maladie de Crohn.

“Treat-to-target” est le mot d’ordre
Les objectifs thérapeutiques dans le traitement de la CED sont avant tout de soulager les symptômes et de supprimer l’inflammation du tractus gastro-intestinal. Aujourd’hui, l’objectif n’est pas seulement la guérison de la muqueuse intestinale, mais aussi le contrôle complet de la maladie avec une rémission histologique [1]. Bien qu’il n’existe toujours pas de traitement curatif, il existe de nombreuses options de traitement médicamenteux dont l’efficacité est prouvée. Dans une première phase du traitement, l’accent est mis sur l’amorce d’une rémission et donc sur le soulagement des symptômes. Pour ce faire, on utilise souvent des médicaments immunomodulateurs qui agissent rapidement (par exemple, les corticostéroïdes). Il s’agit ensuite de maintenir la rémission pendant une période aussi longue que possible. En raison des effets secondaires, les stéroïdes ne sont pas adaptés à cet effet. En fonction de la gravité et des autres caractéristiques de la maladie, on utilise des aminosalicylates, de l’azathioprine ou des produits biologiques. À l’ère de la médecine personnalisée, les caractéristiques individuelles spécifiques à la maladie, telles que le risque de progression et de complications, ainsi que les prédicteurs de la réponse au traitement sont de plus en plus pris en compte [2].
Pour le traitement d’une colite ulcéreuse légère (C. ulcerosa), on utilise souvent initialement des préparations à base d’acide 5-aminosalicylique (5-ASA) (par ex. mésalazine ou sulfasalazine), voire des corticostéroïdes [3]. L’objectif principal est de réduire l’inflammation. Le 5-ASA a également fait ses preuves en tant que traitement d’entretien et en prévention des rechutes. Les immunosuppresseurs tels que l’azathioprine ou la 6-mercaptopurine peuvent être utiles dans le cas d’une forme de C. ulcerosa caractérisée par des poussées fréquentes ou une activité élevée de la maladie [1]. En cas de poussée très active et agressive de C. ulcerosa, les stéroïdes intraveineux peuvent être envisagés et si cela ne permet pas de soulager suffisamment les symptômes, on peut avoir recours à la ciclosporine. Pour les formes sévères, l’ustékinumab élargit depuis 2020 en Suisse l’éventail des thérapies biologiques autorisées [14].
Dans la maladie de Crohn (M. Crohn), les corticostéroïdes sont généralement utilisés en premier lieu en présence de foyers inflammatoires actifs. En cas d’inflammation légère, les préparations à base de 5-ASA peuvent également être ciblées (par exemple, la mésalazine ou la sulfasalazine) [1]. Dans les formes plus agressives de la maladie de Crohn, l’utilisation d’immunosuppresseurs tels que l’azathioprine, la 6-mercaptopurine ou le méthotrexate doit être envisagée. En cas d’absence de réponse au traitement médicamenteux conventionnel, des agents biologiques tels que l’adalimumab, le certolizumab, l’infliximab, le vedolizumab ou l’ustékinumab sont disponibles.
Vaste arsenal de produits biologiques très efficaces
Les progrès dans le domaine de la recherche sur les processus moléculaires constituent la base du développement de cibles thérapeutiques, ce qui se traduit par de nouveaux produits biologiques très efficaces. Elle implique, entre autres, la destruction des jonctions serrées et du film muqueux recouvrant la couche épithéliale intestinale, ce qui augmente la perméabilité de l’épithélium et entraîne une augmentation de l’absorption des antigènes luminaux dans les couches profondes de la paroi intestinale [23]. La participation des cellules immunitaires entraîne une augmentation de la production de cytokines pro-inflammatoires – les cibles des anticorps monoclonaux.
L’autorisation de mise sur le marché des médicaments biologiques a considérablement amélioré les possibilités thérapeutiques pour les formes modérées et sévères de la CED. Le choix du traitement approprié est un défi de plus en plus complexe, en raison du nombre croissant de substances actives disponibles. Pour une décision thérapeutique basée sur des critères, il est possible de se référer à une large base de données probantes. Entre autres, la gravité des symptômes et les foyers d’inflammation dans l’intestin sont des critères importants pour la stratégie de traitement. Voici un résumé concis d’une sélection de résultats concernant les anticorps monoclonaux actuellement autorisés en Suisse pour le traitement des CED.

ANTI-TNF : l’approbation des inhibiteurs du TNFα il y a quelques années a représenté un grand progrès pour les possibilités de traitement des CED. L’efficacité et la sécurité de l’adalimumab en traitement d’induction et d’entretien de la maladie ulcéreuse active modérée à sévère ont été démontrées dans les études ULTRA 1 et 2 [4]. L’étude ULTRA 3 a montré que la rémission, la cicatrisation muqueuse et l’amélioration de la qualité de vie étaient maintenues sous traitement par l’adalimumab pendant 4 ans [4]. L’efficacité du golimumab en présence d’une colite ulcéreuse modérée à sévère malgré un traitement par stéroïdes, 5-ASA ou thiopurines a été démontrée dans le programme d’études PURSUIT [5,6]. Selon les analyses de l’étude d’extension PURSUIT, le bilan des données à long terme est également positif [7]. En cas de C. ulcerosa avec une activité fulminante de la maladie et une réponse insuffisante aux stéroïdes intraveineux, les lignes directrices S3 mises à jour en 2019 recommandent notamment un traitement par infliximab (si possible associé à la thiopurine) [8].
Pour la maladie de Crohn, parmi les représentants des antagonistes du TNFα, outre l ‘adalimumab et l’infliximab, le certolizumab est autorisé depuis peu en Suisse. Dans l’ensemble, les inhibiteurs du TNFα constituent une option de traitement importante pour la maladie ulcéreuse et la maladie de Crohn. Cependant, il est apparu que chez certains patients, le manque de réponse, la baisse d’efficacité ou l’intolérance posaient problème lors de l’utilisation d’anti-TNFα. Pour ces groupes de patients, le vedolizumab, un anticorps anti-intégrine, constitue une alternative [9].
L’INTÉGRINE ANTI-47 : Les lymphocytes T porteurs de l’intégrine-α4β7 se lient aux cellules endothéliales du côlon au moyen de MAdCAM-1 (molécule d’adhésion des cellules vasculaires à l’adressine muqueuse 1). Cela entraîne une invasion des cellules T spécifiques de l’intestin dans la lamina propria, une couche de tissu conjonctif située sous les épithéliums. [23]. Le vedolizumab est un anticorps dirigé contre l’intégrine, qui est autorisé en Suisse depuis 2015 pour la C. ulcéreuse et la maladie de Crohn actives modérées à sévères en cas de réponse insuffisante ou d’intolérance à un traitement conventionnel ou à un traitement par anti-TNFα [1]. Le vedolizumab agit de manière sélective au niveau intestinal et se lie à l’intégrine α4β7d’autres cellules sanguines, les empêchant ainsi de déclencher une réaction inflammatoire dans les tissus intestinaux. Dans une méta-analyse, les taux de rémission sans corticostéroïdes chez les patients atteints de colite ulcéreuse étaient de 26% à la semaine 14 et de 42% à un an [10]. Dans la maladie de Crohn, ces taux étaient respectivement de 25% et 31%. La conclusion des auteurs est que ces données soutiennent le profil bénéfice/risque à long terme du vedolizumab [10].
L’étude VARSITY est la première comparaison directe du vedolizumab et de l’adalimumab chez des patients atteints de la maladie ulcéreuse active modérée à sévère. Le vedolizumab s’est révélé supérieur en termes de rémission clinique. A la semaine 52, 31,3% du bras vedolizumab et 22,5% du bras adalimumab ont obtenu une rémission clinique (p=0,006) selon le score de Mayo. Une guérison de la mucite (critère d’évaluation secondaire) a été observée dans 39,7% des cas sous vedolizumab et dans 27,7% des cas sous adalimumab (p<0,001) [11,12]. En outre, chez les patients naïfs de traitement biologique, l’infliximab et le vedolizumab ont obtenu les meilleurs résultats en termes de rémission clinique et de guérison des muqueuses. Le traitement par vedolizumab a également présenté le taux le plus faible d’événements indésirables graves et d’infections, et son profil d’efficacité et de sécurité était largement conforme à celui des études précédentes.
Le tableau 2 montre dans quels cas l’utilisation d’anti-intégrine/vedolizumab est particulièrement utile.

ANTI-IL12/23 : La voie IL12/IL23 s’est révélée être un facteur important dans la pathogenèse des MIC dans des études d’association pangénomiques [13].
En Suisse, l’ustekinumab (Stelara®) a été autorisé en 2020 pour le traitement de la maladie ulcéreuse, et cette option thérapeutique est déjà sur le marché depuis 2017 pour la maladie de Crohn [14]. L’ustékinumab est un anticorps monoclonal qui bloque simultanément les cytokines pro-inflammatoires IL12 et IL23 en ciblant la sous-unité p40 de cet hétérodimère. Dans le programme d’essais cliniques de phase III UNITI-1 et UNITI-2, l’ustéki-numab s’est avéré efficace à la fois dans la phase d’induction et dans le traitement d’entretien chez les patients atteints de la maladie de Crohn chez qui un traitement conventionnel et un traitement anti-TNF ont échoué [15]. Après une période de 6 semaines, l’ustékinumab a montré une réponse clinique significativement plus élevée (réduction du score CDAI d’au moins 100 points) que le placebo. Les participants à l’étude avaient chacun reçu un traitement d’induction par ustékinumab i.v. à 2 doses (130 mg et 6 mg/kg) ou un placebo. Ceux qui ont répondu au traitement dans les études d’induction UNITI ont été inclus dans l’étude d’entretien IM-UNITI de 44 semaines, dans laquelle ils ont été traités avec 90 mg d’ustékinumab s.c. toutes les 8 semaines, toutes les 12 semaines ou un placebo. Après 44 semaines, 48,8% des patients ont obtenu une rémission clinique dans le groupe traité par ustékinumab 90 mg toutes les 12 semaines, contre 53,1% dans le groupe traité par ustékinumab 90 mg toutes les 8 semaines. Dans la condition placebo, cette proportion était de 35,9%.
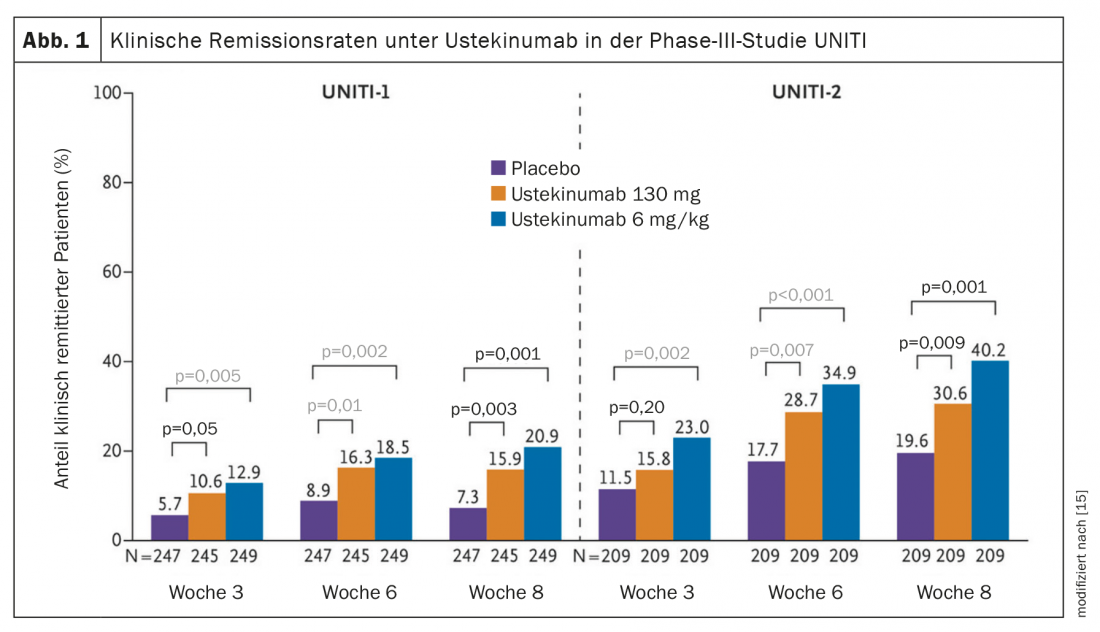
L’efficacité dans la maladie ulcéreuse a été démontrée dans le programme d’étude multicentrique de phase III, en double aveugle et contrôlé par placebo UNIFI (Fig. 1) [15,22]. Dans l’étude d’induction, les participants à l’étude (n=961) ont reçu une dose unique d’ustékinumab par voie intraveineuse, à raison de 130 mg et 6 mg/kg de poids corporel respectivement, ou un placebo. A la semaine 8, 15,6% des patients sous 130 mg et 15,5% sous 6 mg/kg versus 5,3% sous placebo avaient atteint une rémission clinique (score de Mayo ≤2) [15,22]. De plus, les taux de réponse* à la semaine 8 étaient de 56,5% pour les deux doses. La rémission clinique a été atteinte dans 15,6% des cas au cours de cette période. Les patients ayant répondu au traitement d’induction ont été inclus dans l’étude d’entretien de 44 semaines (n=523). Ces participants à l’étude ont été randomisés pour recevoir l’ustékinumab 90 mg s.c. toutes les 8 semaines (q8w), toutes les 12 semaines (q12w) ou un placebo. Une rémission clinique à la semaine 44 (critère d’évaluation principal) a été obtenue dans 43,8% des cas dans le bras q8w et 38,4% dans le bras q12w, contre 24% sous placebo. Une rémission sans prise de stéroïdes a même été obtenue à la semaine 44 chez 42% (q8w) et 37,8% (q12w) respectivement, contre 23,4% dans la condition placebo. De plus, le taux de calprotectine a diminué de manière significative sous ustékinumab (la calprotectine est un marqueur important de l’inflammation dans l’intestin) [16]. Le profil de sécurité de l’ustékinumab était conforme à celui des études précédentes.
* Réduction de ≥30% et ≥3 points dans le score de Mayo avec ≥1 point de réduction dans le sous-score saignement rectal par rapport à la valeur initiale semaine 0
Le tableau 3 montre dans quels cas l’utilisation d’un inhibiteur d’IL12/23 est particulièrement utile.

Les inhibiteurs JAK complètent l’éventail des traitements
Les inhibiteurs de la Janus kinase (JAK), contrairement aux médicaments biologiques, sont fabriqués de manière synthétique. Il s’agit de substances à faible poids moléculaire (“small molecules”). En ce qui concerne le mécanisme d’action, une différence essentielle réside dans le fait que, contrairement aux produits biologiques, les inhibiteurs JAK n’interceptent pas les signaux des cytokines dans l’espace extracellulaire, mais dans l’espace intracellulaire. L’inhibition de la voie de signalisation JAK-STAT permet d’empêcher la réaction pro-inflammatoire en bloquant simultanément plusieurs cytokines. Le début de l’effet est rapide dans la plupart des cas et la forme orale est un facteur de commodité important.
Le premier inhibiteur de JAK autorisé en Suisse pour les CED est le tofacitinib (Xeljanz®), qui est listé depuis 2019 pour le traitement de la C. ulcerosa [21]. Le programme d’essais cliniques OCTAVE (“Oral Clinical Trials for Tofacitinib in ulcerative colitis global development program”) a démontré l’efficacité rapide du tofacitinib [18]. Dès trois jours, une diminution statistiquement significative des saignements rectaux a été observée sous 10 mg de tofacitinib deux fois par jour par rapport au placebo (14,4% vs 8,2% ; p<0,05). Une réduction significative de la fréquence des selles a été observée à 7 jours chez une proportion significativement plus élevée de patients prenant 10 mg de tofacitinib deux fois par jour par rapport au placebo (9,2% vs 2,3% ; p<0,01).

Dans l’étude de phase III U-ACHIEVE évaluant l’efficacité et la sécurité de l’upadacitinib (Rinvoq®) chez des adultes atteints de colite ulcéreuse modérée à sévère, 26% des patients du bras upadicitinib ont obtenu une rémission clinique après 8 semaines, contre 5% dans le bras placebo (p<0,001). De plus, un nombre significativement plus élevé de patients sous upadacitinib ont présenté une amélioration endoscopique à la semaine 8 par rapport au placebo (36% vs 7% ; p<0,001). Le profil de sécurité de l’utacitinib 45 mg était conforme aux études antérieures, aucun nouveau signal de sécurité n’ayant été rapporté [19].
Messages Take-Home
- Les approches modernes de traitement des maladies inflammatoires chroniques de l’intestin (MICI) s’orientent vers la devise “Treat-to-target” (traitement vers la cible). Outre le soulagement des symptômes et l’induction d’une rémission de la maladie, on s’efforce aujourd’hui de préserver la muqueuse du côlon et de la rendre endoscopiquement normale.
- Les médicaments anti-inflammatoires conventionnels couramment utilisés dans les CED comprennent les aminosalicylates (5-ASA), les stéroïdes, les immunosuppresseurs (par exemple, l’azathioprine, la 6-mercaptopurine, le méthotrexate, le tacrolimus, la cyclosporine A).
- En cas de réponse insuffisante, des médicaments biologiques peuvent être utilisés. Outre le traitement par anti-47-intégrine et les représentants des bloqueurs du TNFα, un inhibiteur de l’IL-12/23 est disponible depuis quelques années pour le traitement de la maladie de Crohn, l’ustekinumab, pour lequel une extension d’indication a été accordée en 2020 pour la colite ulcéreuse [14].
- Dans le groupe des “petites molécules”, le tofacitinib est autorisé en Suisse pour le traitement de la colite ulcéreuse [21].


Littérature :
- IBDnet : Réseau suisse de recherche et de communication sur les maladies inflammatoires de l’intestin, www.ibdnet.ch.
- Flamant M, Roblin X : Inflammatory bowel disease : towards a personalized medicine. Therapeutic Advances in Gastroenterology 2018, https://doi.org/10.1177/1756283X17745029
- Biedermann L : State-of-the-art in IBD treatment. A general overview on conventional and advanced treatment options. PD Dr. med. Luc Biedermann, présentation de diapositives, symposium décembre 2020.
- Colombel J-F, et al : Four-year maintenance treatment with adalimumab in patients with moderately to severely active ulcerative colitis : Data from ULTRA 1, 2, and 3. Am J Gastroenterol 2014 ; 109(11) : 1771-1780.
- Sandborn WJ, et al : Le golimumab sous-cutané induit une réponse clinique et une rémission chez les patients atteints de colite ulcéreuse modérée-tosevere. Gastroenterology 2014 ; 146 : 85-95.
- Sandborn WJ, et al : Subcutaneous golimumab maintains clinical response in patients with moderate-to-severe ulcerative colitis. Gastroenterology 2014 ; 146 : 96-109 e1
- Reinisch W : Bénéfice à long terme du golimumab pour les patients atteints de colite ulcéreuse modérée à sévèrement active : résultats de l’extension de maintenance PURSUIT. J Crohns Colitis 2018. doi : 10.1093/ecco-jcc/jjy079. [Epub ahead of print].
- Kucharzik T, et al. : Mise à jour du guide S3 sur la colite ulcéreuse. Août 2019 – Numéro d’enregistrement AWMF : 021-009. www.awmf.org
- Scribano ML : Vedolizumab for inflammatory bowel disease : From randomized controlled trials to real-life evidence. World J Gastroenterol 2018 ; 24(23) : 2457-2467.
- Schreiber S, et al : Systematic review with meta-analysis : real-world effectiveness and safety of vedolizumab in patients with inflammatory bowel disease. J Gastroenterol 2018 ; 53 (9) : 1048-1064.
- Kassenärztliche Bundesvereinigung (KBV) : Médicaments biologiques. Colite ulcéreuse. Édition 04/2020. www.akdae.de/Arzneimitteltherapie/WA/Archiv/Biologika.pdf
- Schreiber S, et al. : J Crohns Colitis 2019 ; 13 (Supplément 1) : S612-613 (Abstract OP34).
- Jostins L, et al : Les interactions hôte-microbe ont façonné l’architecture génétique de la maladie inflammatoire du côlon. Nature 2012 ; 491 : 119-124.
- Information professionnelle Stelara® : www.swissmedicinfo.ch, dernière consultation 04.01.2021
- Feagan BG : Ustekinumab as Induction and Maintenance Therapy for Crohn’s Disease. N Engl J Med 2016 ; 375 : 1946-1960.
- Sands BE, et al. : Sécurité et efficacité du traitement d’induction par utekinumab chez les patients atteints de colite ulcéreuse modérée à sévère : résultats de l’étude UNIFI de phase 3. Paper presented at UEG Week 2018, Vienna, Austria
- USZ : Clinique de gastroentérologie et d’hépatologie, www.gastroenterologie.usz.ch/fachwissen/morbus-crohn-colitits-ulcerosa, dernière consultation 04.01.2021
- Stiefelhagen P : Inhibition des JAK – une nouvelle approche prometteuse. Gastro-News 5, 62 (2018). https://doi.org/10.1007/s15036-018-0464-5
- “Upadacitinib (RINVOQ™) Meets Primary and All Ranked Secondary Endpoints in First Phase 3 Induction Study in Ulcerative Colitis”, AbbVie Inc., 9.12.2020.
- Stallmach A, et al. : Addendum aux lignes directrices S3 sur la maladie de Crohn et la colite ulcéreuse : Prise en charge des patients atteints de maladies inflammatoires chroniques de l’intestin dans la pandémie de COVID-19 – questions ouvertes et réponses. www.awmf.org, dernière consultation 04.01.2021
- Compendium suisse des médicaments : Xeljanz®, www.compendium.ch, dernière consultation 04.01.2021
- Ärzte Zeitung : Ustekinumab : nouvelle option pour la colite ulcéreuse, publié en ligne le 18/10/2019, www.aerztezeitung.de/Medizin/Neue-Option-bei-Colitis-ulcerosa-402582.html
- Roeb E : Colite ulcéreuse : traitement selon la nouvelle ligne directrice. Pharmazeutische Zeitung, 14.02.2019 www.pharmazeutische-zeitung.de/therapie-nach-neuer-leitlinie
PRATIQUE DU MÉDECIN DE FAMILLE 2021 ; 16(1) : 15-18