En raison de la physiopathologie particulière et des options thérapeutiques qui en découlent, le médecin généraliste a un rôle décisif à jouer dans le diagnostic et le traitement des douleurs neuropathiques. Les connaissances essentielles en matière de diagnostic clinique et instrumental et d’options thérapeutiques devraient être familières à tout médecin. Il n’est pas rare qu’il soit nécessaire d’orienter le patient vers des experts en neurologie ou en neurochirurgie ou vers un cabinet ou une clinique interdisciplinaire travaillant de manière multimodale sur la douleur.
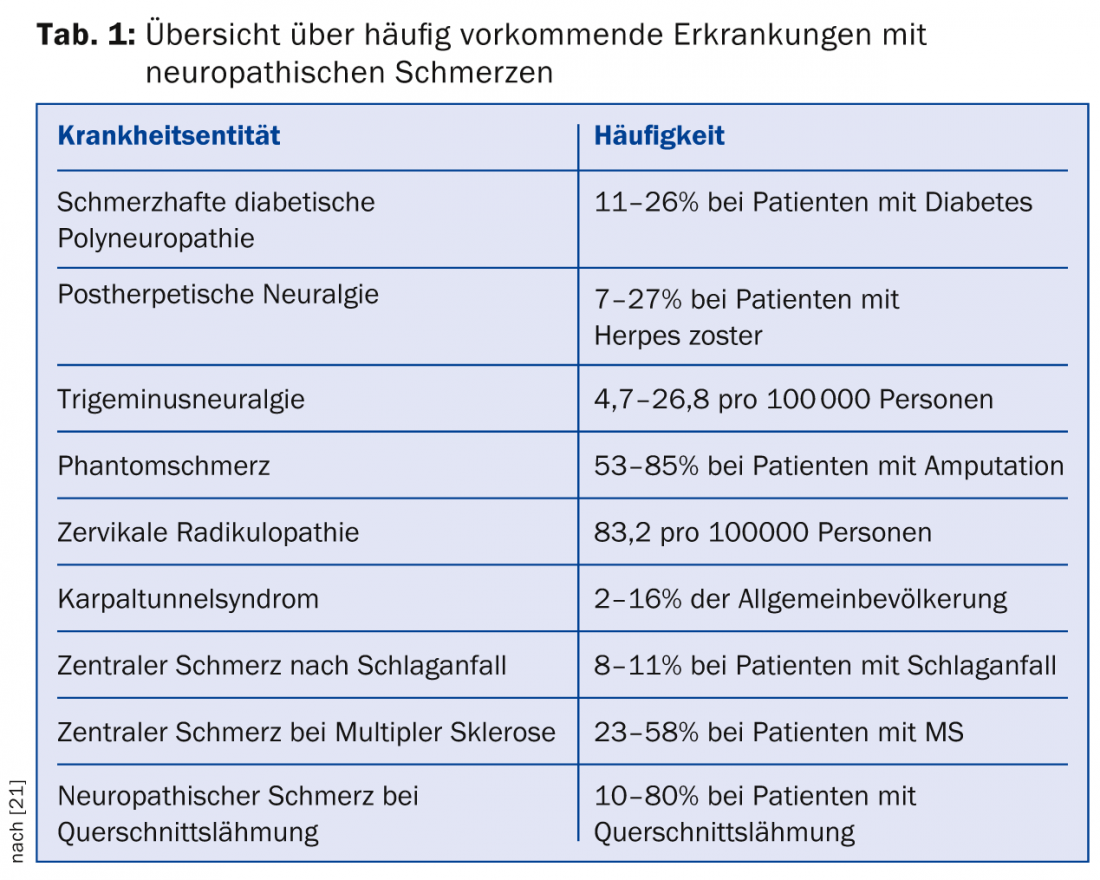
La prévalence des douleurs neuropathiques dans la pratique générale est d’environ 8% ; cette prévalence élevée souligne l’importance du médecin généraliste dans le diagnostic et le traitement de ces symptômes [1]. Le tableau 1 donne un aperçu de la prévalence des maladies courantes associées aux douleurs neuropathiques .
Comment définir la douleur neuropathique ?
La douleur neuropathique est définie par l’Association internationale pour l’étude de la douleur (IASP) comme une “douleur causée par une lésion ou une maladie du système somatosensoriel” [2]. Le système somatosensoriel est la partie du système nerveux qui traite les informations provenant des récepteurs cutanés, articulaires et musculaires et qui transmet la perception des qualités sensorielles telles que la pression, le toucher, la douleur et la température. Il implique les nerfs afférents périphériques, leurs voies centrales de transmission ainsi que les centres de traitement tels que le thalamus et le cortex somatosensoriel.
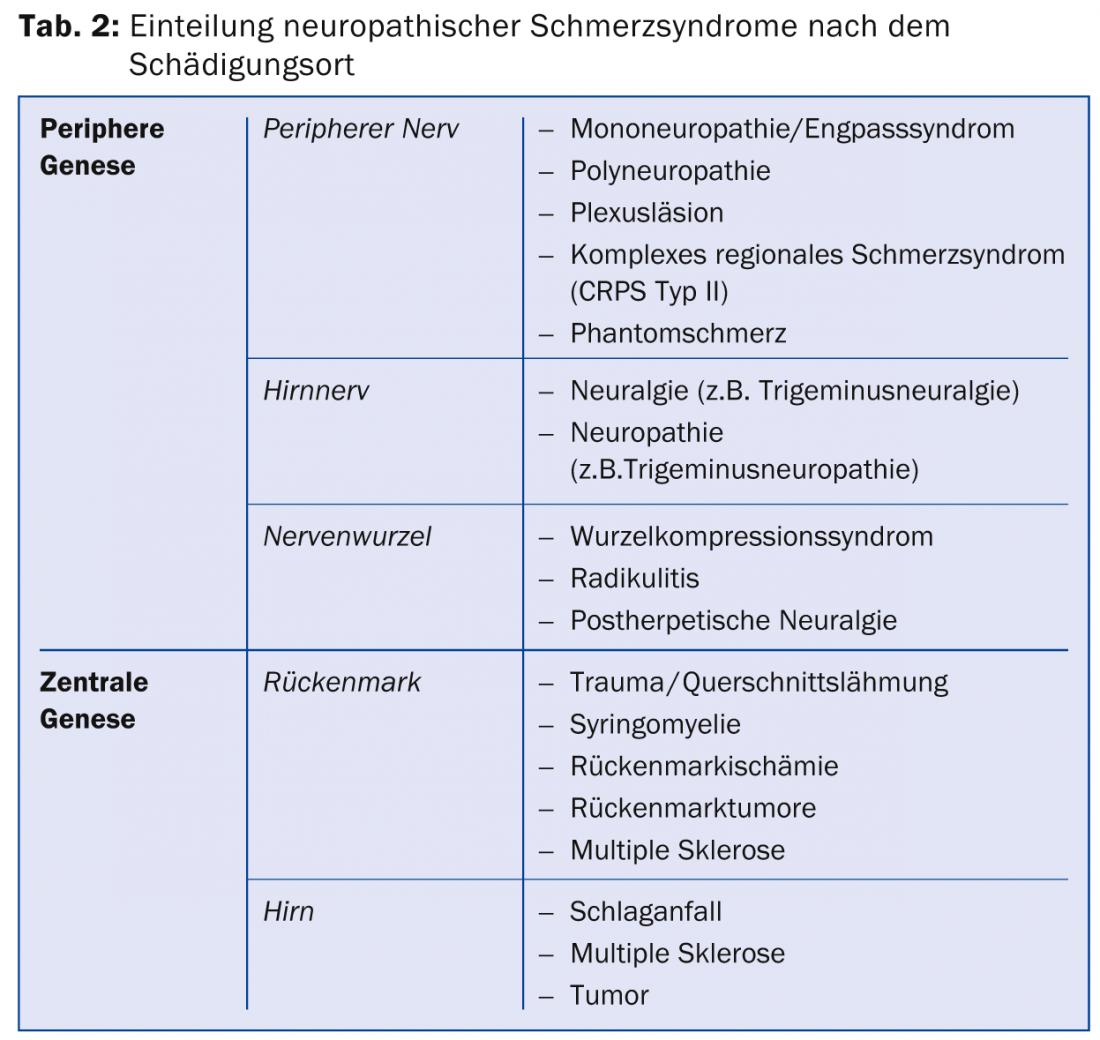
Selon l’emplacement de la lésion nerveuse, il en résulte certains syndromes douloureux neuropathiques (tableau 2). La cause peut varier en fonction de la maladie.
Une forme particulière est le syndrome douloureux régional complexe (abréviation anglaise CRPS) de type I, c’est-à-dire sans lésion nerveuse décelable. Selon les nouveaux critères de diagnostic mentionnés, il ne peut plus être clairement classé parmi les syndromes douloureux neuropathiques, car le lieu de la lésion nerveuse n’est pas clair, bien qu’il existe un certain nombre d’indices de phénomènes neuropathiques. C’est pourquoi des critères de diagnostic spécifiques sont utilisés en prenant en compte les données anamnestiques et les résultats cliniques concernant l’allodynie, l’hyperalgésie, les particularités de la température cutanée, la couleur de la peau, la transpiration, la formation d’œdèmes, la motricité ainsi que la croissance des ongles et des cheveux dans la zone douloureuse en comparaison latérale sans répartition dermatologique certaine [3]. Dans le CRPS de type II, les symptômes sont identiques, mais une lésion nerveuse initiale peut être mise en évidence.
Du pathomécanisme à la douleur neuropathique
Une lésion (par exemple une lésion par compression de la racine nerveuse due à une hernie discale) ou une maladie (par exemple une lésion des fibres nerveuses due à une hyperglycémie en cas de diabète) affectant le système somatosensoriel s’accompagne de la libération de cytokines pro-inflammatoires comme le TNF-α et de facteurs neurotrophiques comme le NGF. Cette libération entraîne la formation de canaux ioniques tels que les canaux Na+ ou encore de récepteurs tels que les récepteurs TRPV1 ou NA (noradrénaline), à la fois sur les cellules nerveuses endommagées et sur les cellules saines voisines. En conséquence, des phénomènes correspondant à des douleurs neuropathiques apparaissent. Par exemple, l’accumulation de canaux Na+ entraîne la formation de ce que l’on appelle l’excitation nerveuse ectopique spontanée, qui se traduit cliniquement par des douleurs électrisantes et lancinantes lorsque les fibres C et A-δ conduisant la douleur sont touchées. En cas d’affection des fibres A-β, qui transmettent des stimuli mécaniques, l’excitation nerveuse ectopique peut se traduire uniquement par des sensations de fourmillement.
Le récepteur TRPV1 est impliqué dans le mécanisme de sensibilisation périphérique. Cliniquement, cette sensibilisation peut se traduire par des douleurs permanentes à type de brûlures ou une hyperalgésie due à la chaleur. Suite à la formation constante de signaux ectopiques par les fibres C endommagées, il se produit également ce que l’on appelle une sensibilisation centrale à l’endroit où la fibre douloureuse périphérique de la corne postérieure de la moelle épinière est commutée sur la voie centrale de la douleur (cordon antérieur). Des mécanismes d’adaptation tels qu’une accumulation accrue de canaux Ca++ et de récepteurs NMDA entraînent une amplification du signal, par exemple une sensation douloureuse accrue de pointe, l’hyperalgésie de Prinprick, ou une sensation douloureuse au toucher, appelée allodynie [4,5].
Diagnostic de la douleur neuropathique
Pour tout patient douloureux en pratique clinique, il convient de s’interroger sur le tableau de la douleur à la recherche d’indices de mécanismes douloureux neuropathiques. Conformément aux lignes directrices européennes pour le diagnostic des douleurs neuropathiques, les points suivants doivent être pris en compte (tableau 3) [6].

Anamnèse : dans l’anamnèse, il convient de vérifier le caractère de la douleur à la recherche d’indices de signes neuropathiques (brûlure, électrisation, fourmillement, constriction). En outre, on examine si la localisation correspond à une répartition neurologiquement plausible (par exemple, répartition dermatomique, syndrome hémisphérique, répartition symétrique distale). Il convient également de rechercher une lésion (par exemple, des signes de hernie discale) ou une maladie (par exemple, le diabète sucré) susceptible de provoquer un syndrome douloureux neuropathique.
Examen clinique : l’examen clinique implique la recherche de signes sensoriels positifs ou négatifs pour les différentes qualités somatosensorielles. La zone douloureuse suspecte est examinée en vue d’une augmentation ou d’une diminution de la sensation de toucher (p. ex. avec un support de coton, un pinceau), d’une augmentation ou d’une diminution de la sensation de douleur (p. ex. avec un stimulus de piqûre d’aiguille) ou d’une augmentation ou d’une diminution de la sensation de température (p. ex. par une stimulation par le froid). En cas d’antécédents de polyneuropathie, l’examen se fait en comparant la partie proximale (cuisse) à la partie distale (dos du pied) [7].
Diagnostic instrumental : d’autres tests de diagnostic peuvent être effectués pour vérifier le dysfonctionnement neurologique sous-jacent, par exemple l’imagerie en cas de suspicion de douleur après un accident vasculaire cérébral ou de suspicion de hernie discale, ou des examens neurophysiologiques pour confirmer une lésion nerveuse (par exemple, suspicion de radiculopathie, de syndrome du canal carpien ou de polyneuropathie).
Plus il y a d’indices, plus le diagnostic de suspicion de douleur neuropathique peut être évalué avec certitude. Si le diagnostic est incertain ou peu clair, le patient doit être présenté à un neurologue ou à un centre de la douleur. Les centres de la douleur disposent d’outils de diagnostic spécifiques tels que les tests sensoriels quantitatifs (QST), les potentiels évoqués par la chaleur de contact (CHEPS), les potentiels évoqués par laser (LEP) ou la biopsie cutanée, qui permettent par exemple d’étudier la fonction des petites fibres nerveuses conduisant la douleur, telles que les fibres A-δ et les fibres C, et de confirmer ou d’infirmer le diagnostic de douleur neuropathique [7,8]. L’échographie prend de plus en plus d’importance dans la recherche d’une lésion nerveuse focale des nerfs périphériques [9].
Diagnostic différentiel important nociceptif vs. neuropathique
Dans un premier temps, un patient peut se présenter avec un problème circonscrit, par exemple une douleur au dos ou à la jambe. L’examen clinique suggère une radiculopathie avec des indices de hernie discale à l’IRM. Bien que le diagnostic et le traitement semblent ici simples, il faut toujours regarder plus loin. Il n’est pas rare de constater que le tableau clinique à première vue monosymptomatique n’est que la partie émergée d’une maladie douloureuse chronique multiloculaire ; il est possible que plusieurs opérations du dos aient déjà été effectuées, par exemple. Chez le patient souffrant de douleurs chroniques, le diagnostic clair de douleur neuropathique en cas de radiculopathie ne peut donc jouer qu’un rôle secondaire, car d’autres aspects biopsychosociaux de la chronicité de la douleur viennent s’y ajouter, ce qui se traduit par le fait que les options thérapeutiques que nous connaissons ne sont que peu efficaces.
Les facteurs biologiques peuvent être l’événement neurologique initial qui, avec les facteurs musculaires, acquiert une composante myofasciale ou nociceptive en raison d’une mauvaise posture. Les facteurs psychologiques sont par exemple une évolution dépressive qui en résulte et des concepts de maladie inadéquats, les facteurs sociaux reflètent l’interaction de la douleur dans la vie professionnelle et privée. Dans ce contexte, le diagnostic différentiel concernant les douleurs myofasciales nociceptives est important. Il faut toujours essayer de faire ressortir la composante nociceptive de la douleur.
Les signes de douleur nociceptive sont des douleurs qui s’intensifient ou s’atténuent en fonction du mouvement ou qui se modifient en fonction du changement de position. En général, on trouve une sensibilité à la pression des structures musculo-squelettiques, mais l’imagerie n’indique pas toujours une pathologie liée au squelette. Typiquement, les patients décrivent la douleur comme sourde, oppressante ou tirante. La description des douleurs à type de brûlure doit être remise en question, car elle n’est pas pathognomonique des douleurs neuropathiques – les douleurs myofasciales sont souvent décrites comme des douleurs à type de brûlure.
Il faut également distinguer les douleurs soudaines : Une douleur survenant uniquement lors d’un mouvement est plutôt corrélée à une douleur nociceptive, alors que la douleur survenant de manière neuropathique survient typiquement au repos, surtout le soir ou la nuit. Cette distinction importante se reflète dans la littérature récente, dans laquelle il existe un certain nombre de propositions de classification de la douleur pour différentes maladies neurologiques, par exemple la classification de la douleur en cas d’accident vasculaire cérébral [10], en cas de paraplégie [11] et en cas de sclérose en plaques [12]. Ces classifications soulignent que même en cas de maladie neurologique sous-jacente, la douleur n’est pas nécessairement neuropathique.
Le syndrome de la douleur persistante après une intervention chirurgicale (persistent post surgical pain/PPSP), dont il est de plus en plus question dans la littérature actuelle, occupe une place particulière [13]. Le PPSP, dont l’incidence est de 14,8% après une intervention chirurgicale, est mal compris sur le plan physiopathologique et présente des aspects à la fois nociceptifs et neuropathiques [14,15]. Les syndromes que nous connaissons, tels que la douleur post-mastectomie, la douleur post-thoracotomie, la douleur post-herniotomie et autres, en font partie.
Aspects thérapeutiques multimodaux
En présence d’un tableau douloureux complexe, les différentes composantes de la douleur doivent également être traitées de manière spécifique ou le patient doit être adressé à un cabinet ou à une clinique de la douleur travaillant de manière interdisciplinaire et multimodale. -Le patient doit être adressé à la clinique de l’hôpital. En ce qui concerne les priorités thérapeutiques, le traitement médicamenteux antineuropathique, la kinésithérapie et la gestion psychologique de la douleur devraient être sur un pied d’égalité. En outre, la thérapie interventionnelle de la douleur peut apporter une contribution importante sur le plan diagnostique et thérapeutique. Cependant, les données actuelles montrent que l’efficacité des mesures interventionnelles en médecine de la douleur repose sur des preuves faibles [16], de sorte que ces mesures thérapeutiques devraient être mises en œuvre dans des cabinets ou des cliniques spécialisés dans la douleur et disposant d’une expertise dans ce domaine. Par exemple, il n’existe que de faibles recommandations pour les injections épidurales en cas de zona, les injections de stéroïdes en cas de radiculopathie et l’application d’un stimulateur de la moelle épinière en cas de “syndrome de la chirurgie échouée du dos” (douleurs inchangées dans le dos et les jambes après une opération du dos) ou de “syndrome de la chirurgie échouée du dos”. dans le CRPS de type I. Pour un certain nombre de procédures de thérapie interventionnelle pour différentes pathologies, les données ne sont pas concluantes [16].
Principes de base de la thérapie médicamenteuse
Les mécanismes physiopathologiques peuvent être utilisés à des fins pharmacothérapeutiques en ciblant les antagonistes Na+ (par ex. carbamazépine, oxcarbazépine, lamotrigine), les modulateurs des canaux Ca++ (gabapentine, prégabaline) ou encore les antagonistes TRPV1 (capsaïcine) contre les douleurs neuropathiques. En outre, les voies spinales inhibitrices descendantes, qui ont leur origine dans le tronc cérébral et inhibent la transmission des stimuli douloureux dans la moelle épinière, peuvent être utilisées à des fins thérapeutiques. Les tricycliques (amitriptyline) et les inhibiteurs de la recapture de la sérotonine et de la noradrénaline (duloxétine, venlafaxine) ont un effet analgésique en renforçant cette inhibition. Les opiacés inhibent la transmission des signaux de douleur en se liant aux récepteurs µ ou kappa, ils peuvent donc également être utilisés pour traiter les douleurs neuropathiques. Les opiacés plus récents, tels que le tapentadol et la buprénorphine, peuvent être supérieurs aux opiacés traditionnels, car le tapentadol exerce une action supplémentaire d’inhibition descendante (liaison aux récepteurs de la noradrénaline) et la buprénorphine a une propriété supplémentaire de blocage des canaux K+. Le tramadol inhibe également les voies inhibitrices descendantes. En cas de mononeuropathies douloureuses circonscrites, telles que la névralgie post-zostérienne, la lidocaïne en gel à 5%, qui agit comme un bloqueur des canaux Na+, peut être appliquée par voie topique.
En fonction du mécanisme de douleur sous-jacent, il convient également d’envisager des thérapies causales, par exemple le contrôle optimal de la glycémie chez le diabétique ou des interventions chirurgicales (opération de Janetta pour la névralgie du trijumeau, décompression pour la hernie discale).
Les objectifs du traitement médicamenteux sont une réduction de la douleur de plus de 50%, une amélioration de la qualité du sommeil, le maintien de l’activité sociale et des relations sociales ainsi que le maintien de la capacité de travail. Pour cela, il est nécessaire de titrer les médicaments à action antineuropathique en tenant compte de leur effet et de leurs effets secondaires, avec une durée de traitement suffisante et une dose suffisamment élevée. Il est également souvent nécessaire de recourir à des thérapies combinées de différents groupes de substances actives.
Traitement médicamenteux des douleurs neuropathiques d’origine périphérique et centrale
Les guidelines suisses actuelles pour le traitement des douleurs neuropathiques [7] sont en accord avec les guidelines internationales [17,18]. Pour le traitement général des douleurs neuropathiques générées en périphérie, les tricycliques, les modulateurs des canaux calciques et les inhibiteurs sélectifs de la recapture de la sérotonine et de la noradrénaline (IRSN) sont des agents thérapeutiques de premier choix (tableau 4) [17]. Les opiacés peuvent être utilisés comme médicaments de deuxième intention. En termes d’efficacité, les opiacés ne diffèrent pas des médicaments de première intention, mais ils ont un taux d’effets secondaires plus élevé en comparaison avec les tricycliques et la gabapentine, et il existe un risque d’hyperalgésie potentielle induite par les opiacés ou de développement d’une dépendance aux opiacés.
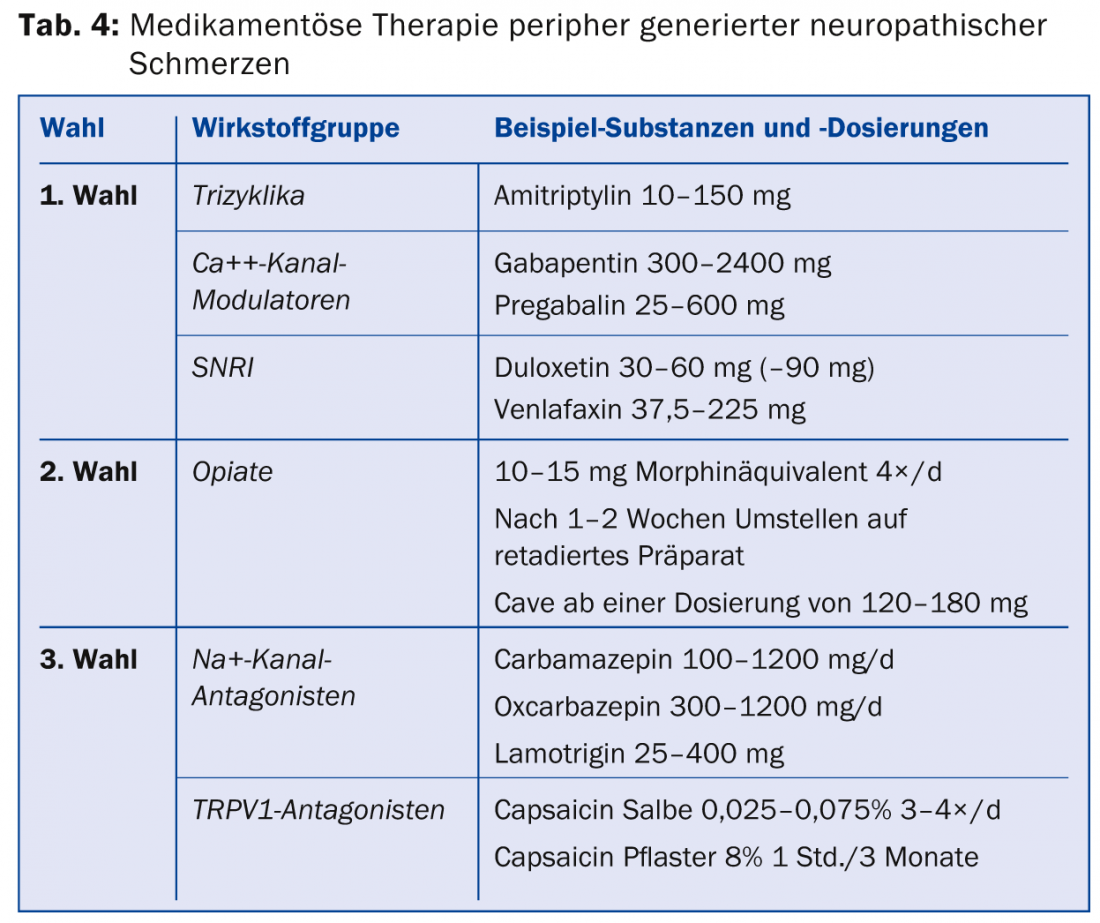
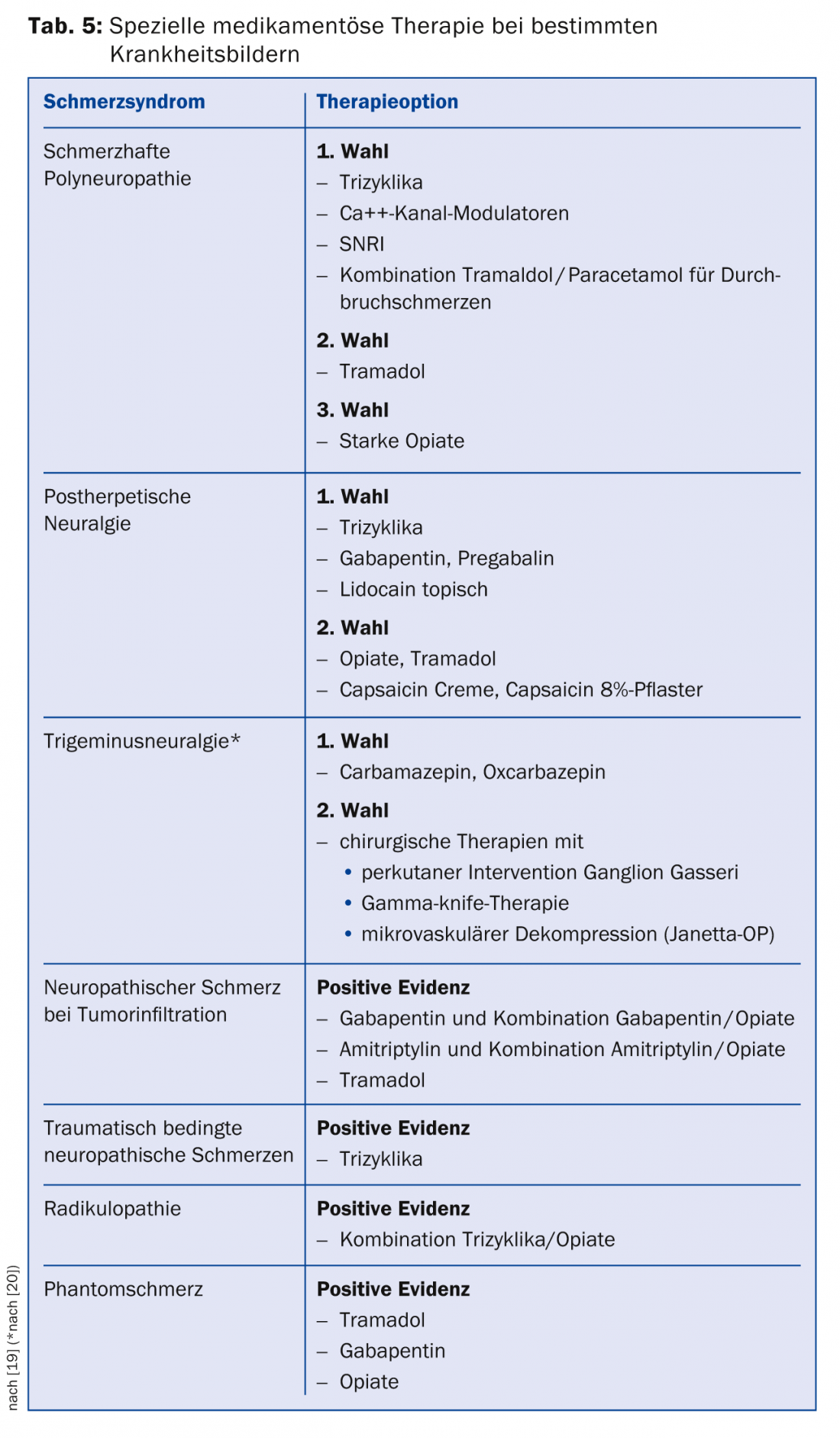
Si ces médicaments ne permettent pas de soulager suffisamment la douleur, il existe des traitements de troisième intention pour lesquels il n’existe qu’une seule étude positive ou pour lesquels les données sont incohérentes. Les représentants de cette classe sont les antagonistes des canaux Na+, les inhibiteurs sélectifs de la recapture de la sérotonine (ISRS), les analogues de la lidocaïne et également la capsaïcine. En Suisse, la capsaïcine (patch à 8%) est autorisée pour le traitement des douleurs neuropathiques périphériques chez les adultes qui ne souffrent pas de diabète. Pour être remboursé par la caisse d’assurance maladie, il faut le plus souvent présenter une demande de garantie de prise en charge des frais. La capsaïcine doit être appliquée dans les cabinets de traitement de la douleur. Il existe des recommandations spécifiques pour certaines pathologies (tableau 5) [19].
Pour le traitement des douleurs neuropathiques d’origine centrale, les options sont plus limitées [8]. Les tricycliques sont des traitements de première intention pour les douleurs post-AVC et les modulateurs des canaux Ca++ pour les douleurs post-lésionnelles de la moelle épinière. Les médicaments de deuxième intention disponibles en cas d’AVC et de paraplégie incomplète avec allodynie sont le tramadol et les opiacés forts ainsi que la lamotrigine, et en cas de sclérose en plaques, les cannabinoïdes, mais uniquement après l’échec d’autres traitements (tableau 6) .

Si ces médicaments ne sont pas efficaces ou s’il existe des contre-indications, il est possible de recourir aux médicaments de première et deuxième intention pour les douleurs neuropathiques générées en périphérie.
Conclusion pour la pratique
- La connaissance des signes sensoriels positifs et négatifs est importante pour le diagnostic clinique des douleurs neuropathiques.
- Le diagnostic de suspicion de douleurs neuropathiques doit être posé dès le cabinet du médecin généraliste.
- Pour confirmer le diagnostic, il est souvent indiqué de procéder à un examen neurologique et, dans les cas peu clairs ou résistants au traitement, d’adresser le patient à un cabinet ou à une clinique interdisciplinaire spécialisée dans la douleur.
- Le diagnostic différentiel entre les douleurs nociceptives et neuropathiques joue également un rôle dans les maladies neurologiques primaires.
- Le traitement des douleurs neuropathiques nécessite souvent une équipe interdisciplinaire et multimodale.
- Les tricycliques, les IRSN et les modulateurs des canaux Ca++ sont disponibles pour le traitement de première intention des douleurs neuropathiques générées en périphérie.
- Pour le traitement des douleurs neuropathiques d’origine centrale, les options de premier choix sont les tricycliques et les modulateurs des canaux Ca++.
- Bien que les preuves de la thérapie interventionnelle de la douleur soient limitées, celle-ci peut aider à la prise en charge diagnostique et thérapeutique des patients douloureux.
Littérature :
- Torrance N, et al : The epidemiology of chronic pain of predominantly neuropathic origin. Résultats d’une enquête de population générale. The journal of pain : official journal of the American Pain Society 2006 ; 7(4) : 281-289.
- Treede RD, et al : Neuropathic pain : redefinition and a grading system for clinical and research purposes. Neurology 2008 ; 70(18) : 1630-1635.
- Harden RN : Proposed new diagnostic criteria for complex reghilan pain syndrome. Médecine de la douleur 2007 ; 8(4) : 326-331.
- Baron R : Douleurs neuropathiques. Anesthésiste 2000 ; 49 : 373-386.
- Baron R, Freynhagen R : Compendium de la douleur neuropathique. 2e édition, Éditions Ésope, 2006.
- Cruccu G, et al : EFNS guidelines on neuropathic pain assessment : revised 2009. Eur J Neurol 2010 ; 17(8) : 1010-1018.
- Renaud R, et al : Douleurs neuropathiques chroniques Recommandations du groupe de travail (Special Interest Group, SIG) de la Société suisse pour l’étude de la douleur (SGSS). Forum Médical Suisse 2011 ; 11(Suppl. 57) : 3-19.
- Gosrau G, et al. : Méthodes de mesure électrophysiologiques dans le traitement de la douleur. Douleur 2008 ; 22 : 471-481.
- Böhm J, Schelle T : Place de l’échographie à haute résolution dans le diagnostic des maladies nerveuses périphériques. Akt Neurol 2013 ; 40(05) : 258-268.
- Klit H, et al : Central post-stroke pain : clinical characteristics, pathophysiology, and management. Lancet Neurol 2009 ; 8(9) : 857-868.
- Bryce TN, et al : International spinal cord injury pain classification : part I. Background and description. Spinal Cord 2012 ; 50(6) : 413-417.
- Truini A, et al : Mécanismes de la douleur dans la sclérose en plaques : une étude combinée clinique et neurophysiologique. Pain 2012 ; 153(10) : 2048-2054.
- Werner MU, Kongsgaard UE. Définir la douleur post-opératoire persistante : une mise à jour est-elle nécessaire ? Br J Anaesth 2014 ; 113(1) : 1-4.
- Simanski CJ, et al : Incidence de la douleur chronique post-urgicale (CPSP) après une chirurgie générale. Pain medicine (Malden, Mass) 2014 ; 15(7) : 1222-1229.
- Haroutiunian S, et al : The neuropathic component in persistent postsurgical pain : a systematic literature review. Pain 2013 ; 154(1) : 95-102.
- Dworkin RH, et al : Interventional management of neuropathic pain : NeuPSIG recommendations. Pain 2013 ; 154(11) : 2249-2261.
- Dworkin RH, et al : Pharmacologic management of neuropathic pain : evidence-based recommendations. Pain 2007 ; 132(3) : 237-251.
- O’Connor AB, Dworkin RH : Treatment of neuropathic pain : an overview of recent guidelines. Am J Med 2009 ; 122(10 Suppl) : S22-32.
- Attal N, et al : EFNS guidelines on the pharmacological treatment of neuropathic pain : 2010 revision. Eur J Neurol 2010 ; 17(9) : 1113-1188.
- Cruccu G, et al : AAN-EFNS guidelines on trigelminal neuralgia management. Eur J Neurol 2008 ; 15(10) : 1013-1028.
- Sadosky A, et al : A review of the epidemiology of painful diabetic peripheral neuropathy, postherpetic neuralgia, and less commonly studied neuropathic pain conditions. Pain practice : the official journal of World Institute of Pain 2008 ; 8(1) : 45-56.
PRATIQUE DU MÉDECIN DE FAMILLE 2015 ; 10(1) : 14-21