L’identification et l’étude de biomarqueurs moléculaires peuvent contribuer à décomposer le phénotype complexe de la dermatite atopique en sous-phénotypes. L’un des objectifs à long terme de cette recherche translationnelle est la stratification et la sélection des patients sur la base de biomarqueurs diagnostiques, pronostiques et prédictifs comme base d’une stratégie thérapeutique individuelle optimale.
De nombreuses publications récentes abordent le thème des approches de recherche translationnelle dans le contexte de la dermatite atopique (DA). Parmi eux, une revue publiée dans Cellular & Molecular Immunology 2023 par Facheris et al. et une revue de Balato et al. publiée dans Life 2022 [1,2]. Voici un résumé de quelques-unes des principales conclusions qui y sont abordées [1,2].
Recherche translationnelle pour des approches thérapeutiques personnalisées
Les progrès récents dans la compréhension de la pathogenèse de la MA ont révolutionné la recherche translationnelle et conduit à un élargissement exponentiel du pipeline thérapeutique [1]. Outre les produits biologiques (dupilumab, tralokinumab) et les inhibiteurs de JAK (baricitinib, upadacitinib, abrocitinib) déjà autorisés, de nombreuses autres substances actives innovantes, telles que des produits biologiques et des “petites molécules”, sont actuellement en cours de développement dans le domaine de la dermatite atopique. Il s’agit notamment du lebrikizumab (anti-IL13), du nemolizumab (anti-31-R), du tezepelumab (anti-TSLP), des anti-Ox-40-Ak ainsi que du brepocitinib (inhibiteur topique de TYK2/JAK1) et des modulateurs des récepteurs arylhydrocarbonés [1,2]. Partant du principe que l’hétérogénéité des symptômes et de l’évolution de la maladie reflète des différences fondamentales au niveau moléculaire, il sera possible à l’avenir d’identifier des sous-groupes de patients présentant différents sous-types de la maladie et réagissant différemment à certaines thérapies.
| Projets de recherche translationnelle Le projet “BIOMAP “* (Biomarkers in Atopic Dermatitis and Psoriasis) [14] étudie les causes et les mécanismes de la DA et du psoriasis dans le but d’identifier les biomarqueurs responsables de la variation de l’évolution de la maladie. Le projet “CHAMP”$ (CHildhood Allergy and tolerance : bioMarkers and Predictors) [15] se concentre sur l’étude des déterminants de différentes maladies allergiques (allergie alimentaire, dermatite atopique, asthme, rhume des foins) de la naissance à l’adolescence. Une attention particulière est accordée aux facteurs qui déterminent la tolérance primaire (= absence d’apparition de maladies) et la tolérance acquise (= rémission de maladies existantes). Le projet d’étude identifiera des biomarqueurs cliniquement pertinents qui permettront de prédire un début précoce, ainsi que la progression et la rémission. |
* Durée : 01.04.2019-31.03.2024 $ Durée : 2017-2022 |
MA : physiopathologie multifactorielle avec prédisposition génétique
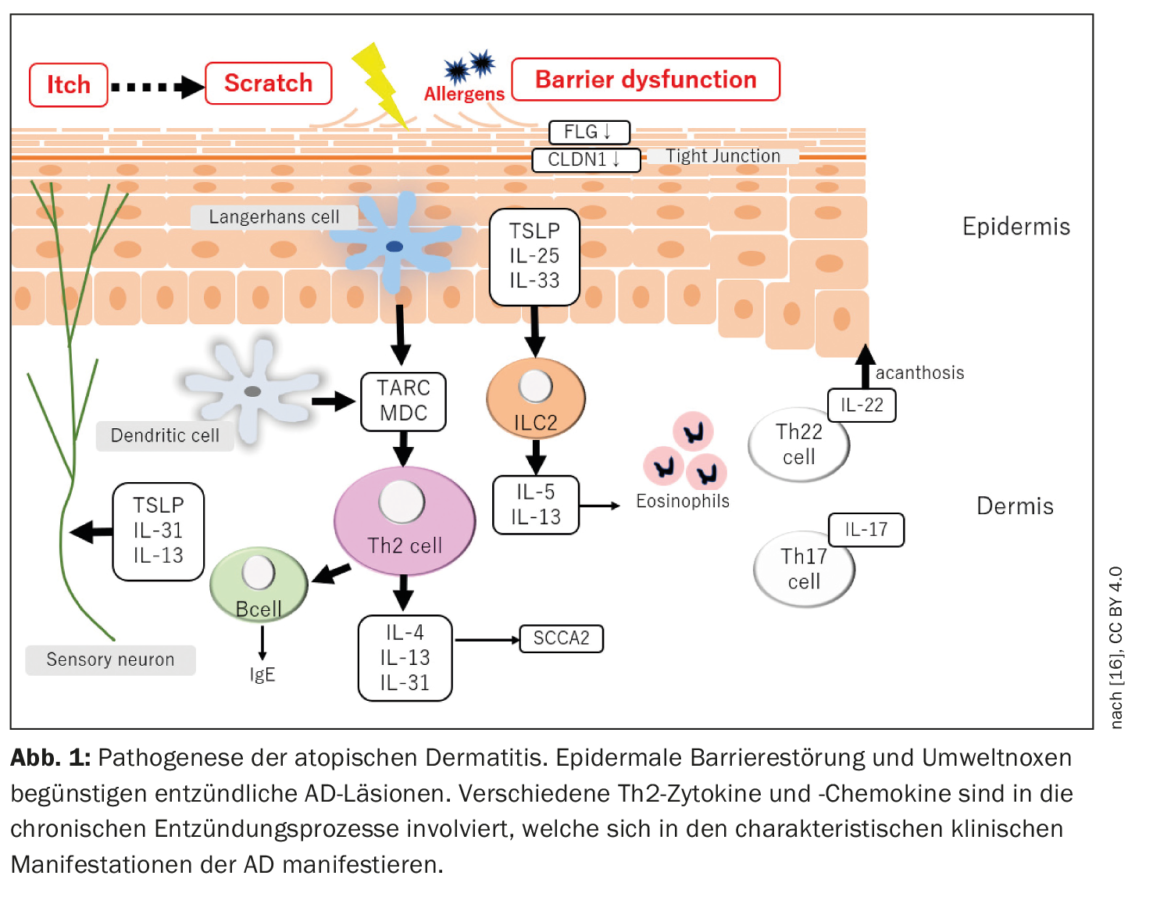
La dermatite atopique se caractérise par une évolution chronique et récurrente par poussées, avec un début de la maladie dans la petite enfance. Les “flares” aigus s’accompagnent de lésions cutanées inflammatoires et de fortes démangeaisons, de sorte que la qualité de vie des patients est considérablement affectée [3]. La physiopathologie de la DA est complexe (Fig. 1) : Les interactions entre une fonction de barrière cutanée altérée et des réponses immunitaires modifiées contribuent à l’apparition et au maintien de la maladie [2].
On sait qu’une prédisposition génétique est une condition préalable à l’apparition de la MA. Le facteur de risque génétique le plus connu est une mutation dans le gène FLG, qui entraîne une réduction de l’expression de la filaggrine dans la peau et un dysfonctionnement de la barrière épidermique associé [4]. Outre le FLG, plus de 30 loci génétiques ont été identifiés comme étant associés à la MA [5,6]. De plus, des variantes dans le gène de l’IL-13 ou dans la région du récepteur de l’IL-6, ainsi que plusieurs variantes rares codant pour des protéines, expliquent près de 30% de la susceptibilité génétique à la MA [7]. La MA est considérée comme une maladie à médiation Th2, ce qui est étayé par des résultats montrant des concentrations élevées de médiateurs Th2 et des niveaux réduits d’IFN-γ dans le sang des patients atteints de MA sévère [1,8]. Plusieurs études ont confirmé que les lésions de la MA sont principalement, mais pas exclusivement, médiées par Th2 et sont associées à une surproduction de cytokines et de chimiokines Th2 importantes. Mais Th22 semble également impliqué, ce qui se traduit par une surproduction d’IL-22, tandis que l’implication des axes Th1 et Th17 varie apparemment en fonction de l’endophénotype de la MA [1].
L’identification de biomarqueurs cliniquement pertinents reste un défi
Les projets de recherche de biomarqueurs cliniquement pertinents utilisent les derniers développements techniques en médecine translationnelle dans le but lointain d’améliorer les possibilités de traitement et la “gestion de la maladie”.
L’un des critères des biomarqueurs moléculaires est qu’ils peuvent être détectés et mesurés dans le sang, dans d’autres fluides corporels ou dans les tissus et qu’ils peuvent être utilisés comme indicateurs de processus liés à la maladie dans l’organisme [9].
Actuellement, on connaît au moins 18 biomarqueurs détectables dans le sang/sérum qui sont associés à l’activité de la maladie de la MA, comme par exemple le taux de granulocytes éosinophiles, de lactate déshydrogénase, d’IgE totales ou de récepteur soluble de l’IL-2 [10]. En outre, plusieurs chimiokines# (CCL17, CCL18, CCL22, CCL26, CCL27) et interleukines (IL-13, IL-22, IL-24, IL-25, IL-31, IL-33), ainsi que le “Thymic Stromal Lymphopoietint” (TSLP), la périostine et l’antigène-2 du carcinome épidermoïde sont considérés comme des biomarqueurs dans la MA [10]. CCL18, TSLP et CCL26 ont été associés à l’asthme comorbide dans une étude danoise chez des enfants atteints de la MA [11]. Les chercheurs ont étudié quatre groupes d’enfants âgés de 6 à 12 ans : (1) AD ancienne ou actuelle sans asthme, (2) AD ancienne ou actuelle et asthme actuel, (3) asthme actuel sans AD. (4) des contrôles sains. Une étude clinique exploratoire a été menée pour déterminer quels biomarqueurs sont associés à la réponse thérapeutique à l’inhibition du récepteur α de l’IL-4 par l’anticorps monoclonal dupilumab dans la MA modérée à sévère. Il a été démontré que le dupilumab réduisait l’expression accrue des signatures Th2 telles que IL-13, IL-31, CCL17, CCL18, CCL22 et CCL26 dans le sang et la peau lésionnelle de AD [12,13]. Balato et al. indiquent que des études supplémentaires sont nécessaires pour mieux comprendre les associations possibles entre ces biomarqueurs et l’évolution de la maladie et du traitement de la MA [2].
# Les chimiokines sont un sous-groupe des cytokines ; ce sont de petites protéines (8-10 kDa) à effet chimiotactique (protéines de signalisation).
Littérature :
- Facheris P, et al : The translational revolution in atopic dermatitis : the paradigm shift from pathogenesis to treatment. Cell Mol Immunol 2023,
https://doi.org/10.1038/s41423-023-00992-4,(dernière consultation 24.02.2023). - Balato A, et al : The Impact of Psoriasis and Atopic Dermatitis on Quality of Life : A Literature Research on Biomarkers. Life. 2022 ; 12(12) : 2026.
- Arima K, et al. : Burden of atopic dermatitis in Japanese adults : Analysis of data from the 2013 National Health and Wellness Survey. J Dermatol 2018 ; 45, 390-396.
- Irvine AD, et al : Mutations de la filaggrine associées à des maladies cutanées et allergiques. N Engl J Med 2011 ; 365 : 1315-1327.
- Ellinghaus D, et al : High-density genotyping study identifies four new susceptibility loci for atopic dermatitis. Nat Genet 2013 ; 45 : 808-812.
- Løset M, et al. : Génétique de la dermatite atopique : de la séquence d’ADN à la pertinence clinique. Dermatology 2019 ; 235 : 355-364.
- Mucha S, et al : Les variants de codage des protéines contribuent au risque de dermatite atopique et à l’expression génétique spécifique de la peau. J Allergy Clin Immunol 2020, 145, 1208-1218.
- Gittler JK, et al : L’activation progressive des cytokines T(H)2/T(H)22 et des protéines épidermiques sélectives caractérise la dermatite atopique aiguë et chronique. J Allergy Clin Immunol 2012 ; 130 : 1344-1354.
- Agence européenne des médicaments (EMA). Qualification de nouvelles méthodologies pour le développement de la médecine. Réglementation humaine. Recherche et développement. Opinions et lettres de soutien sur la qualification de nouvelles méthodologies pour le développement de la médecine. Disponible en ligne : www.ema.europa.eu/en/glossary/biomarker,(dernière consultation 24.03.2023).
- Nakahara T, et al : Exploration des biomarqueurs pour prédire l’amélioration clinique de la dermatite atopique chez les patients traités par dupilumab : un protocole d’étude. Medicine 2020 ; 99 : e22043.
- Basu MN, et al : Biomarkers in asthma in the context of atopic dermatitis in young children. Pediatr Allergy Immunol 2022 ; 33 : e13823.
- Guttman-Yassky E, et al : Dupilumab améliore progressivement les anomalies systémiques et cutanées chez les patients atteints de dermatite atopique. J Allergy Clin Immunol 2019 ; 143 : 155-172.
- Hamilton JD, et al : Dupilumab améliore la signature moléculaire dans la peau des patients atteints de dermatite atopique modérée à sévère. J Allergy Clin Immunol 2014 ; 134 : 1293-1300.
- Precision Medicine in Chronic Inflammation, www.precisionmedicine.de/fileadmin/user_upload/cluster/pmi/downloads/PMI-Magazin2021_digital_Doppelseiten.pdf,(dernière consultation 24.03.2023)
- BMFB : CHAMP – Allergie et tolérance chez l’enfant : biomarqueurs et prédicteurs, www.gesundheitsforschung-bmbf.de/de/champ-allergie-und-toleranz-im-kindesalter-biomarker-und-pradiktoren-7268.php,(dernière consultation 24.03.2023)
- Itamura M, Sawada Y : Implication de la dermatite atopique dans le développement des maladies inflammatoires systémiques. International Journal of Molecular Sciences. 2022 ; 23(21) : 13445, www.mdpi.com/1422-0067/23/21/13445,(dernière consultation 23.03.2023).
DERMATOLOGIE PRATIQUE 2023 ; 33(2) : 28-29