Chez les patients chez qui l’on soupçonne une embolie pulmonaire, il est important de stratifier le risque, car cela oriente toutes les décisions thérapeutiques ultérieures. Les patients à haut risque présentant une instabilité hémodynamique doivent être identifiés sans délai afin de mettre en place immédiatement un traitement thrombolytique systémique en l’absence de contre-indications (grade 1B). L’embolectomie par cathéter (grade 2aC) ou chirurgicale (grade 1C) est recommandée chez les patients à haut risque présentant une contre-indication ou un échec à la thrombolyse systémique. La thrombolyse systémique ne doit pas être utilisée de manière systématique en l’absence de situation à haut risque (grade 3B). La thrombolyse (grade 2aB) ou la thrombolyse assistée par cathéter (grade 2bB) peut être envisagée chez les patients à risque intermédiaire-élevé sans instabilité hémodynamique, notamment en cas d’aggravation clinique sous anticoagulation seule.
L’embolie pulmonaire est une maladie potentiellement mortelle, avec un taux de mortalité pouvant atteindre 17% au cours des trois premiers mois [1]. Au cours de cette première phase, la survie dépend principalement de l’état hémodynamique et de la dysfonction du ventricule droit. Il est donc important d’identifier immédiatement les patients qui sont particulièrement à risque. C’est cette stratification des risques que nous allons mettre en lumière dans cet article. En fonction du groupe à risque, des recommandations sont émises quant au traitement : thrombolyse systémique, traitement par cathéter ou embolectomie chirurgicale. Ces stratégies de traitement spécifiques à chaque groupe à risque sont également discutées dans le présent article. L’article s’appuie sur les recommandations actuelles des ESC Guidelines de 2014 [2].
Stratification des risques
Tout d’abord, il est important d’identifier les patients qui présentent un risque élevé de mortalité, en particulier dans la phase précoce de l’embolie pulmonaire (Fig. 1). Le risque de mortalité pour ces patients à haut risque est estimé jusqu’à 24,5% [3,4].
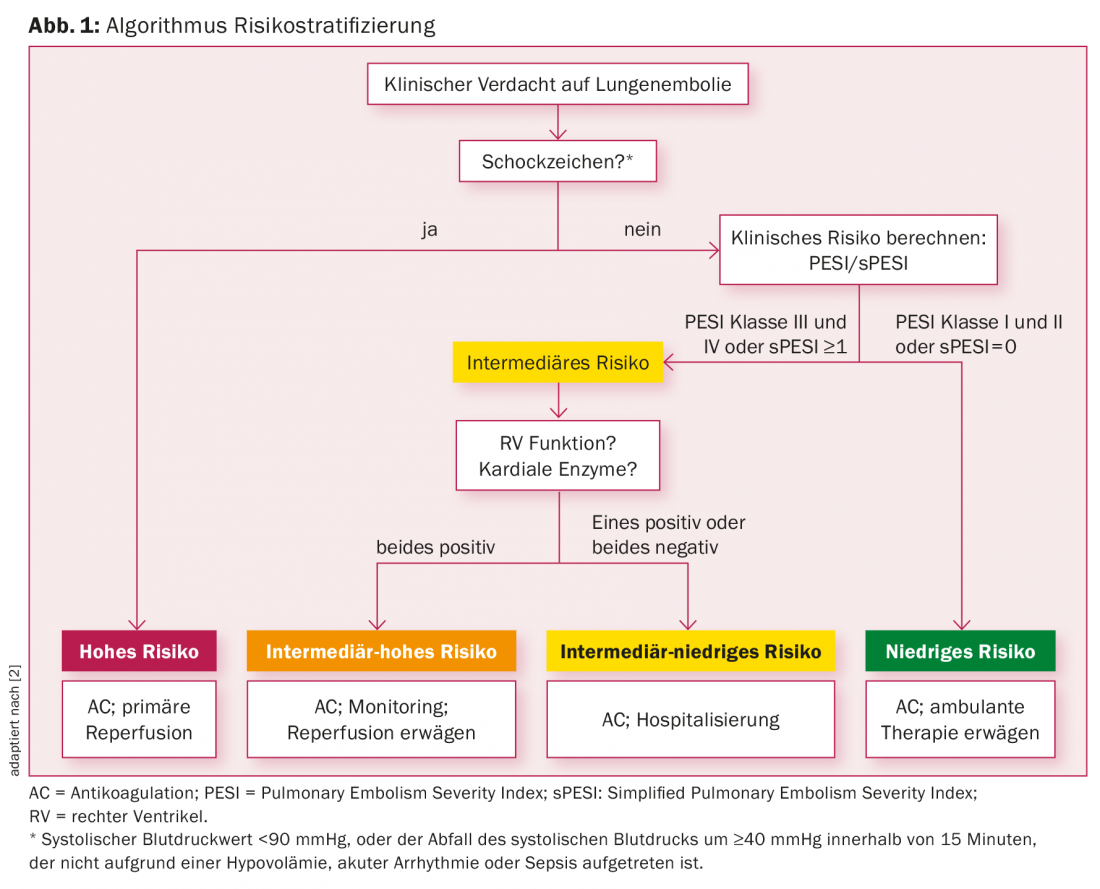
Les patients sont identifiés comme étant à haut risque s’ils présentent des signes d’état de choc ou d’hypotension, définis par une valeur de pression artérielle systolique <90 mmHg, ou la chute de la pression artérielle systolique de ≥40 mmHg en 15 minutes (non due à une hypovolémie, une arythmie, un sepsis).
Thérapie générale
Tous les patients devraient recevoir immédiatement un traitement anticoagulant, quelle que soit leur situation de risque, dans le but de réduire d’une part la mortalité et d’autre part le risque de récidive de thromboembolie veineuse. La durée standard d’un traitement anticoagulant est d’au moins trois mois.
L’anticoagulation conventionnelle commence par un traitement immédiat par anticoagulation parentérale (héparines), qui se chevauche plus tard avec des antagonistes de la vitamine K. Le traitement est ensuite suivi d’un traitement par voie orale.
Tous les nouveaux anticoagulants oraux (DOAK : rivaroxaban, edoxaban, dabigatran et apixaban) ont fait l’objet d’études de phase III qui n’ont pas montré d’efficacité inférieure à celle des antagonistes de la vitamine K. Les études de phase II ont montré que l’efficacité des antagonistes de la vitamine K était supérieure à celle des DOAK. Il est même possible que les DOAC soient considérés comme plus sûrs en termes de saignements significatifs [5]. Toutes les substances sont autorisées dans l’Union européenne pour le traitement de l’embolie pulmonaire.
Étant donné que l’anticoagulation seule a peu d’effet direct sur la fonction ventriculaire droite, les approches thérapeutiques supplémentaires discutées ci-dessous (thrombolyse systémique, thérapie thrombolytique par cathéter, embolectomie chirurgicale) doivent être évaluées en cas de risque élevé ou intermédiaire.
Traitement des patients à haut risque
Les patients à haut risque doivent être suivis de manière accélérée (fast-track). Chez ces patients, la recommandation primaire selon les lignes directrices de l’ESC est d’administrer un traitement thrombolytique systémique (niveau de preuve 1B).
La thrombolyse systémique a montré le plus grand bénéfice dans les 48 premières heures après le début des symptômes. Une amélioration des résultats cliniques et échocardiographiques a été observée dans plus de 90% des cas au cours des trois premiers jours suivant la thrombolyse [6,7]. La grande étude randomisée Peitho [8] a confirmé l’efficacité de la thrombolyse systémique, même chez les patients à risque intermédiaire hémodynamiquement stables. Une réduction du collapsus hémodynamique et de la mortalité (2,6%) a été observée chez les patients sous thrombolyse systémique par rapport aux patients sous anticoagulation seule (5,6%). Cependant, il y a eu une augmentation des hémorragies majeures dans le groupe thrombolyse : 6,3% contre 1,5% dans le groupe placebo. De plus, il y a eu une augmentation significative des accidents vasculaires cérébraux d’origine hémorragique 2% vs 0,2%. Dans ce contexte, de nombreux centres font preuve de retenue dans l’utilisation de la thrombolyse systémique.
S’il existe des contre-indications à la thrombolyse systémique, une thrombolyse interventionnelle par cathéter (grade 2aC) doit être mise en balance avec une embolectomie pulmonaire chirurgicale (grade 1C). Il en va de même lorsqu’un traitement thrombolytique de première intention n’a pas encore donné les résultats escomptés.
Jusqu’à présent, les preuves ne sont pas claires quant à savoir si une thrombolyse chirurgicale ou par cathéter donne de meilleurs résultats pour le patient chez les patients à risque spécialement exposés. Pour répondre à cette question, une étude interdisciplinaire randomisée (essai spécial) est actuellement menée à l’Hôpital de l’Île à Berne, dans laquelle des patients intermédiaires à haut risque et des patients à haut risque sont assignés au hasard à un bras de traitement (embolectomie chirurgicale ou thrombolyse basée sur un cathéter). Les premiers résultats sont attendus en 2017.
Traitement des patients intermédiaires et à faible risque
S’il n’y a pas de signes de choc ou d’hypotension en cas de suspicion d’embolie pulmonaire, il s’agit d’une urgence intermédiaire ou d’une urgence médicale. une situation à faible risque. Pour différencier le groupe à risque intermédiaire du groupe à faible risque, un outil de décision clinique est utile : le Pulmonary Embolism Severity Index (PESI) ou le Simplified Pulmonary Embolism Score (sPESI), c’est-à-dire la version simplifiée du même score [3]. Le tableau 1 donne un aperçu des critères du sPESI. Chacun de ces critères, s’il est rempli, donne droit à un point. Si la somme des points est égale à zéro, il s’agit d’un patient à faible risque. Ces patients reçoivent uniquement une anticoagulation sans traitement de reperfusion. En outre, pour les patients à faible risque, il s’agit d’évaluer s’ils peuvent être traités en ambulatoire.
En conséquence, les patients dont le score sPESI est ≥1 point sont considérés comme des patients à risque intermédiaire. Les patients à risque intermédiaire doivent faire l’objet d’une évaluation diagnostique plus poussée afin d’évaluer la fonction ventriculaire droite en raison de la pression exercée par l’embolie pulmonaire. Les patients présentant un dysfonctionnement du ventricule droit à l’échocardiographie ou à l’angiographie par tomodensitométrie et une élévation des enzymes cardiaques (troponine cardiaque positive) sont classés dans la catégorie de risque intermédiaire-élevé. Ces patients doivent être monitorés dans une unité de soins intermédiaires pendant les 24 premières heures (grade 1B). Un traitement de revascularisation primaire n’est pas obligatoire. Chez ces patients, un traitement thrombolytique doit être envisagé en cas d’aggravation clinique ou d’absence d’amélioration de la situation clinique sous anticoagulation initiale (grade 2aB). En cas de contre-indication à la thrombolyse, une embolectomie interventionnelle par cathéter (grade 2bB) ou chirurgicale (grade 2bC) peut être envisagée comme alternative.

Le traitement interventionnel par cathéter
L’intervention basée sur un cathéter a pour but de réduire la charge de thrombus dans les artères pulmonaires centrales ou dans les artères du lobe inférieur. Cela permet de réduire la charge ventriculaire droite, ce qui entraîne une amélioration des symptômes et de la survie [9].
Il existe d’une part les techniques d’intervention conventionnelles basées sur le cathéter pour les patients qui présentent une contre-indication absolue à la thrombolyse [10].
Le thrombus peut alors être fragmenté par cathétérisme, soit au moyen d’un cathéter à queue de cochon, soit par rhéolyse au moyen d’un gradient de pression (par ex. cathéter Angio-Jet), soit par aspiration (par ex. Argon Medical Device), soit enfin par rotation (par ex. cathéter Aspirex).
Il existe en outre des méthodes de thrombolyse locorégionale assistée par cathéter. D’une part, la thrombolyse conventionnelle par cathéter (CDT), dans laquelle, par exemple, l'”activateur tissulaire recombinant du plasminogène” (rtPA) est appliqué directement dans les artères pulmonaires via un cathéter de thombolyse. Le cathéter Angio-Jet permet également l’injection locale de l’agent thrombolytique par la “méthode Power Pulse Spray”.
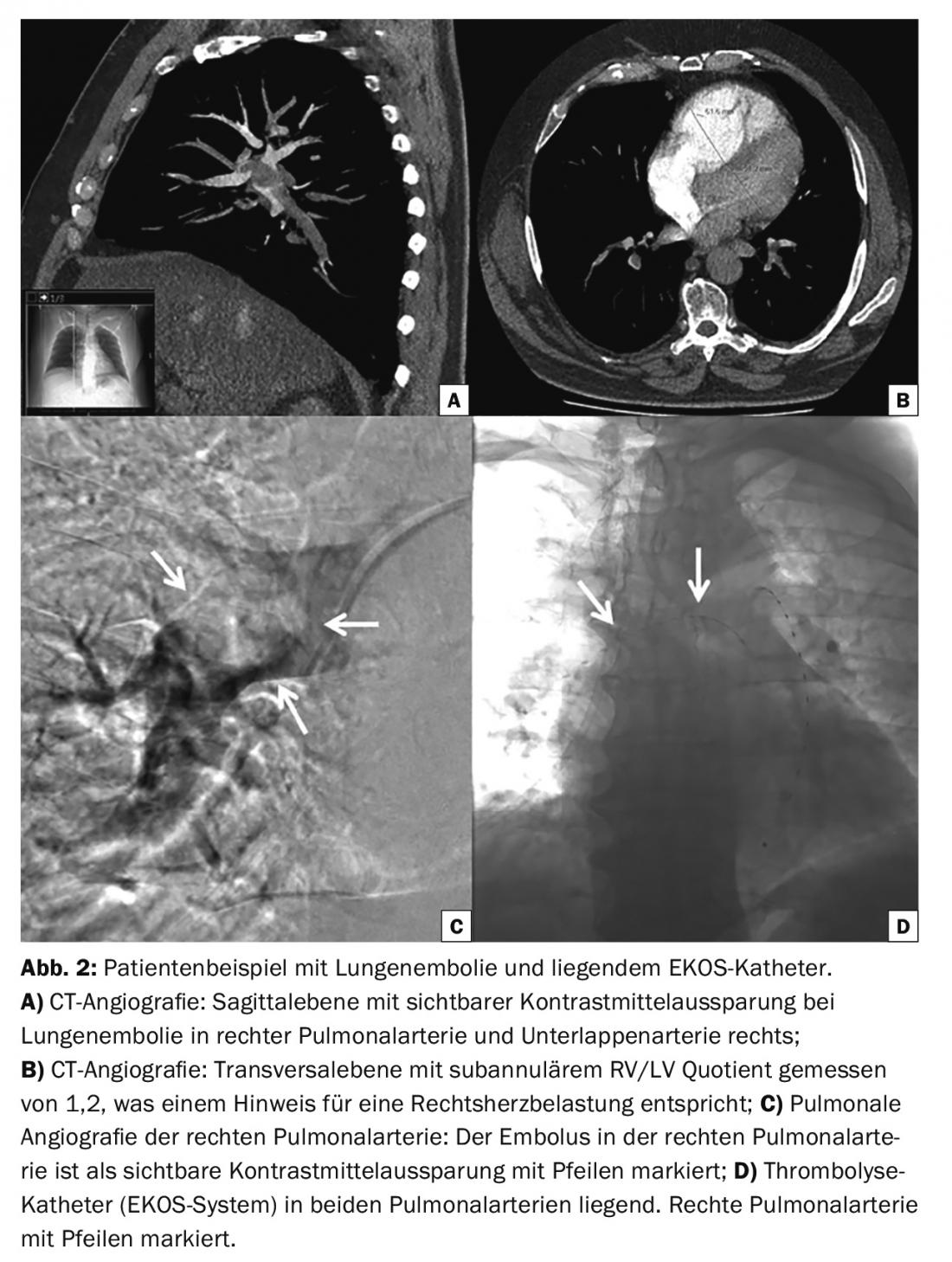
D’autre part, la thrombolyse pharmacomécanique par cathéter assisté par ultrasons (système EKOS) s’est révélée efficace pour réduire la dilatation du ventricule droit [11,12]. Les ultrasons eux-mêmes ne peuvent pas dissoudre le thrombus, mais ils favorisent la fibrinolyse en contribuant à la dissolution des filaments de fibrine et à une meilleure pénétration de l’agent thrombolytique. La figure 2 présente un exemple de patient souffrant d’embolie pulmonaire avec un cathéter EKOS en position couchée.
Littérature :
- Kucher N, et al : Embolie pulmonaire massive. Circulation 2006 ; 113(4) : 577-582.
- Konstantinides SV, et al. : 2014 ESC Guidelines on the diagnosis and management of acute pulmonary embolism. The Task Force for the Diagnosis and Management of Acute Pulmonary Embolism of the European Society of Cardiology (ESC) Endorsed by the European Respiratory Society (ERS). Eur Heart J 2014 ; 35(43) : 3033-3073.
- Jimenez D, et al : Simplification de l’indice de sévérité de l’embolie pulmonaire pour le pronostic chez les patients atteints d’embolie pulmonaire aiguë symptomatique. Archives of Internal Medicine 2010 ; 170(15) : 1383-1389.
- Aujesky D, et al : Derivation and validation of a prognostic model for pulmonary embolism. American Journal of Respiratory and Critical Care Medicine 2005 ; 172(8) : 1041-1046.
- Caldeira D, et al : Non-vitamin K antagonist oral anticoagulants and major bleeding-related fatality in patients with atrial fibrillation and venous thromboembolism. A systematic review and meta-analysis. Heart 2015 ; 101(15) : 1204-1211.
- Meneveau N, et al : Management of unsuccessful thrombolysis in acute massive pulmonary embolism. Chest 2006 ; 129(4) : 1043-1050.
- Wan S, et al : Thrombolyse comparée à l’héparine pour le traitement initial de l’embolie pulmonaire. Une méta-analyse des essais contrôlés randomisés. Circulation 2004 ; 110(6) : 744-749.
- Meyer G, et al : Fibrinolysis for patients with intermediate-risk pulmonary embolism. The New England Journal of Medicine 2014 ; 370(15) : 1402-1411.
- Jaff MR, et al : Management of massive and submassive pulmonary embolism, iliofemoral deep vein thrombosis, and chronic thromboembolic pulmonary hypertension. Une déclaration scientifique de l’American Heart Association. Circulation 2011 ; 123(16) : 1788-1830.
- Engelberger RP, Kucher N : Traitement de reperfusion par cathéter de l’embolie pulmonaire. Circulation 2011 ; 124(19) : 2139-2144.
- Kucher N, et al : Randomized, controlled trial of ultrasound-assisted catheter-directed thrombolysis for acute intermediate-risk pulmonary embolism. Circulation 2014 ; 129(4) : 479-486.
- Engelberger RP, Kucher N : Thrombolyse assistée par ultrasons pour l’embolie pulmonaire aiguë. Une revue systématique. Eur Heart J 2014 ; 35(12) : 758-764.
CARDIOVASC 2016 ; 15(2) : 18-22