Jusqu’à présent, le traitement systémique de la dermatite atopique était assombri par les risques d’effets secondaires. Depuis l’année dernière, le dupilumab est une alternative pour les adultes atteints de dermatite atopique modérée à sévère, un médicament biologique qui s’est avéré très efficace et sûr. L’autorisation de mise sur le marché de cet anticorps monoclonal a considérablement modifié le spectre thérapeutique pour cette indication.
Contrairement aux options thérapeutiques systémiques conventionnelles, les produits biologiques influencent très spécifiquement certains processus cellulaires, ce qui réduit les risques d’effets secondaires. Le dupilumab est le premier médicament biologique qui modifie efficacement la physiopathologie des maladies allergiques à médiation Th2 et qui présente un bon profil de sécurité [1]. Jusqu’à l’autorisation de mise sur le marché de cet anticorps monoclonal, les traitements systémiques de la dermatite atopique modérée à sévère se limitaient aux glucocorticoïdes oraux, à la ciclosporine et aux substances hors indication (par ex. azathioprine, mycophénolate mofétil, méthotrexate) [2]. Bien que les glucocorticoïdes oraux aient un effet significatif, un traitement à long terme n’est pas recommandé en raison des risques d’effets secondaires (par exemple, atrophie de la peau et des muscles, ostéoporose, augmentation de la glycémie). La ciclosporine atténue la réaction immunitaire et inhibe donc également le processus inflammatoire. Cette substance active peut également entraîner des effets secondaires indésirables en cas de prise prolongée (par ex. altération de la fonction rénale). Les traitements off-label (par ex. azathioprine, mycophénolate mofétil, méthotrexate) sont parfois utilisés chez les adultes lorsqu’un autre traitement ne permet pas d’atteindre l’objectif fixé en raison d’une réponse insuffisante ou d’effets secondaires.
Les processus à médiation cellulaire Th2 comme cible thérapeutique du dupilumab
En intervenant de manière très ciblée dans l’évolution de la maladie, le risque d’effets secondaires est réduit. Comme les médicaments biologiques ne peuvent pas être absorbés par la muqueuse du tractus gastro-intestinal en raison de leur structure, ils ne sont pas pris sous forme de comprimés, mais injectés par voie sous-cutanée. Le dupilumab (Dupixent®) [3] est disponible sous forme de seringue prête à l’emploi au dosage prescrit et peut être administré par les patients eux-mêmes après avoir reçu des instructions médicales. La substance active, produite par la technologie de l’ADN recombinant à partir de cellules ovariennes de hamster chinois, est un anticorps monoclonal humain IgG4 qui se lie à la sous-unité alpha du récepteur IL4, inhibant ainsi les voies de signalisation IL4/IL13 [4]. Grâce à cette régulation négative des processus inflammatoires médiés par Th2, le dupilumab est efficace dans diverses maladies allergiques [5]. Dans la pathogenèse de la dermatite atopique, les réactions immunitaires médiées par les cellules auxiliaires de type 2 (Th2) jouent un rôle important en sécrétant des quantités excessives d’IL4 et d’IL13. Ces deux cytokines stimulent la production d’anticorps IgE, ce qui entraîne une réaction de défense inflammatoire contre les agents irritants. En conséquence, un cercle vicieux peut s’installer, avec une barrière cutanée perturbée, la pénétration d’agents irritants, une inflammation, des démangeaisons et un grattage insupportables et une détérioration supplémentaire de la peau. Des lésions cutanées très importantes peuvent entraîner une inflammation chronique (voir 1) et une réduction secondaire de la fonction de barrière en raison de l’inflammation, qui dépend de la phase d’interaction entre les kératinocytes, les cellules dendritiques, les mastocytes cutanés et les cellules T avec les cytokines pro-inflammatoires correspondantes [2]. Au niveau moléculaire, le dupilumab a entraîné une réduction de la signature de plus de 800 gènes impliqués dans la dermatite atopique, dont ceux des chimiokines Th2, de la prolifération des cellules T et des cellules dendritiques [6]. La recherche sur les différentes cibles cellulaires du dupilumab n’est pas encore terminée [1].

Traitement adapté à la gravité
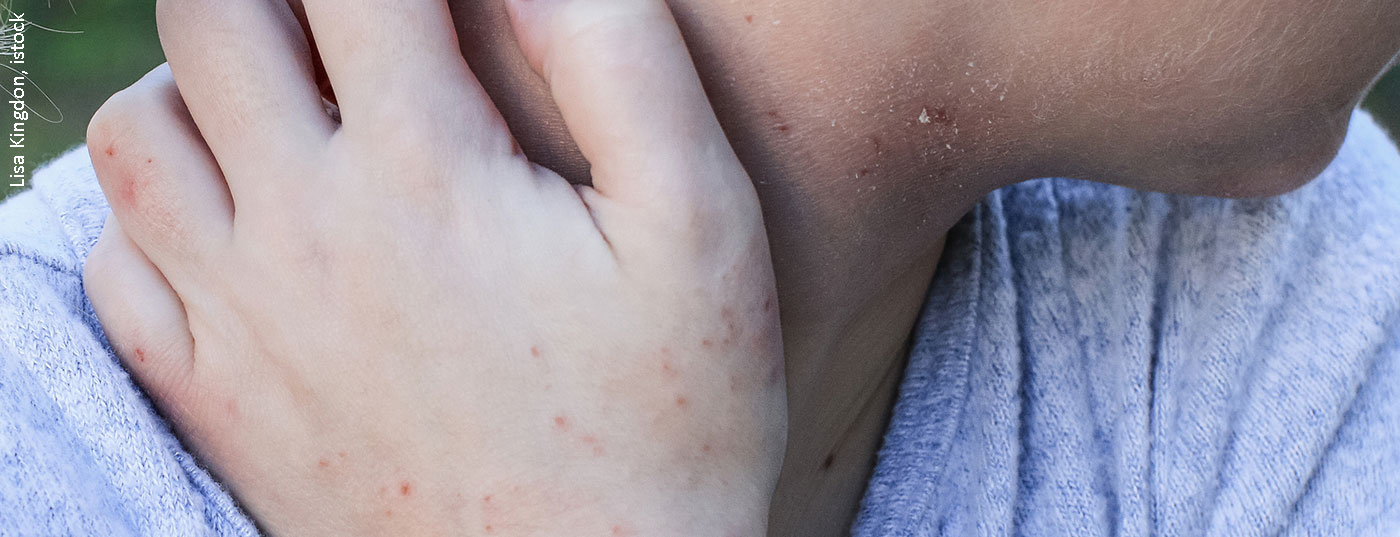
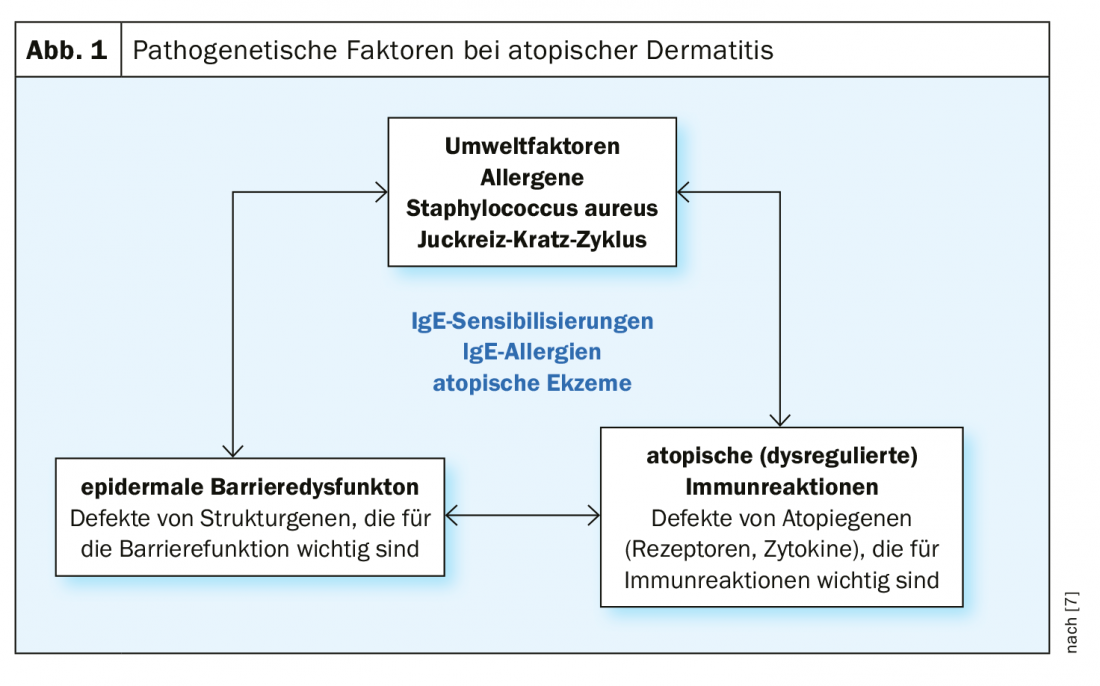
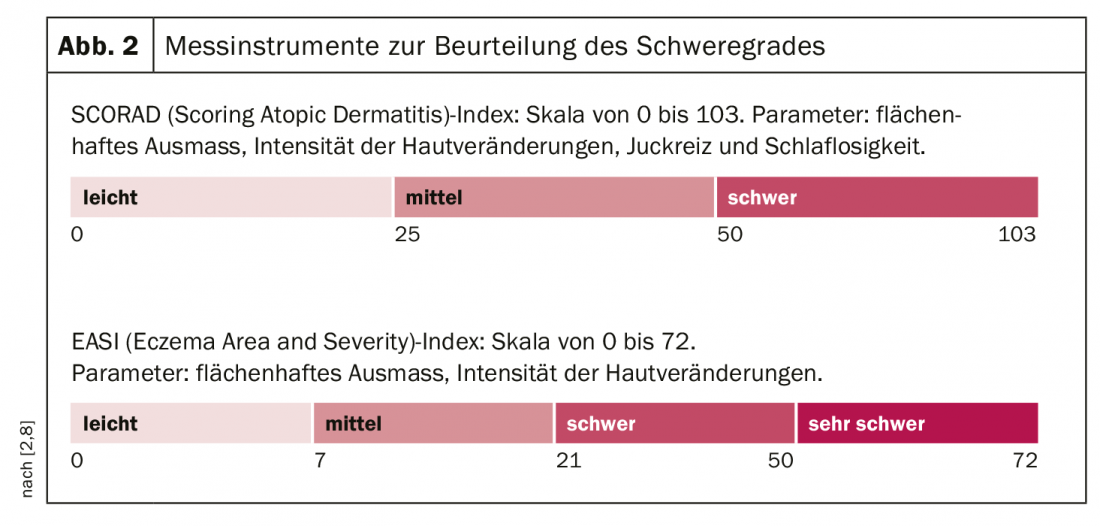
La dermatite atopique a une pathogenèse multifactorielle [7] : Il existe des prédispositions génétiques à un dysfonctionnement de la barrière épidermique et des dérégulations complexes du système immunitaire déjà mentionnées, avec une tendance à développer des sensibilisations médiées par les IgE. (Fig.1). Les facteurs déclencheurs exogènes incluent les substances irritantes (par exemple les détergents), le contact prolongé ou répété avec l’eau, la température élevée de l’air et la transpiration, ainsi que les facteurs de stress psychosocial [7]. L’expression des symptômes peut varier considérablement d’un individu à l’autre et selon les phases de la maladie. Environ la moitié des personnes atteintes présentent un eczéma modéré à sévère, au moins temporairement [8]. Les formes très sévères de dermatite atopique touchent environ 8% des patients. Pour adapter au mieux le traitement à l’évolution de la maladie, il est nécessaire d’évaluer les symptômes en tenant compte des données objectives et subjectives. Les instruments de mesure validés SCORAD (Scoring Atopic Dermatitis) et EASI (Eczema Area and Severity Index) sont adaptés à l’évaluation de la sévérité et à la mesure de l’évolution dans la pratique clinique quotidienne [2]. (Fig. 2). Des démangeaisons souvent insupportables et persistantes sont perçues comme particulièrement pénibles par la plupart des patients atteints de dermatite atopique sévère et peuvent entraîner un cycle prurit-grattage. L’indice de qualité de vie en dermatologie (DLQI) peut être utilisé pour évaluer les différentes dimensions de la qualité de vie altérée. En particulier dans les formes sévères de dermatite atopique, un traitement topique seul n’est souvent pas suffisant et un traitement systémique est nécessaire. La prescription d’agents systémiques administrés par voie orale ou sous-cutanée se situe au niveau 4 du schéma graduel toujours en vigueur [2] :
- Niveau 1 : peau sèche : traitement de base topique/soins de la peau ; éviter ou réduire les facteurs de provocation.
- Niveau 2 : eczéma léger : mesures nécessaires du niveau 1 plus agents antiprurigineux et anti-inflammatoires ; glucocorticoïdes topiques légers et/ou (à partir de l’âge de 3 ans) inhibiteurs topiques de la calcineurine
- Niveau 3 : eczéma modéré : mesures nécessaires des niveaux 1-2 plus glucocorticoïdes topiques (classe 2 à 3) et/ou (à partir de l’âge de 3 ans) inhibiteurs topiques de la calcineurine
- Niveau 4 : eczéma sévère persistant : mesures nécessaires des niveaux 1 à 3 plus traitement immunomodulateur systémique (comprimés/injections pour réguler le système immunitaire).
Littérature :
- Harb H, Chatila TA : Mécanismes du dupilumab. Clinical & Experimental Allergy 2020 ; 50(1) : 5-14. https://doi.org/10.1111/cea.13491
- AWMF : Lignes directrices sur la dermatite atopique [eczéma atopique ; dermatite atopique] Niveau de développement : S2k. Numéro de registre AWMF : 013-027 version longue, www.awmf.org
- Compendium suisse des médicaments : Dupixent, www.compendium.ch
- Agence européenne des médicaments : Dupixent. Information sur le produit, résumé des caractéristiques du produit, www.ema.europa.eu
- Del Rosso JQ : Traitements anti-corps monoclonaux pour la dermatite atopique : où en sommes-nous dans le spectre de la prise en charge de la maladie ? J Clin Aesthet Dermatol. 2019;12(2) : 39-41.
- Hamilton JD, et al : Dupilumab améliore la signature moléculaire dans la peau des patients atteints de dermatite atopique modérée à sévère. J Allergy Clin Immunol 2014 ; 134(6) : 1293-1300.
- Trautmann A, et al. : Eczéma atopique. Allergologie en clinique et en pratique 2018, DOI : 10.1055/b-0037-147082, www.thieme-connect.de
- Deutsche Haut- und Allergiehilfe e.V., www.dha-schwere-neurodermitis.de
- Gandhi NA, et al : Targeting key proximal drivers of type 2 inflammation in disease. Nat Rev Drug Discov 2015 ; 15 : 35-50.
- Noda, et al : The translational revolution and use of biologics in patients with inflammatory skin diseases. J Allergy Clin Immunol 2015 ; 135 : 324-336.
DERMATOLOGIE PRATIQUE 2020 ; 30(2) : 28-29