L’ablation par cathéter de la fibrillation auriculaire paroxystique symptomatique est une procédure thérapeutique bien établie qui offre de bonnes chances de succès et un faible risque. L’isolation des veines pulmonaires est et reste la base d’une ablation par cathéter réussie. Cependant, chez une partie des patients atteints de fibrillation auriculaire, on trouve une maladie fibrotique auriculaire indépendante qui fournit le substrat nécessaire au maintien de la fibrillation auriculaire. Cela concerne en particulier (mais pas exclusivement) les patients souffrant de fibrillation auriculaire persistante. Cette découverte a ouvert la voie à des concepts d’ablation individualisés afin d’obtenir une stabilisation à long terme du rythme sinusal, même chez ce groupe de patients exigeants. Le traitement ciblé des “modulateurs” de fibrillation auriculaire (c’est-à-dire des facteurs favorisants tels que l’hypertension artérielle, l’obésité, l’apnée du sommeil, le diabète, etc.) devrait à l’avenir être effectué de manière interdisciplinaire.
L’ablation par cathéter de la fibrillation auriculaire (FAV) est devenue une procédure de routine avec de bons résultats cliniques. Les taux de succès à long terme sont actuellement de 80-90% pour la fibrillation auriculaire paroxystique (FAP) et de 50-60% pour la fibrillation auriculaire persistante (FAPP) [1,2].
L’ablation par cathéter peut améliorer de manière significative la qualité de vie des patients. De plus, des études montrent non seulement la supériorité de l’ablation par cathéter sur les médicaments antiarythmiques en ce qui concerne la récurrence de l’HVF, mais fournissent également des preuves que l’ablation pourrait influencer le pronostic des AVC ischémiques et la mortalité [3].
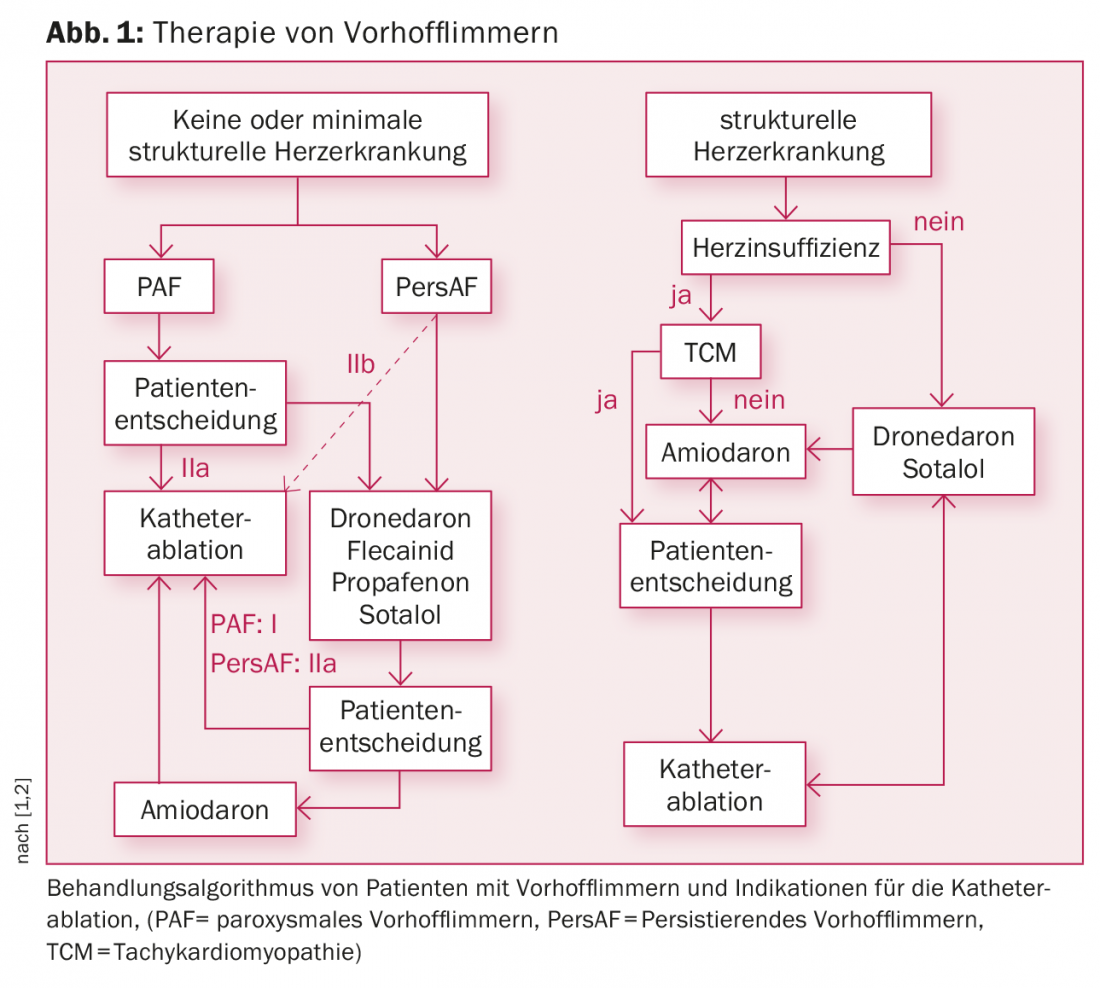
En fonction de l’utilisation préalable ou non d’antiarythmiques, les directives actuelles mentionnent une indication de classe I ou IIa pour le FAP et une indication de classe IIa ou IIb pour le persAF (Fig. 1) [1,2]. Pour la FAP en particulier, l’ablation par cathéter est déjà utilisée comme traitement de première ligne.
La physiopathologie de la FHV non valvulaire a fait l’objet d’études intensives ces dernières années, ce qui a permis d’élargir considérablement nos connaissances sur les fondements physiopathologiques.
Le rôle des déclencheurs
Il y a près de deux décennies, Haissaguerre et ses collaborateurs ont décrit pour la première fois le rôle des déclencheurs des veines pulmonaires (PV) dans l’initiation de la FHV [4]. Cette observation a constitué la pierre angulaire du développement de l’isolation des veines pulmonaires (PVI) en tant que stratégie de traitement potentiellement curative. Depuis lors, elle constitue la pierre angulaire de l’ablation par cathéter de la FHV. Rarement, les déclencheurs non-PV-dépendants jouent un rôle dans l’initiation. Ces derniers peuvent avoir leur origine en partie dans l’oreillette gauche, le sinus veineux coronaire ou le septum interauriculaire.
L’isolation des veines pulmonaires
L’IVP fait quasiment partie intégrante de toute ablation par cathéter de la FHV et peut être obtenue grâce à l’utilisation de différents outils ou techniques (Fig. 2 A-C).
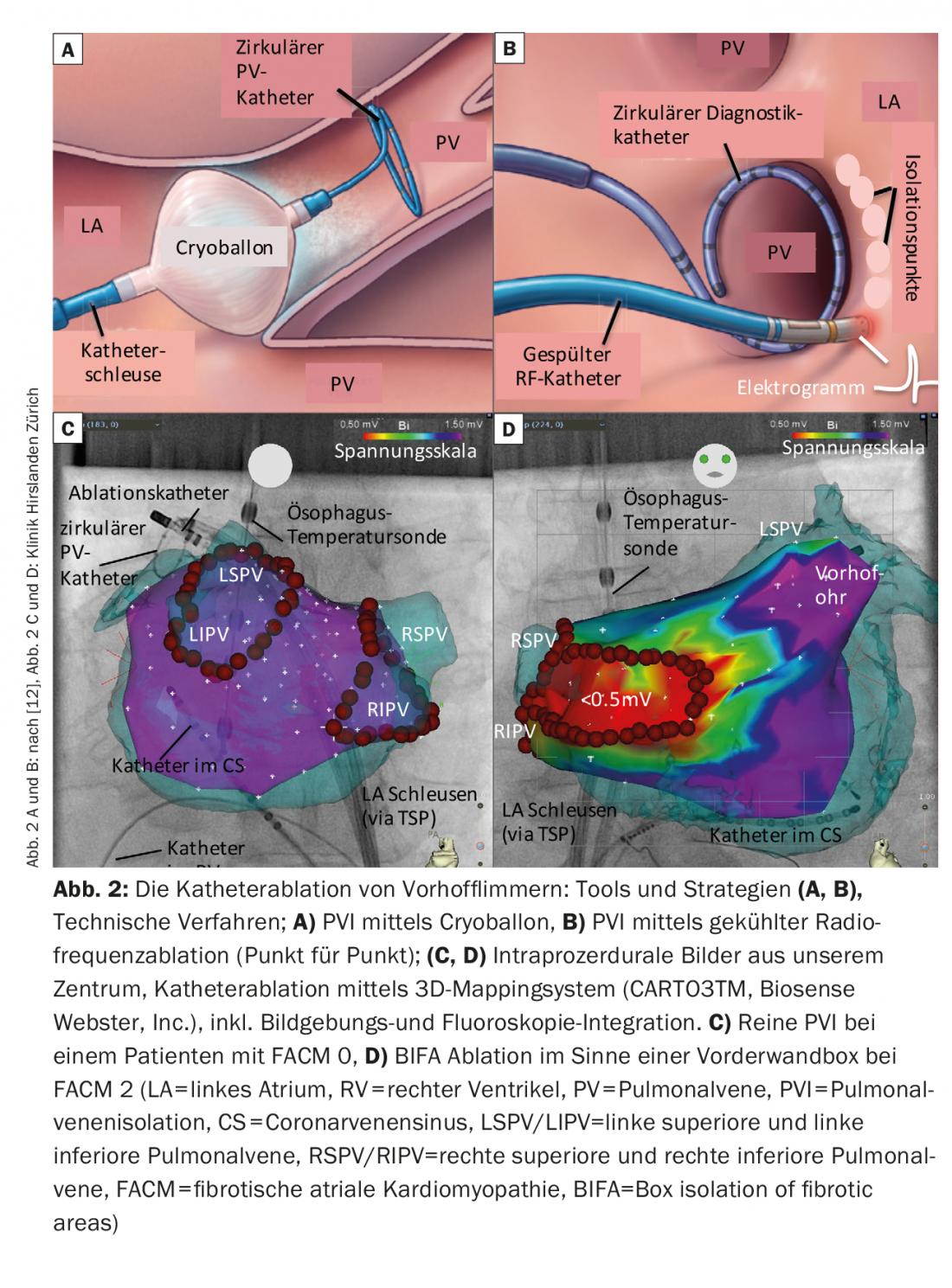
La forme d’énergie avec laquelle on dispose de la plus grande expérience au monde est le courant à haute fréquence (= radiofréquence, RF). En règle générale, une ligne circonférentielle est créée autour des PV ipsilatérales par une ablation point par point via l’extrémité du cathéter. L’isolation électrique est généralement vérifiée par l’utilisation périprocédurale de cathéters de cartographie circulaires. Des systèmes de cartographie électro-anatomique ou des techniques d’imagerie sont souvent utilisés pour intégrer les images (scanner, IRM, échographie intracardiaque). Ils facilitent la navigation dans l’atrium, contribuent à la sécurité de l’intervention et réduisent les temps de fluoroscopie. La durabilité des lésions d’ablation s’est également améliorée grâce aux technologies physiques telles que les sas navigables, les différentes méthodes de rinçage des cathéters et, en particulier, la mesure de la pression de compression des cathéters. Le taux de récupération des lignes PV a ainsi pu être réduit.
Outre l’ablation par radiofréquence, l’ablation par cryoballon est aujourd’hui de plus en plus utilisée comme alternative. Les 4 PV sont isolées individuellement, la fluoroscopie étant utilisée pour évaluer la position optimale du ballon à l’aide d’injections de produit de contraste. Les ballons sont souvent plus faciles à manipuler, mais ils présentent la limite de ne pas permettre un diagnostic/traitement détaillé des arythmies consécutives ou l’analyse des électrogrammes de l’oreillette gauche en dehors de la PV pendant la procédure.
L’énergie laser est très rarement utilisée pour l’IPV. L’expérience est encore limitée à cet égard.
En cas de PAF, la PVI pure permet généralement d’obtenir de très bons résultats à long terme en une seule procédure. En revanche, dans le cas de persAF, malgré les progrès techniques et stratégiques, les taux de réussite sont limités, même après parfois plusieurs procédures. Les récidives après une ablation ne s’expliquent pas toujours par une récupération de la conduction PV.
Le substrat de l’oreillette gauche
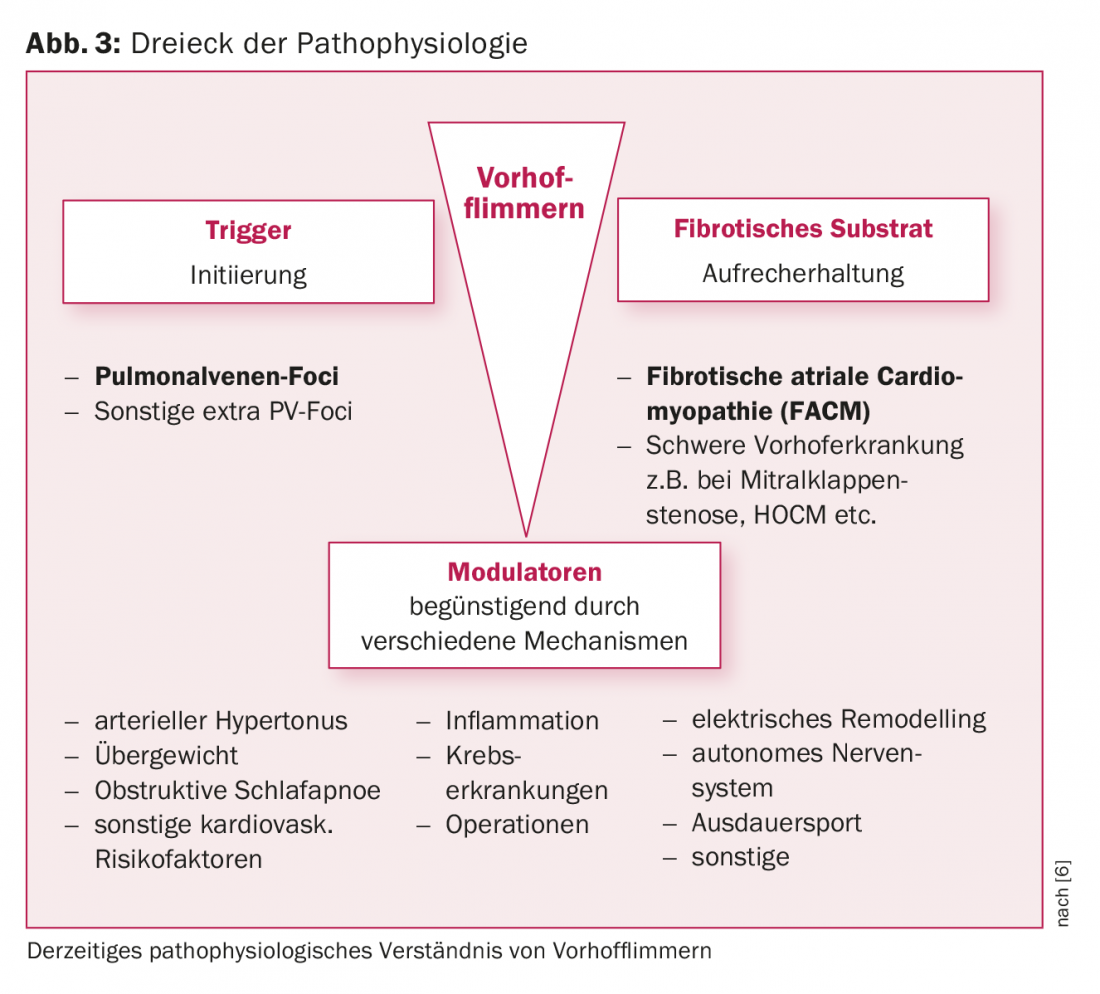
La présence d’une fibrose de l’oreillette gauche est un résultat pathologique typique chez les patients atteints de FHV. Ce substrat de l’oreillette gauche joue un rôle crucial dans le maintien de la FHV. Cette dernière peut se développer sur la base de maladies cardiaques structurelles importantes (p. ex. sténose de la valve mitrale, HOCM) ou exister sous la forme d’une maladie auriculaire indépendante. Dans ce contexte, le terme de cardiomyopathie auriculaire fibrotique préexistante (FACM) s’est établi ces dernières années [5, 6] (Fig. 3, 4). Des études expérimentales ont montré que les processus de remodelage structurel fibrotiques entraînent une situation électriquement anisotrope (modification des vitesses de conduction, des périodes réfractaires, des contacts cellule-cellule) qui favorise le maintien de la FVC. Nous savons aujourd’hui que les taux de réussite de l’ablation dépendent en grande partie de l’ampleur de la fibrose auriculaire sous-jacente.
La création d’une carte de tension bipolaire pendant la procédure peut bien représenter ce substrat auriculaire gauche (les zones saines sont codées en violet, les zones très fibrosées <0,5 mV en rouge).
Notre centre classe aujourd’hui la FACM en 5 stades selon le degré de sévérité (fig. 4) (FACM 0 : sur la carte de tension, pas de zones de basse tension significatives, FACM 1 : fibrose locale de faible étendue, FACM 2 : zones de fibrose plus importantes et confluentes, FACM3 : fibrose atriale marquée, mais encore limitée à une région, FACM 4 : fibrose quasi ubiquitaire).
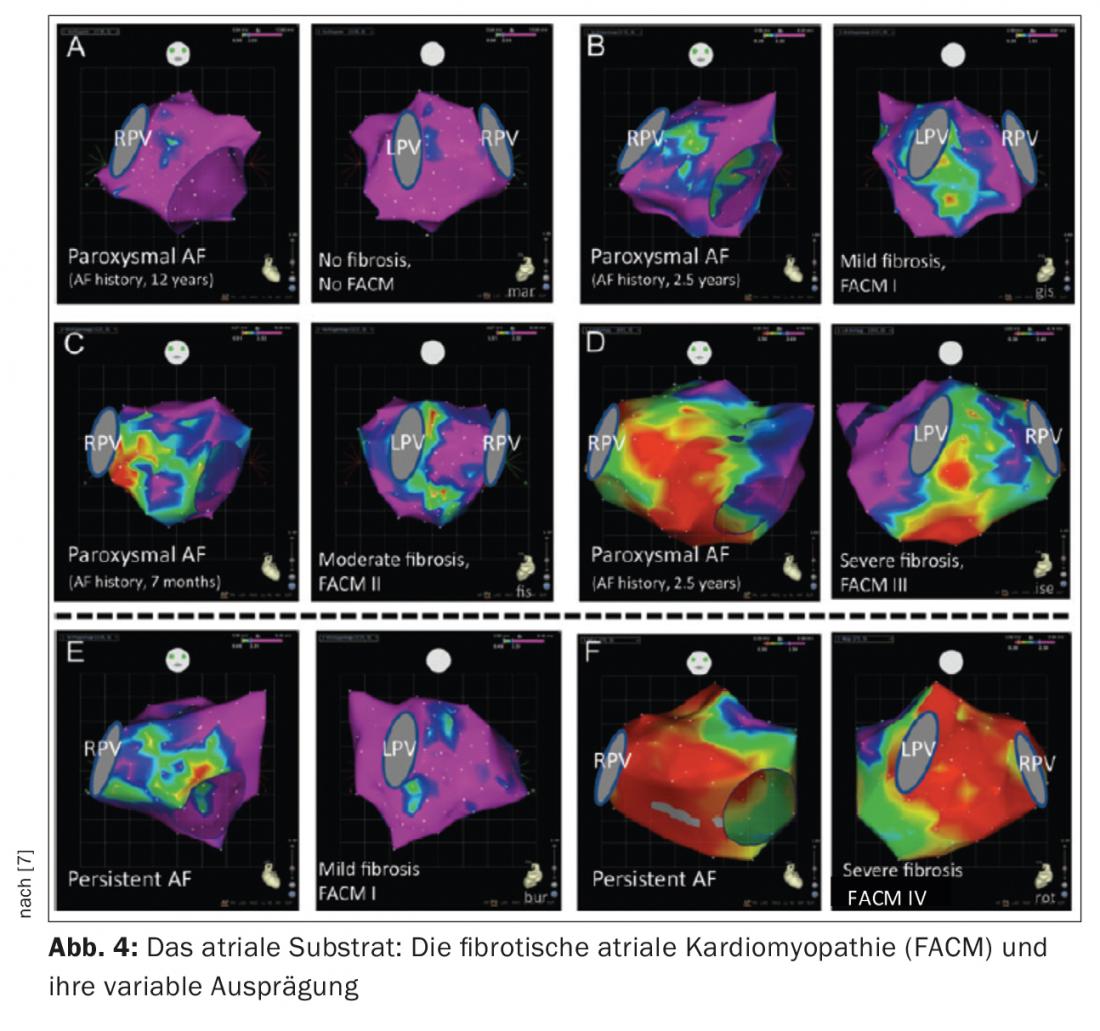
On a longtemps pensé que la durée et l’ampleur des épisodes de fibrillation auriculaire fournissaient le stimulus critique pour le remodelage fibrotique des oreillettes (“AF begets AF”). Depuis, des doutes ont été émis sur cette théorie. En effet, il a été démontré que les patients atteints de PAF et de persAF peuvent tous deux présenter une maladie auriculaire significative. Chez nos patients, des zones de fibrose peuvent être détectées chez près de 20% des patients PAF et chez 70% des patients persAF.
Procédures individualisées actuelles et nouvelles pour la modification de substrats
La PVI pure ne réussit que chez à peine 50% des patients atteints de persAF. Jusqu’à présent, les stratégies d’ablation allant au-delà de la PVI (par exemple, l’ablation d’électrogrammes fractionnés complexes, appelés CFAE, ou l’application de lignes ou la combinaison des deux) n’ont pas contribué à une amélioration significative des résultats de l’ablation. Cette dernière a notamment été démontrée par l’étude prospective multicentrique STAR AF II [1,8].
C’est pourquoi des concepts d’ablation individualisés ont été développés, qui prennent en compte (en plus de l’IVP) les mécanismes pathologiques sous-jacents de la FHV.
D’une part, d’un point de vue fonctionnel, les “rotors” auriculaires ont fait l’objet d’une attention particulière au cours des cinq dernières années. De nouvelles techniques de cartographie électrophysiologique permettent d’identifier ces “moteurs” de la FHV à l’aide d’un cathéter multi-électrodes en forme de panier, ou plus rarement de manière non invasive par “cartographie de la surface corporelle”, et de les rendre accessibles à une ablation ciblée. Toutefois, sa valeur clinique, en particulier chez les patients atteints de persAF, doit être étudiée plus avant. Les résultats de l’ablation font l’objet de controverses [9].
D’autre part, il existe aujourd’hui des concepts d’ablation qui se concentrent sur les modifications structurelles, c’est-à-dire la fibrose de l’oreillette gauche. L’isolation des zones fibrotiques (BIFA), qui va au-delà de l’IPV circonférentielle, est l’une de ces stratégies développées dans notre centre (Fig. 2B). Sur la base d’une carte de tension en rythme sinusal établie par l’oreillette, les zones fibrotiques, c’est-à-dire les “zones de basse tension” (<0,5 mV) sont isolées électriquement. L’objectif est d’éliminer les aires auriculaires malades et donc le substrat potentiellement arythmogène.
Malgré un groupe de patients difficile, le concept BIFA obtient de bons résultats d’ablation avec des taux de réussite initiaux à 1 an d’environ 85% avec seulement 1,2 procédure par patient [10].
En raison de l’expression très variable de la FACM, un concept d’ablation optimal peut être choisi individuellement pendant la procédure. L’imagerie médicale en tant que méthode de dépistage préalable est encore en cours d’expérimentation. Chez les patients sans FACM détectable (FACM 0), une simple PVI semble suffisante, même en cas de persAF. Il existe ici de bonnes chances pronostiques de conserver le rythme sinusal à long terme (80-90%) avec seulement 1,2 procédure/patient [10]. L’ablation par cathéter est nettement plus exigeante chez les patients souffrant déjà d’une maladie de l’oreillette. La question de savoir dans quelle mesure les patients atteints de fibrose atriale de très haut grade (FACM 4) peuvent bénéficier à long terme d’une ablation par cathéter n’est pas encore définitivement tranchée.
Modulateurs de la fibrillation auriculaire
Un certain nombre de facteurs de risque cliniques (âge, hypertension, obésité, apnée du sommeil, diabète, alcool, etc.) favorisent l’apparition d’une FHV. Certaines circonstances concomitantes, telles que l’inflammation/l’infection ou encore le contexte périopératoire, favorisent également les récidives d’arythmie (Fig. 3).
Ces dernières années, il a été démontré qu’un traitement ciblé, appelé “modulateur de la fibrillation auriculaire”, avait des effets positifs. Le groupe de recherche australien dirigé par Sanders a ainsi pu démontrer qu’un traitement ciblé des facteurs de risque cliniques permettait de réduire les symptômes associés à la FVC, de provoquer un remodelage cardiaque et même d’améliorer significativement les résultats d’une ablation par cathéter [11].
Une gestion concomitante des facteurs de risque devrait donc être une composante essentielle du contrôle du rythme dans la pratique, non seulement avant, mais aussi après l’ablation par cathéter. Une prise en charge interdisciplinaire des patients atteints de FHV est donc souhaitable.
Complications
Les complications potentielles de l’ablation par cathéter de la FHV dépendent des technologies et des stratégies d’ablation utilisées ainsi que de l’expérience de l’examinateur.
Le taux global de complications est d’environ 4 à 5 %, dont la moitié environ sont des complications vasculaires périphériques liées à l’accès inguinal [1,12,13]. Les complications graves sont rares.
Des épanchements/tamponnades péricardiques sont rapportés dans 1-2,5% des cas, les cryoballons présentant des taux légèrement inférieurs de 0,5%. Le risque de complications cérébrovasculaires (AIT/accidents vasculaires cérébraux) a pu être réduit au cours des dernières années grâce à des mesures telles que l’exclusion pré-interventionnelle des thrombus par échocardiographie transoesophagienne, l’héparinisation périprocédurale (guidée par ACT) et le rinçage continu du cathéter/du sas, et ne représente aujourd’hui qu’environ 0,5%.
Les sténoses de la PV en tant qu’effet thermique de l’ablation ne se produisent pratiquement plus aujourd’hui en dehors des zones d’embouchure de la PV en raison des stratégies d’ablation plus récentes et sont estimées à 0-0,3% dans la littérature.
La parésie diaphragmatique est une complication rare mais typique de l’ablation par cryoballon (2-5%). Cependant, elle n’est souvent détectable que temporairement, de sorte qu’elle n’est décrite que dans 0,2% des cas après 3 mois. Une complication extrêmement rare mais potentiellement mortelle est l’apparition d’une fistule atrio-œsophagienne (rapports de cas isolés ou environ 0,04%). Des mesures prophylactiques à cet égard sont clairement recommandées : Les réductions d’énergie au niveau de la paroi postérieure de l’oreillette ainsi que l’utilisation de sondes de température œsophagienne qui détectent les températures trop élevées ou trop basses pendant l’ablation.
Un aperçu de l’avenir
La FHV est une maladie complexe et hétérogène. L’ablation par cathéter peut traiter efficacement une grande partie des patients et établir un rythme sinusal stable à long terme. Toutefois, pour le pronostic à long terme, la sévérité de la maladie atriale sous-jacente, qui n’est pas toujours corrélée à l’aspect clinique (PAF vs. persAF), est d’une importance déterminante.
Des concepts d’ablation individualisés “sur mesure” sont donc essentiels pour obtenir des résultats optimaux. De nouvelles techniques de cartographie diagnostique, idéalement à haute résolution et automatisées pendant l’ablation par cathéter, nous donneront davantage d’informations, notamment sur les mécanismes de maintien de la FVC. De plus, l’importance des techniques d’imagerie va augmenter (par exemple, les analyses d’écho spécifiques comme le strain, les IRM cardiaques, etc.) avec le potentiel de décider des thérapies adéquates ou des concepts d’ablation spécifiques avant la procédure. En outre, des biomarqueurs (par exemple des marqueurs de la matrice ex-tracellulaire) ou des prédispositions génétiques connues pourraient à l’avenir fournir des indications sur l’étendue et la progression du substrat auriculaire à moyen terme.
Littérature :
- Calkins H, et al. : HRS/EHRA/ECAS Expert Consensus Statement on Catheter and Surgical Ablation of Atrial Fibrillation : recommendations for patient selection, procedural techniques, patient management and follow-up, definitions, endpoints, and research trial design. Europace. 2012 ; Avril;14(4) : 528-606.
- Kirchhof P, et al. : 2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS : The Task Force for the management of atrial fibrillation of the European Society of Cardiology (ESC) Developed with the special contribution of the European Heart Rhythm Association (EHRA) of the ESCEndorsed by the European Stroke Organisation (ESO). Europace. 2016 Aug 27 [Epub].
- Friberg L, et al : Catheter ablation for atrial fibrillation is associated with lower incidence of stroke and death : data from Swedish health registries. Eur Heart J. 2016 ; Mar 16. pii : ehw087. [Epub ahead of print]
- Haïssaguerre M, et al. Initiation spontanée de la fibrillation auriculaire par des battements ectopiques provenant des veines pulmonaires. N Engl J Med. 1998 ; Sep 3;339(10) : 659-66.
- Kottkamp H, et al : Catheter ablation of atrial fibrillation : how to modify the substrate ? J Am Coll Cardiol. 2015 ; Jan 20;65(2) : 196-206.
- Kottkamp H, et al. : The Substrate in “Early Persistent” Atrial Fibrillation Arrhythmia Induced, Risk Factor Induced, or From a Specific Fibrotic Atrial Cardiomyopathy ? JACC CEP 2016 ; 2 : 140-142.
- Kottkamp H : Human atrial fibrillation substrate : towards a specific fibrotic atrial cardiomyopathy. Eur Heart J. 2013 ; Sep;34(35):2731-8.
- Verma A, Jiang CY, et. al. : STAR AF II Investigators. Approches de l’ablation par cathéter pour la fibrillation auriculaire persistante. N Engl J Med. 2015 ; May 7;372(19) : 1812-22.
- Guillem MS, Climent AM, et al. : Présence et stabilité des rotors dans la fibrillation auriculaire : preuves et implications thérapeutiques. Cardiovasc Res. 2016, 109(4) : 480-92. [Epub].
- Kottkamp H, et. al : Box Isolation of Fibrotic Areas (BIFA) : A Patient-Tailored Substrate Modification Approach for Ablation of Atrial Fibrillation. J Cardiovasc Electrophysiol. 2016 ; Jan27(1):22-30
- Pathak RK, et al : Aggressive risk factor reduction study for atrial fibrillation and implications for the outcome of ablation : the ARREST-AF cohort study. J Am Coll Cardiol 2014;64 : 2222-2231.
- Kuck KH, et al : Cryoballon ou ablation par radiofréquence pour la fibrillation auriculaire paroxystique. N Engl J Med. 2016 ; 374 : 2235-45.
- Shah RU, et al : Complications procédurales, et procédures répétées après ablation par cathéter pour fibrillation auriculaire. J Am Coll Cardiol 2012 ; 59 : 143-9.
CARDIOVASC 2016 ; 15(6) : 3-8