L’anticoagulation orale avec les anticoagulants oraux non dépendants de la vitamine K (NOAK) chez les patients atteints de fibrillation auriculaire est une histoire à succès. Depuis leur introduction en Suisse il y a près de 10 ans, ces substances se sont imposées comme traitement privilégié dans la prévention des attaques cérébrales. Quelle est l’expérience pratique ?
L’anticoagulation orale avec les anticoagulants oraux non dépendants de la vitamine K (NOAK) chez les patients atteints de fibrillation auriculaire est une réussite. Depuis l’introduction de ces substances en Suisse il y a près de 10 ans, elles se sont établies comme traitement privilégié dans la prévention des attaques cérébrales ; des données récentes issues de grands registres, désormais disponibles, peuvent également confirmer les conclusions des études d’homologation chez les patients au quotidien. Dans cette brève revue, nous résumons certains aspects nouveaux et pertinents pour la pratique.
Nouvelles directives de l’ESC sur la fibrillation auriculaire
Lors du congrès de la Société européenne de cardiologie de cette année, qui s’est déroulé de manière virtuelle en raison de la pandémie de COVID-19, les recommandations adaptées des guidelines sur la prise en charge de la fibrillation auriculaire ont été présentées et publiées simultanément dans l’European Heart Journal [1]. L’adaptation “simplifiée” du diagnostic et de la prise en charge de ce trouble du rythme cardiaque est une nouveauté importante ; le principe simple à retenir est “CC to ABC” (tab. 1). Au début, la fibrillation auriculaire doit être correctement diagnostiquée (Confirm AF), puis une caractérisation objective de l’état d’avancement du problème doit être effectuée (Characterize AF). Pour ce dernier, les “4S” s’appliquent : évaluation du risque d’accident vasculaire cérébral, gravité des symptômes, fréquence/gravité de la fibrillation auriculaire et, enfin, analyse du substrat de la fibrillation auriculaire (modifications morphologiques déjà survenues dans l’oreillette). Une fois cette étape franchie, le traitement est mis en place. La prévention de l’attaque cérébrale est particulièrement importante (Avoid stroke), mais le contrôle des symptômes (Better symptom control) et le traitement des comorbidités (Comorbidities and cardiovascular risk factors) sont également des facteurs essentiels du traitement intégratif des patients atteints de fibrillation auriculaire. Ce dernier aspect en particulier ne doit pas être sous-estimé ; une perte de poids est non seulement essentielle quoad vitam, mais aussi en ce qui concerne le contrôle du rythme dans la fibrillation auriculaire [2]. La situation est très similaire pour d’autres facteurs de risque cardiovasculaire tels que l’hypertension artérielle [3], le diabète sucré [4] et le syndrome d’apnée obstructive du sommeil [5]. Toutes ces comorbidités doivent être prises en compte si l’on veut traiter la fibrillation auriculaire de manière complète et adaptée au patient.
Diagnostic de la fibrillation auriculaire
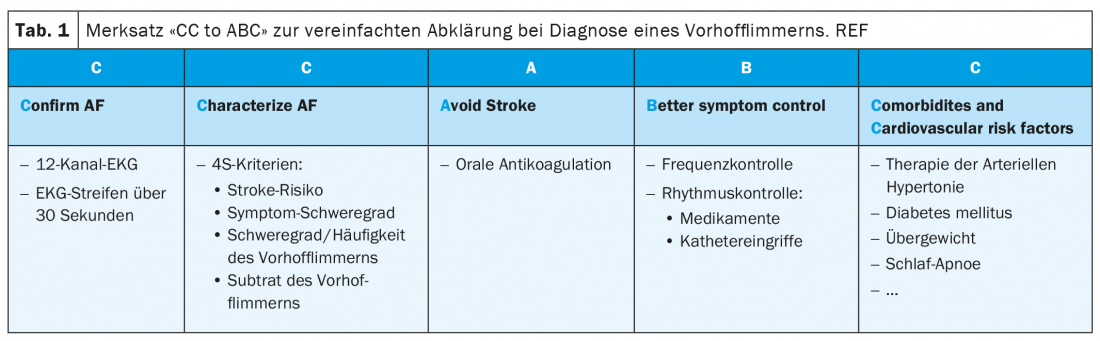
Selon les nouvelles directives, la fibrillation auriculaire est définie comme un trouble du rythme cardiaque supraventriculaire avec une activation électrique auriculaire non coordonnée et donc une contraction auriculaire insuffisante. Il convient de distinguer la fibrillation auriculaire clinique de la fibrillation auriculaire subclinique et des épisodes dits de haute fréquence auriculaire (AHRE). Une fibrillation auriculaire clinique est considérée comme telle, indépendamment de la présence de symptômes, si elle est enregistrée sur un ECG 12 dérivations ou documentée pendant au moins 30 secondes sur un enregistrement ECG simple (tableau 2). Pour cet enregistrement ECG, on utilise aujourd’hui, outre les examens Holter classiques de longue durée, des technologies de diagnostic plus modernes comme les téléphones mobiles et/ou les montres spécialisées. En effet, deux grandes études récemment publiées sur une population saine de plusieurs centaines de milliers de personnes ayant un ECG mobile (soit via un téléphone portable, soit via une montre) ont montré que 0,23 à 0,5% de cette population avait des épisodes de pouls irrégulier [6,7]. L’évaluation cardiologique qui s’en est suivie a confirmé la présence d’une fibrillation auriculaire chez 84 et 87% de ces personnes. Nous parlons de fibrillation auriculaire subclinique lorsqu’un enregistrement automatique – par exemple au moyen d’un stimulateur cardiaque ou d’une montre intelligente – suggère une fibrillation auriculaire chez un patient asymptomatique, mais que cela ne peut pas être confirmé par un ECG standard [1]. Les épisodes auriculaires à haut débit sont mentionnés dans les guidelines comme une forme particulière de fibrillation auriculaire infraclinique. Elles correspondent à des tachycardies auriculaires paroxystiques documentées par un stimulateur ou un défibrillateur implanté. En règle générale, elles sont définies comme des tachycardies avec une fréquence auriculaire supérieure à 175/min et une durée minimale de 5 minutes. Si de tels épisodes sont trouvés et documentés sur un ECG au cours de l’évolution et interprétés comme une fibrillation auriculaire, le diagnostic de fibrillation auriculaire clinique peut être posé. La prise en charge des patients atteints de fibrillation auriculaire infraclinique, tant en ce qui concerne les ACO que le traitement éventuel du trouble du rythme, n’est pas encore définitivement établie. En cas de risque élevé d’AVC et d’épisodes fréquents/prolongés (par ex. >24 heures), une anticoagulation orale est généralement recommandée ; en revanche, en cas de risque faible ou moyen avec des épisodes plutôt rares (<6 minutes), elle n’est pas recommandée. Dans la grande zone d’ombre qui se trouve entre les deux, des études en cours permettront de clarifier la situation par la suite [8,9].
Indication de l’anticoagulation orale dans la fibrillation auriculaire
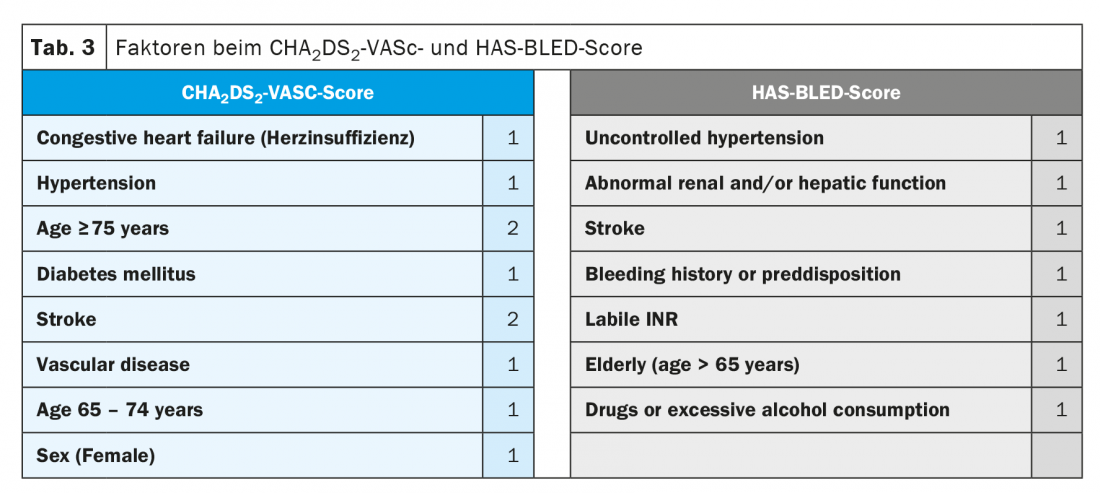
La nécessité de diluer le sang chez les patients présentant une fibrillation auriculaire clinique est déterminée par le risque calculé sur la base du score CHA2DS2-VASC (tableau 3). Il est important de noter que la durée et la fréquence de la fibrillation auriculaire ne sont pas prises en compte dans le score CHA2DS2-VASC. Bien que les données des registres confirment que le risque d’événements thromboemboliques augmente avec la gravité de la fibrillation auriculaire (AHRE/fibrillation auriculaire subclinique < fibrillation auriculaire paroxystique < fibrillation auriculaire permanente) [10–12], seuls les facteurs de risque décrits dans le score CHA2DS2-VASC déterminent l’indication d’une anticoagulation orale. [1]. Si le score CHA2DS2-VASC est ≥2 chez les hommes ou ≥3 chez les femmes, une anticoagulation orale est indiquée, de préférence au moyen d’un NOAK (recommandation de classe I, “niveau de preuve” A). Si le score CHA2DS2-VASC est de 0 pour les hommes ou de 1 pour les femmes, il ne faut pas diluer le sang et s’il est de 1 (ou de 2 pour les femmes), les directives recommandent une anticoagulation orale avec une recommandation de classe IIa (niveau de preuve B) [1,13]. Nouveauté dans les guidelines actuelles, l’évaluation du risque de saignement au moyen du score HAS-BLED a pris une importance accrue (tab. 3) [1]. Il est important de noter que le score HAS-BLED n’a pas pour but de priver les patients d’une anticoagulation orale (car il n’a jamais été étudié pour cela dans une étude randomisée), mais d’identifier les risques hémorragiques modifiables (par exemple une pression artérielle insuffisamment contrôlée, des patients difficiles à équilibrer sous antagonistes de la vitamine K) en cas de risque hémorragique élevé (score HAS-BLED ≥3) et de les traiter, voire de contrôler encore plus régulièrement de tels patients en fonction du contexte clinique afin de pouvoir réagir rapidement à d’éventuels problèmes hémorragiques [1].
Les NOAKs en cas de fibrillation auriculaire et de cardiopathie coronarienne
La présence simultanée d’une maladie coronarienne (MC) et d’une fibrillation auriculaire est fréquente et s’accompagne d’un risque accru d’événements cardiovasculaires. Il convient de distinguer deux scénarios différents : Les patients souffrant d’un syndrome coronarien aigu ou d’une intervention coronarienne et ceux présentant une situation coronarienne chronique (anciennement appelée “stable”).
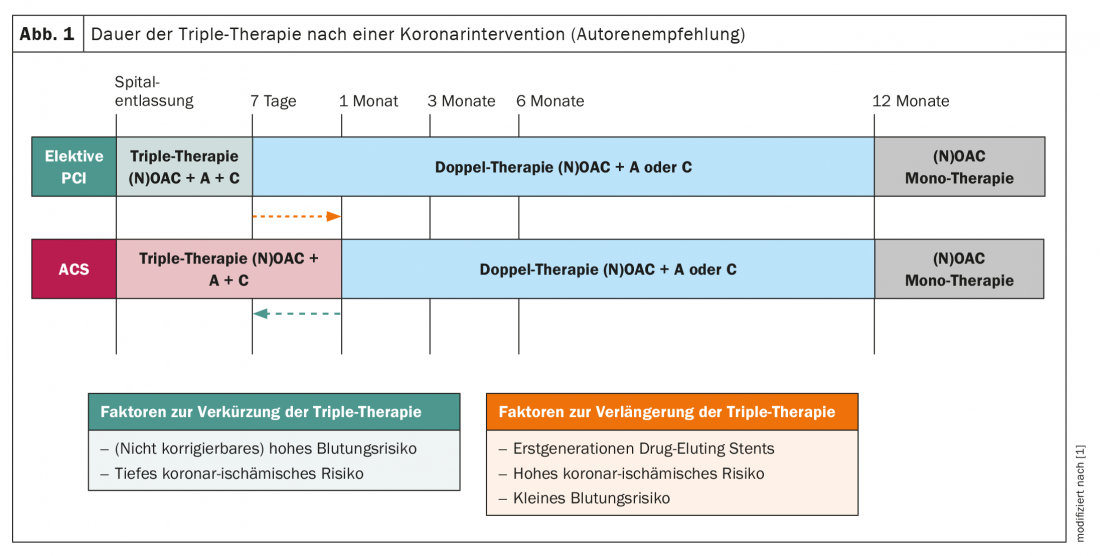
Patients souffrant de fibrillation auriculaire et présentant un syndrome coronarien aigu ou nécessitant une intervention coronarienne : dans le passé, les patients souffrant de fibrillation auriculaire et présentant un syndrome coronarien aigu ou nécessitant une intervention coronarienne élective étaient traditionnellement traités par une triple anticoagulation à base d’antagonistes de la vitamine K, souvent jusqu’à un an. L’étude WOEST a montré que les dommages (événements hémorragiques) sont souvent nettement plus importants que le bénéfice incrémental (protection contre de nouveaux événements thromboemboliques) par rapport à une double anticoagulation (warfarine et un seul antiplaquettaire), en particulier lorsque la trithérapie est administrée pendant 12 mois [14]. C’est pourquoi on a abandonné depuis un certain temps déjà cette longue période d’anticoagulation plus intensive ; mais le rôle des NOAK dans cette situation clinique n’était pas clair jusqu’à récemment. Il existe désormais des études randomisées pour les quatre substances, qui ont examiné chaque NOAK, y compris la durée du traitement dans ce scénario (PIONEER AF-PCI pour le rivaroxaban [15], RE-DUAL PCI pour le dabigatran [16], ENTRUST AF-PCI pour l’edoxaban [17], et AUGUSTUS pour l’apixaban [18]). Les quatre études ont montré que la survenue d’hémorragies pertinentes est significativement plus faible sous une combinaison d’un NOAK avec un antiplaquettaire que par rapport à une triple combinaison avec un antagoniste de la vitamine K, sans qu’un effet sur la mortalité globale ne soit démontré (contrairement à l’étude WOEST). Ces données montrent que l’association d’un antiagrégant plaquettaire et d’un NOAK est sûre chez les patients souffrant de fibrillation auriculaire et d’une intervention coronarienne/d’un SCA (Fig. 1). Cependant, il convient de noter que les études ont montré un signal cohérent d’une légère augmentation possible du taux d’infarctus du myocarde et de thrombose de stent [19]. En ce qui concerne la durée de la triple anticoagulation, les nouvelles directives de l’ESC recommandent de la suivre pendant <7 jours après un SCA ou une intervention élective, puis de passer à une bithérapie (NOAK et, en règle générale, clopidogrel). Toutefois, en cas de risque ischémique coronaire élevé, ce délai peut être prolongé jusqu’à 1 mois, ce qui semble tout à fait acceptable compte tenu du signal mentionné d’un risque discrètement accru d’infarctus du myocarde chez ces patients. La bithérapie doit ensuite être poursuivie dans les deux scénarios cliniques jusqu’au 12e mois inclus (6e mois en cas de risque hémorragique élevé) (Fig. 1).
Patients atteints de fibrillation auriculaire et de cardiopathie coronarienne chronique : depuis les directives de l’ESC de 2010, il est recommandé de traiter les patients atteints de cardiopathie coronarienne chronique et de FHV avec des antagonistes de la vitamine K seuls, sans ajouter d’aspirine, sur la base d’études plus anciennes dans ce cadre. Les études d’enregistrement des NOAK pour les patients atteints de fibrillation auriculaire ont inclus une proportion pertinente de patients coronariens. Cette population ne s’est pas comportée différemment des autres participants à l’étude, ce qui a permis de conclure que les NOAK pouvaient également être administrés en monothérapie en cas de maladie coronarienne chronique. Dans l’étude AFIRE, spécifiquement conçue à cet effet, 2 236 patients coronariens chroniques atteints de fibrillation auriculaire ont été inclus au Japon et randomisés pour recevoir le rivaroxaban (à la dose autorisée au Japon de 15 mg) plus aspirine ou le rivaroxaban en monothérapie [20]. Comme on pouvait s’y attendre, la monothérapie était supérieure au traitement combiné en termes d’événements hémorragiques (HR 0,59 ; p=0,01) ; parallèlement, aucune augmentation des événements thromboemboliques n’a été observée (au contraire, le nombre de ces événements était même numériquement inférieur de 30%). Ces données soutiennent la recommandation d’utiliser les NOAK en monothérapie (sans association avec un antiplaquettaire) chez les patients atteints de coronaropathie chronique et de fibrillation auriculaire.
Digression : anticoagulation chez les patients atteints de cardiopathie coronarienne chronique SANS fibrillation auriculaire
Les patients atteints de coronaropathie chronique sans FVH étaient jusqu’à présent traités par aspirine en prévention secondaire [21]. Contrairement à ce que l’on disait jusqu’à présent, ces patients ne sont pas considérés comme “stables”, mais présentent toujours un risque important d’événements cardiovasculaires et une mortalité globale plus élevée. Afin de réduire ce taux, l’étude COMPASS a examiné si l’inhibition simultanée des plaquettes (par l’aspirine) et de la cascade de coagulation plasmatique – cette dernière par le rivaroxaban à très faible dose de 2× 2,5 mg par jour – présentait un avantage [22]. Sur les presque 24 000 patients inclus, le traitement combiné a montré une réduction significative de 24% du critère d’évaluation primaire (AVC, infarctus du myocarde, décès cardiovasculaire) par rapport à l’aspirine seule. En raison de l’utilité prononcée, l’étude a dû être arrêtée prématurément un an avant la fin prévue. Bien que l’incidence des saignements ait augmenté de 70% avec la combinaison, aucune différence n’a été observée en ce qui concerne les saignements importants cliniquement significatifs et les redoutables hémorragies intracrâniennes. Cela montre que la majorité des événements hémorragiques n’étaient pas cliniquement dangereux, contrairement aux événements ischémiques évités. Afin de comparer ce qui est comparable, l’étude COMPASS a prédéfini ce que l’on appelle un bénéfice clinique net. Celui-ci regroupe les événements thromboemboliques et hémorragiques les plus graves. Le taux d’événements a été réduit de 20% avec le traitement combiné par rapport à la monothérapie. Il convient également de noter que ce bénéfice clinique net augmente avec le temps, car les événements hémorragiques se sont produits principalement au début – mais le risque d’événements ischémiques augmente régulièrement au fil des ans [23]. Enfin, il convient de mentionner que la mortalité globale était plus faible dans le traitement combiné par rapport à l’aspirine en monothérapie (même si l’étude n’était plus alimentée en raison de l’arrêt prématuré) [22]. Ces données sont désormais prises en compte dans les nouvelles recommandations de l’ESC sur la prophylaxie secondaire de la maladie coronarienne chronique, où l’association d’aspirine et de rivaroxaban 2× 2,5 mg peut être considérée comme une nouvelle option thérapeutique [24].
Messages Take-Home
- Les anticoagulants oraux non vitamine K-dépendants sont aujourd’hui l’étalon-or de la prévention des accidents vasculaires cérébraux dans la fibrillation auriculaire.
- Le traitement complet de la fibrillation auriculaire comprend, outre l’anticoagulation et le contrôle du rythme/de la fréquence, le traitement des facteurs de risque cardiovasculaire.
- Des dispositifs modernes tels que les téléphones portables et les montres numériques peuvent également être utilisés avec le logiciel approprié pour assurer le diagnostic.
- Les NOAK peuvent également être utilisés seuls chez les patients atteints de cardiopathie coronarienne à l’état chronique.
Littérature :
- Hindricks G, Potpara T, Dagres N, et al : 2020 ESC Guidelines for the diagnosis and management of atrial fibrillation developed in collaboration with the European Association of Cardio-Thoracic Surgery (EACTS). Eur Heart J. 2020.
- Pathak RK, Middeldorp ME, Meredith M, et al. : Long-Term Effect of Goal-Directed Weight Management in an Atrial Fibrillation Cohort : A Long-Term Follow-Up Study (LEGACY). J Am Coll Cardiol. 2015;65 : 2159-2169.
- Dzeshka MS, Shantsila A, Shantsila E, Lip GYH : Fibrillation auriculaire et hypertension. Hypertension. 2017;70 : 854-861.
- Chang SH, Wu LS, Chiou MJ, et al : Association of metformin with lower atrial fibrillation risk among patients with type 2 diabetes mellitus : a population-based dynamic cohort and in vitro studies. Cardiovasc Diabetol. 2014;13 : 123.
- Li L, Wang ZW, Li J, et al : Efficacité de l’ablation par cathéter de la fibrillation auriculaire chez les patients souffrant d’apnée obstructive du sommeil avec et sans traitement par pression positive continue : une méta-analyse des études d’observation. Europace. 2014;16 : 1309-1314.
- Guo Y, Wang H, Zhang H, et al : Mobile Photoplethysmographic Technology to Detect Atrial Fibrillation. J Am Coll Cardiol. 2019;74 : 2365-2375.
- Perez MV, Mahaffey KW, Hedlin H, et al. : Large-Scale Assessment of a Smartwatch to Identify Atrial Fibrillation. N Engl J Med. 2019;381 : 1909-1917.
- Lopes RD, Alings M, Connolly SJ, et al. : Raison d’être et conception de l’essai Apixaban pour la réduction des thrombo-embolismes chez les patients atteints de fibrillation auriculaire sub-clinique détectée par un dispositif (ARTESiA). Am Heart J. 2017;189 : 137-145.
- Kirchhof P, Blank BF, Calvert M, et al : Probing oral anticoagulation in patients with atrial high rate episodes : Rationale and design of the Non-vitamin K antagonist Oral anticoagulants in patients with Atrial High rate episodes (NOAH-AFNET 6) trial. Am Heart J. 2017;190 : 12-18.
- Mahajan R, Perera T, Elliott AD, et al : Subclinical device-detected atrial fibrillation and stroke risk : a systematic review and meta-analysis. Eur Heart J. 2018;39 : 1407-1415.
- Perera KS, Sharma M, Connolly SJ, et al : Type d’accident vasculaire cérébral et sévérité chez les patients atteints de fibrillation auriculaire sous-clinique : Une analyse de la fibrillation auriculaire asymptomatique et de l’évaluation de l’accident vasculaire cérébral chez les patients pacemakers et de l’essai de réduction de la fibrillation auriculaire (ASSERT). Am Heart J. 2018;201 : 160-163.
- Ogawa H, An Y, Ikeda S, et al : Progression de la fibrillation auriculaire paroxystique à la fibrillation auriculaire soutenue est associée à une augmentation des événements indésirables. Accident vasculaire cérébral. 2018;49 : 2301-2308.
- Fauchier L, Clementy N, Bisson A, et al : Should Atrial Fibrillation Patients With Only 1 Nongender-Related CHA2DS2-VASc Risk Factor Be Anticoagulated ? Stroke. 2016;47 : 1831-1836.
- Dewilde WJ, Oirbans T, Verheugt FW, et al. : Use of clopidogrel with or without aspirin in patients taking oral anticoagulant therapy and subgoing percutaneous coronary intervention : an open-label, randomised, controlled trial. Lancet . 2013;381 : 1107-1115.
- Gibson CM, Mehran R, Bode C, et al : Prevention of Bleeding in Patients with Atrial Fibrillation Undergoing PCI. N Engl J Med. 2016;375 : 2423-2434.
- Cannon CP, Bhatt DL, Oldgren J, et al : Dual Antithrombotic Therapy with Dabigatran after PCI in Atrial Fibrillation. N Engl J Med. 2017;377 : 1513-1524.
- Vranckx P, Valgimigli M, Eckardt L, et al. : Edoxaban-based versus vitamin K antagonist-based antithrombotic regimen after successful coronary stenting in patients with atrial fibrillation (ENTRUST-AF PCI) : a randomised, open-label, phase 3b trial. Lancet . 2019;394 : 1335-1343.
- Lopes RD, Heizer G, Aronson R, et al : Traitement antithrombotique après syndrome coronarien aigu ou PCI dans la fibrillation auriculaire. N Engl J Med. 2019;380 : 1509-1524.
- Gargiulo G, Goette A, Tijssen J, et al : Safety and efficacy outcomes of double vs triple antithrombotic therapy in patients with atrial fibrillation following percutaneous coronary intervention : a systematic review and meta-analysis of non-vitamin K antagonist oral anticoagulant-based randomized clinical trials. Eur Heart J. 2019;40 : 3757-3767.
- Yasuda S, Kaikita K, Akao M, et al : Antithrombotic Therapy for Atrial Fibrillation with Stable Coronary Disease. N Engl J Med. 2019;381 : 1103-1113.
- Antithrombotic Trialists C, Baigent C, Blackwell L, et al. : Aspirin in the primary and secondary prevention of vascular disease : collaborative meta-analysis of individual participant data from randomised trials. Lancet . 2009;373 : 1849-1860.
- Eikelboom JW, Connolly SJ, Bosch J, et al : Rivaroxaban with or without Aspirin in Stable Cardiovascular Disease. N Engl J Med. 2017;377 : 1319-1330.
- Steffel J, Eikelboom JW, Anand SS, et al. : The COMPASS Trial : Net Clinical Benefit of Low-Dose Rivaroxaban Plus Aspirin as Compared With Aspirin in Patients With Chronic Vascular Disease. Circulation. 2020;142 : 40-48.
- Knuuti J, Wijns W, Saraste A, et al : 2019 ESC Guidelines for the diagnosis and management of chronic coronary syndromes. Eur Heart J. 2020;41 : 407-477.
- Steffel, et al : European Heart Journal 2018 ; 39 : 1330-1393.
CARDIOVASC 2020 : 19(4) : 6-10