La réponse Th2 de la dermatite atopique est fortement contrôlée par l’IL-13, qui active le récepteur de type II en se liant à la chaîne IL-13Rα. L’IL-13 est exprimée à des niveaux plus élevés que l’IL-4 dans les lésions cutanées des patients atteints de dermatite atopique et ses effets directs sur la peau sont de mieux en mieux compris. En ciblant spécifiquement ces pathomécanismes, nous nous rapprochons de l’objectif d’une médecine de précision individualisée.
La dermatologie, comme la peau elle-même, est en constante évolution. Comme partout ailleurs en médecine, notre compréhension des processus pathophysiologiques de base s’est considérablement élargie et nous apprenons chaque jour. Pendant longtemps, le seul traitement de la dermatite atopique consistait principalement en l’utilisation de stéroïdes très puissants, complétés tout au plus par des inhibiteurs topiques de la calcineurine, une photothérapie et, dans les formes sévères, des immunosuppresseurs tels que la ciclosporine A. Cette approche peut maintenant être de plus en plus étendue grâce à notre compréhension plus détaillée de la pathologie sous-jacente et à une utilisation beaucoup plus ciblée des produits pharmaceutiques [1].
La dermatite atopique, comme la pelade ou l’asthme bronchique, est une maladie dominante de type 2 causée par des interactions complexes entre la génétique et l’environnement. Néanmoins, des points communs entre des phénotypes cliniquement très différents peuvent être identifiés. Certaines interleukines et leurs récepteurs, ainsi que les voies de signalisation en aval, se sont révélés d’une importance capitale.
L’origine de la réponse immunitaire T2 réside probablement dans la protection contre les infections parasitaires. Outre les cellules T auxiliaires classiques de type 2 (cellules Th2), les sources des cytokines essentielles IL-4, IL-13 et IL-5 comprennent les cellules lymphoïdes innées de type 2 (ILC-2), les mastocytes et les basophiles. IL-5 joue également un rôle clé dans la maturation et le recrutement des éosinophiles dans la plupart des tissus, où ils agissent comme cellules effectrices des réactions allergiques [2].
Mode d’action moléculaire
L’IL-4 et l’IL-13 se lient à des récepteurs spécifiques. Les récepteurs de type I sont principalement exprimés dans les ganglions lymphatiques et jouent un rôle dans la réponse immunitaire humorale, tandis que les récepteurs de type II médient la réponse immunitaire dans les tissus périphériques et donc dans la peau. L’IL-4 peut activer les deux récepteurs, alors que l’IL-13 n’active que le récepteur de type II [3]. L’IL-13 et l’IL-4 se lient toutes deux au récepteur dit de type II, composé de la sous-unité IL-4Rα et de la sous-unité IL-13Rα1. Dans ce processus, les deux cytokines sont en compétition pour se lier au récepteur de type II – par conséquent, le rapport IL-4/IL-13 présent détermine laquelle des deux cytokines contrôle la réponse inflammatoire [4] (Fig. 1). En outre, l’IL-13 se lie au récepteur IL-13Rα2, mais son rôle n’est pas encore totalement compris [5]. La réponse Th2 de la dermatite atopique n’est probablement pas contrôlée de manière prédominante par l’IL-4, comme on le pensait auparavant, mais plutôt principalement par l’IL-13 via le récepteur de type II [6–8].
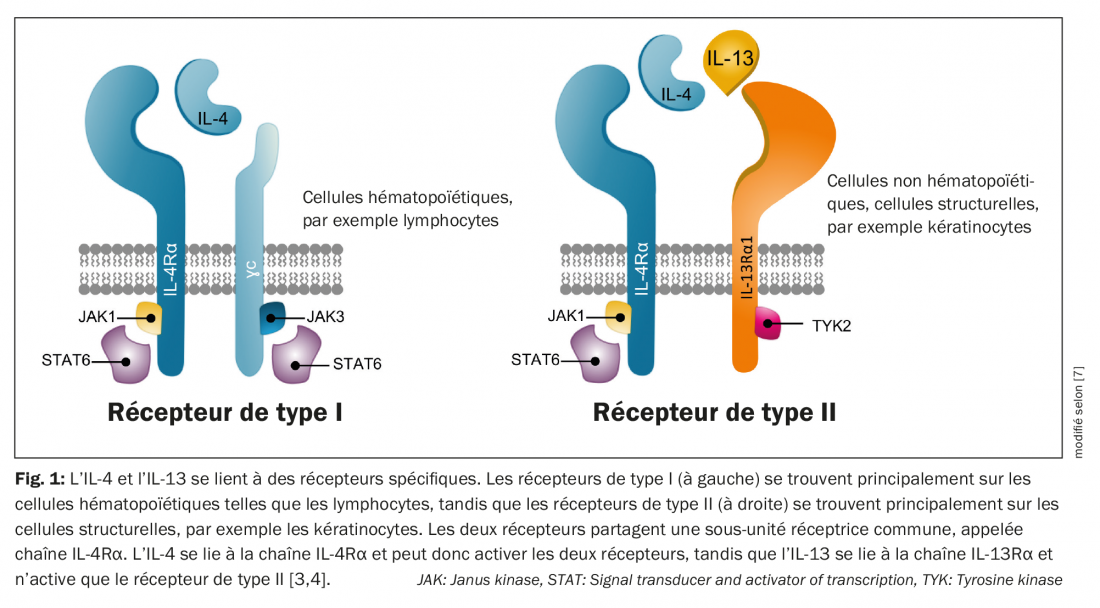
Expression et évolution de la maladie impliquant l’IL-13
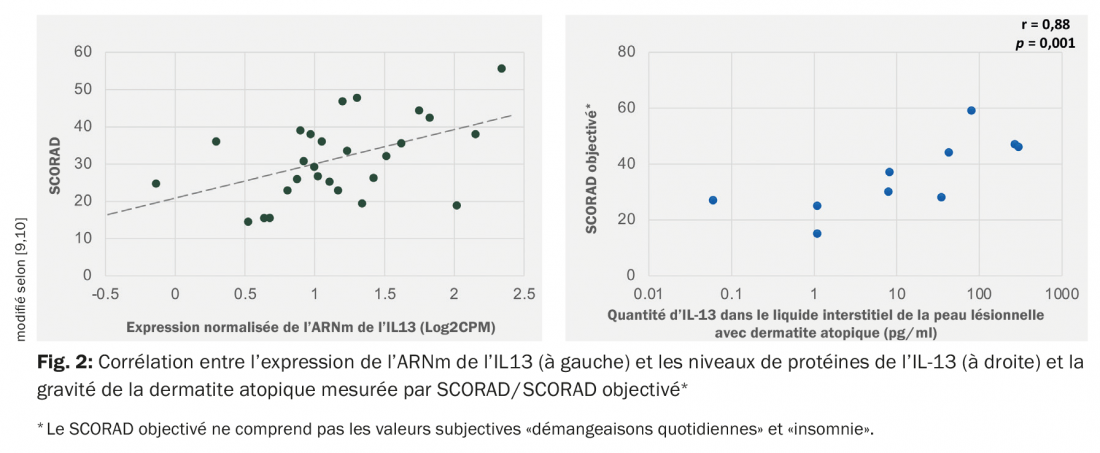
Des études ont montré que l’IL-13 est davantage exprimée que l’IL-4 dans les lésions cutanées des patients atteints de dermatite atopique. Le niveau d’expression de l’ARNm de l’IL-13 est corrélé positivement avec l’indice de sévérité (SCORAD, SCORing Atopic Dermatitis) [9–11] (Fig. 2).
Cascade de signalisation intracellulaire
Cibler les voies de signalisation impliquées dans la maladie est l’objectif de la médecine de précision (voir section ci-dessous). La liaison de l’IL-13 et de l’IL-4 à leurs récepteurs active des kinases en aval qui se phosphorylent mutuellement. Au récepteur de type II, l’IL-4 se lie via la chaîne IL-4Rα et l’IL-13 se lie via la chaîne IL-13Rα et active la Janus kinase (JAK) 1 et la tyrosine kinase 2 (TYK2). La liaison de l’IL-4 au récepteur de type I active JAK1 et JAK3 [4]. L’IL-5, qui est important pour le recrutement des éosinophiles en tant que cellules effectrices importantes dans les allergies, active également JAK2 [12]. La phosphorylation des JAK respectifs active le facteur de transcription STAT6 (Signal transducer and activator of transcription 6), qui déclenche l’expression génétique dans le noyau cellulaire. Les JAK étant impliqués dans diverses cascades de signalisation via différents types de récepteurs, leur blocage par des inhibiteurs de JAK (JAKis) constitue une autre approche thérapeutique possible et efficace, mais moins spécifique [13].
Effets de la surexpression de l’IL-13 sur la peau
Dans la dermatite atopique, l’IL-13 est de plus en plus produite par les mastocytes, les Th2, les ILC-2 et les cellules basophiles. Les kératinocytes sécrètent ce que l’on appelle des alarmines (TSLP, IL-33, IL-25) et stimulent ainsi les cellules ILC-2 à sécréter IL-13 et IL-5. Dans le même temps, cela réduit la sécrétion de peptides et de lipides antimicrobiens, ce qui rend la barrière cutanée plus perméable et entraîne une sensibilité accrue à S. aureus et une inflammation cutanée. La surproduction d’IL-13 alerte également le système immunitaire, provoquant une production accrue d’éosinophiles et de cellules Th2 et déclenchant une inflammation des tissus médiée par les cytokines (Fig. 3) [7]. D’autres cytokines telles que l’IL-10, l’IL-22 et l’IL-31 sont également impliquées [8].
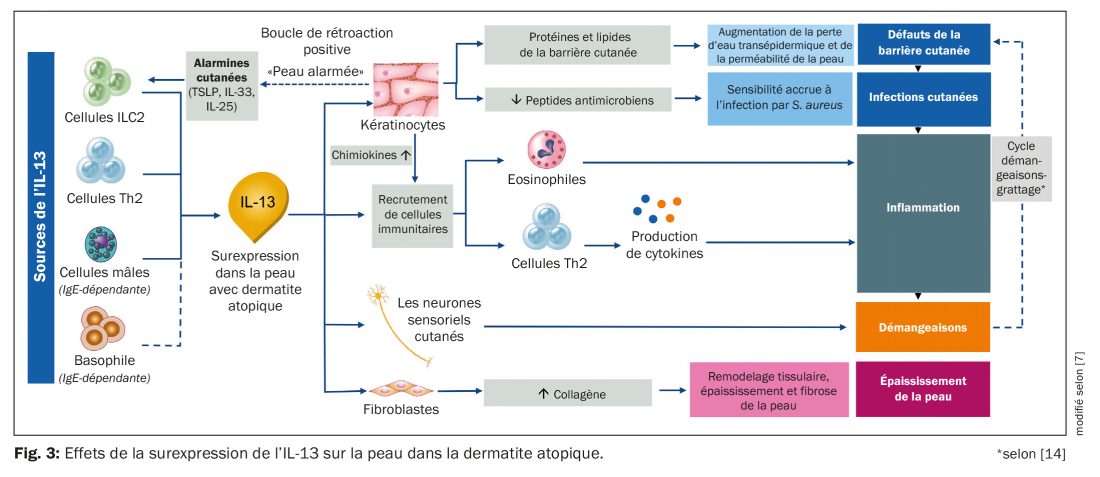
L’augmentation des démangeaisons est due à la stimulation répétée des neurones sensoriels cutanés, qui libèrent davantage d’IL-4 et d’IL-13 [7]. Une autre cytokine à fort potentiel pruritogène est l’IL-31 [15,16]. La libération de ces substances entraîne un cycle démangeaisons-grattage qui augmente encore la perméabilité de la barrière cutanée. La boucle de rétroaction ainsi déclenchée fait que les kératinocytes se mettent à nouveau en alerte et produisent davantage d’alarmines cutanées, qui stimulent à nouveau les cellules ILC-2 pour qu’elles produisent encore plus d’IL-13. À travers ce cycle, la cascade de signalisation est à nouveau initiée et l’état de la maladie s’aggrave. En outre, les fibroblastes sont stimulés pour se reproduire via l’IL-13; la production de collagène est augmentée, ce qui peut entraîner un épaississement de la peau et une fibrose cutanée supplémentaire. À plus long terme, cela conduit à une lichénification chronique de la peau [5,17–22].
Stratégies thérapeutiques
La dermatite atopique est une maladie fortement contrôlée par l’IL-13. Les stratégies thérapeutiques suivantes visant à inhiber l’activité biologique sont possibles [7]:
- petites molécules qui influencent l’interaction entre l’IL-13 et le récepteur: Modulateurs d’interaction protéine-protéine (MIPP).
- petites molécules qui influencent les voies de signalisation intracellulaires en aval (inhibiteurs de kinases, JAKis).
- les produits biologiques qui inhibent la signalisation via l’IL-13, par exemple en bloquant sa liaison au récepteur.
Les PPIM font actuellement l’objet de recherches; ils sont conçus à l’aide de bibliothèques moléculaires et de simulations dynamiques. Cette approche in silico permet de développer de nouveaux médicaments ciblant des interleukines spécifiques et leurs récepteurs [7,23].
Des JAKis de sélectivité différente sont déjà utilisés dans le traitement de la polyarthrite rhumatoïde. Des applications orales et topiques sont possibles pour le traitement de la dermatite atopique, et le début de l’action est très rapide. En raison de leur mode d’action, les JAKis inhibent partiellement plusieurs cytokines, par exemple l’IL4, l’IL-5, l’IL-31 et d’autres cytokines en plus de l’IL-13 – contrairement aux produits biologiques, qui n’inhibent presque complètement que certaines cytokines. Les JAKis de première génération inhibent principalement JAK1 et JAK2 (ruxolitinib et baricitinib) ou tous les JAK dans une mesure similaire (pan-JAKis delgocitinib, tofacitinib, peficitinib, oclacitinib) [13,24–27]. Le baricitinib est déjà autorisé en Suisse pour le traitement des patients adultes atteints de la maladie d’Alzheimer modérée à sévère [28]. L’oclacitinib possède une autorisation de mise sur le marché vétérinaire pour le traitement de la DA chez le chien [29]. La deuxième génération de JAKis est un peu plus sélective et agit principalement, mais pas exclusivement, sur JAK1 (abrocitinib, filgotinib, upadacitinib, itacitinib) ou TYK2 (BMS-986165) [25–27]. Les profils de sécurité et de tolérance des différents JAKis diffèrent selon la forme galénique et la molécule. Dans l’ensemble, les infections des voies respiratoires supérieures sont observées comme l’effet secondaire le plus fréquent; en outre, une augmentation de la créatine phosphokinase et des transaminases hépatiques peut être mesurée. En outre, un risque accru de survenue de l’herpès zoster est un effet secondaire possible [25,28].
Un produit biologique de première génération pour le traitement de la dermatite atopique est le dupilumab, un anticorps monoclonal administré par voie sous-cutanée qui se lie à la sous-unité IL-4Rα des récepteurs de type I et de type II. Ainsi, l’effet de signalisation médié par l’IL-4 et l’IL-13 est empêché par les récepteurs de type I et II. Le dupilumab est autorisé pour le traitement des patients atteints de dermatite atopique modérée à sévère en Suisse depuis 2019 [30]. Il présente une très bonne efficacité et un profil de tolérance favorable. Outre la dermatite atopique, il peut également être utilisé pour diverses autres pathologies telles que les formes sévères d’asthme bronchique et la rhinosinusite chronique avec polypes nasaux. Il faut noter que l’apparition d’une éosinophilie transitoire et l’augmentation de la fréquence des conjonctivites sont les symptômes concomitants les plus fréquents; les autres effets secondaires ou les modifications des paramètres de laboratoire sont très rares [2,31–33].
Médecine de précision par l’inhibition sélective de l’IL-13
Le blocage ciblé et spécifique des voies de signalisation moléculaires est l’objectif de la médecine de précision. Le développement des PPIMs va probablement montrer la voie de l’avenir dans ce domaine. Les produits biologiques lebrikizumab et tralokinumab ont été développés pour inhiber spécifiquement l’IL-13, et tous deux ont été étudiés dans la dermatite atopique [34]. Le lebrikizumab inhibe sélectivement la formation des complexes de signalisation des récepteurs hétérodimériques de l’IL-13Rα1 et de l’IL-4Rα [35]. Les études de phase IIb ont montré des effets rapides et dose-dépendants sur divers paramètres cliniques de la dermatite atopique [36]. Le tralokinumab est un anticorps monoclonal IgG4 entièrement humain qui se lie avec une très grande affinité à l’IL-13. L’épitope chevauche le site de liaison des récepteurs IL-13Rα, empêchant l’IL-13 de se lier à la fois à IL-13Rα1 et IL-13Rα2 [37]. Ainsi, un facteur important de la pathogenèse de la dermatite atopique est éliminé de manière sélective.
Il a été postulé que cette stratégie pourrait être plus efficace que le seul blocage de la liaison IL-13Rα1 [9]. Dans les essais cliniques menés chez des patients atteints de dermatite atopique modérée à sévère, le tralokinumab en association avec des stéroïdes a entraîné une amélioration rapide et durable des symptômes de la DA pendant au moins 52 semaines. L’EASI, l’indice SCORAD, l’indice de qualité de vie dermatologique (DLQI) et l’échelle d’évaluation numérique du prurit ont montré des valeurs significativement meilleures par rapport au groupe placebo [2,38–40]. En outre, un bon profil de tolérance et de sécurité a été démontré, avec également une éosinophilie mesurable transitoirement et une incidence légèrement accrue de conjonctivite, avec une réduction simultanée des infections cutanées par rapport au groupe témoin [7,39,40].
Aperçu
La dermatite atopique se caractérise par un large éventail de phénotypes cliniques. Nous reconnaissons de plus en plus que des mécanismes basaux, génétiques et immunopathogéniques complexes sous-tendent cette maladie. L’absence d’un facteur unique et explicatif complique la réponse thérapeutique et nécessite une thérapie individualisée. Le traitement sur mesure est le défi et l’objectif de la médecine centrée sur le patient. L’IL-13 est exprimée à des niveaux plus élevés que l’IL-4 dans les lésions cutanées des patients atteints de dermatite atopique et ses effets directs sur la peau sont de mieux en mieux compris. Plus nous parviendrons à agir spécifiquement sur ces pathomécanismes, plus nous nous rapprocherons de l’objectif d’une médecine de précision individualisée dans la dermatite atopique également.
Messages clés
- Les sources des cytokines IL-4, IL-13, IL-5 sont les cellules Th2 et les cellules ILC-2, les mastocytes et les basophiles.
- L’IL-4 se lie aux récepteurs de type I et de type II.
- L’IL-13 ne se lie qu’aux récepteurs de type II présents dans la peau.
- La réponse Th2 de la dermatite atopique est fortement contrôlée par l’IL-13, qui active le récepteur de type II en se liant à la chaîne IL-13Rα.
- L’IL-13 est exprimée à un niveau plus élevé que l’IL4 chez les patients atteints de dermatite atopique et est en corrélation avec la gravité de la maladie.
Littérature:
- Siegels D, Heratizadeh A, Abraham S, European Academy of Allergy, Clinical Immunology Atopic Dermatitis Guideline group, et al.: European Academy of Allergy, Clinical Immunology Atopic Dermatitis Guideline group. Systemic treatments in the management of atopic dermatitis: A systematic review and meta-analysis. Allergy. 2021;76: 1053–1076.
- Gandhi NA, Bennett BL, Graham NM, et al.: Targeting key proximal drivers of type 2 inflammation in disease. Nat Rev Drug Discov. 2016;15: 35–50.
- Mueller TD, Zhang JL, Sebald W, Duschl A: Structure, binding, and antagonists in the IL-4/IL-13 receptor system. Biochim Biophys Acta. 2002;1592(3): 237–250.
- McCormick SM, Heller NM: Commentary: IL-4 and IL-13 receptors and signaling. Cytokine. 2015; 75: 38–50.
- Bao K, Reinhardt RL: The differential expression of IL-4 and IL-13 and its impact on type-2 immunity. Cytokine. 2015; 75: 25–37.
- Leung DY, Bieber T: Atopic dermatitis. Lancet 2003; 361: 151–160. [PubMed: 12531593]
- Bieber T: Interleukin-13: Targeting an underestimated cytokine in atopic dermatitis. Review. Allergy 2020; 75: 54–62.
- Langan SM, Irvine AD, Weidinger S: Atopic dermatitis. Lancet 2020; 396: 345–360.
- Tsoi J, Rodriguez E, Sarkar MK, et al.: Atopic dermatitis is an IL-13 dominant disease with greater molecular heterogeneity compared to psoriasis. J Invest Dermatol 2019;139: 1480–1489.
- Szegedi K, Lutter R, et al.: Cytokine profiles in interstitial fluid from chronic atopic dermatitis skin. JEADV 2015; 29: 2136–2144.
- Ungar B, Garcet S, Gonzalez J, et al.: An integrated model of atopic dermatitis biomarkers highlights the systemic nature of the disease. J Invest Dermatol 2017; 137: 603–613.
- Long H, Liao W, Wang L, Lu Q: A player and coordinator: the versatile roles of eosinophils in the immune system. Transfus Med Hemother. 2016; 43: 96–108.
- Mobasher P, Heydari Seradj M, Raffi J, et al.: Oral small molecules for the treatment of atopic dermatitis: a systematic review. J Dermatolog Treat. 2018; 201: 1–8.
- Mack MR, Kim BS: The Itch-Scratch Cycle: A Neuroimmune Perspective. Trends Immunol 2018; 39: 980–991.
- Datsi A, Steinhoff M, Ahmad F, et al.: Interleukin-31: The «itchy» cytokine in inflammation and therapy. Allergy. 2021 Feb 24. doi: 10.1111/all.14791. Epub ahead of print.
- Dillon SR, Sprecher C, Hammond A, et al.; Interleukin 31, a cytokine produced by activated T cells, induces dermatitis in mice. Nat Immunol 2004;5: 752–760.
- Salimi M, Barlow JL, Saunders SP, et al.: A role for IL-25 and IL-33- driven type-2 innate lymphoid cells in atopic dermatitis. J Exp Med. 2013; 210: 2939–2950.
- Moriya C, Jinnin M, Yamane K, et al.: Expression of matrix metalloproteinase-13 is controlled by IL-13 via PI3K/Akt3 and PKC-d in normal human dermal fibroblasts. J Invest Dermatol 2011; 131: 655–661.
- Howell MD, Kim BE, Gao P, et al.: Cytokine modulation of atopic dermatitis filaggrin skin expression. J Allergy Clin Immunol 2007; 120: 150–155.
- Kim BE, Leung DY, Boguniewicz M, Howell MD: Loricrin and involucrin expression is down-regulated by Th2 cytokines through STAT-6. Clin Immunol 2008; 126: 332–337.
- Berdyshev E, Goleva E, Bronova I, et al. Lipid abnormalities in atopic skin are driven by type 2 cytokines. JCI Insight. 2018;3(4). https://doi.org/10.1172/jci.insight.98006
- Oetjen LK, Mack MR, Feng J, et al.: Sensory neurons co-opt classical immune signaling pathways to mediate chronic itch. Cell 2017; 171: 217–228.
- Majumdar S, Ghosh A, Saha S: Modulating interleukins and their receptors interactions with small chemicals using in silico approach for asthma. Curr Top Med Chem 2018; 18: 1123–1113.
- Gadina M, Le MT, Schwartz DM, et al.: Janus kinases to jakinibs: from basic insights to clinical practice. Rheumatology. 2019;58(suppl 1): i4–i16.
- Rodrigues MA, Torres T: JAK/STAT inhibitors for the treatment of atopic dermatitis. J Dermatolog Treat. 2020; 31: 33–40.
- Cotter DG, Schairer D, Eichenfield L: Emerging therapies for atopic dermatitis: JAK inhibitors. J Am Acad Dermatol. 2018;78(suppl 1): S53–S62.
- Schwartz DM, Kanno Y, Villarino A, et al.: JAK inhibition as a therapeutic strategy for immune and inflammatory diseases. Nat Rev Drug Discov 2017: 843–862.
- Informations techniques Olumiant® (Baricitinib). www.swissmedicinfo.ch
- Informations techniques Apoquel® (Oclacitinib). www.tierarzneimittel.ch
- Informations techniques Dupixent® (Dupilumab). www.swissmedicinfo.ch
- Chang HY, Nadeau KC. IL-4Ralpha inhibitor for atopic disease. Cell. 2017;170: 222.
- Beck LA, Thaçi D, Hamilton JD, et al.: Dupilumab treatment in adults with moderate-to-severe atopic dermatitis. N Engl J Med. 2014 Jul 10; 371: 130–139.
- Simpson EL, Bieber T, Guttman-Yassky E, et al.: Two Phase 3 Trials of Dupilumab versus Placebo in Atopic Dermatitis. N Engl J Med. 2016; 375: 2335–2348.
- Gonçalves F, Freitas E, Torres T: Selective IL-13 inhibitors for the treatment of atopic dermatitis. Drugs Context. 2021;10: 1–7.
- Ultsch M, Bevers J, Nakamura G, et al.: Structural basis of signaling blockade by anti-IL-13 antibody Lebrikizumab. J Mol Biol. 2013; 425(8): 1330–1339.
- Guttman-Yassky E, Blauvelt A, Eichenfield LF, et al.: Efficacy and Safety of Lebrikizumab, a High-Affinity Interleukin 13 Inhibitor, in Adults With Moderate to Severe Atopic Dermatitis: A Phase 2b Randomized Clinical Trial. JAMA Dermatol 2020 Apr 1; 156(4): 411–420.
- Popovic B, Breed J, Rees DG, et al.: Structural characterisation reveals mechanism of IL-13-neutralising monoclonal antibody tralokinumab as inhibition of binding to IL-13Ralpha1 and IL-13Ralpha2. J Mol Biol 2017;429: 208–219.
- Wollenberg A, Howell MD, Guttman-Yassky E, et al.: Treatment of atopic dermatitis with tralokinumab, an anti–IL-13 mAb. J Allergy Clin Immunol 2019; 143: 135–141.
- Wollenberg A, Blauvelt A, Guttman-Yassky E, et al.: Tralokinumab for moderate-to-severe atopic dermatitis: results from two 52-week, randomized, double-blind, multicentre, placebo-controlled phase III trials (ECZTRA 1 and ECZTRA 2). Br J Dermatol 2021; 184: 437–449.
- Silverberg JI, Toth D, Bieber T, et al.: Tralokinumab plus topical corticosteroids for the treatment of moderate-to-severe atopic dermatitis: results from the double-blind, randomized, multicentre, placebo-controlled phase III ECZTRA 3 trial. Br J Dermatol 2021; 184: 450–463.
DERMATOLOGIE PRAXIS 2021; 31(4): 10–14 (publié en allemand)













