L’immunothérapie prend également de plus en plus d’importance dans le traitement du carcinome urothélial. Les inhibiteurs de points de contrôle sont déjà utilisés avec succès, en particulier dans les tumeurs avancées. Les applications potentielles de l’avelumab, de l’atezolizumab et autres se profilent désormais à des stades plus précoces de la maladie et dans des lignes de traitement.
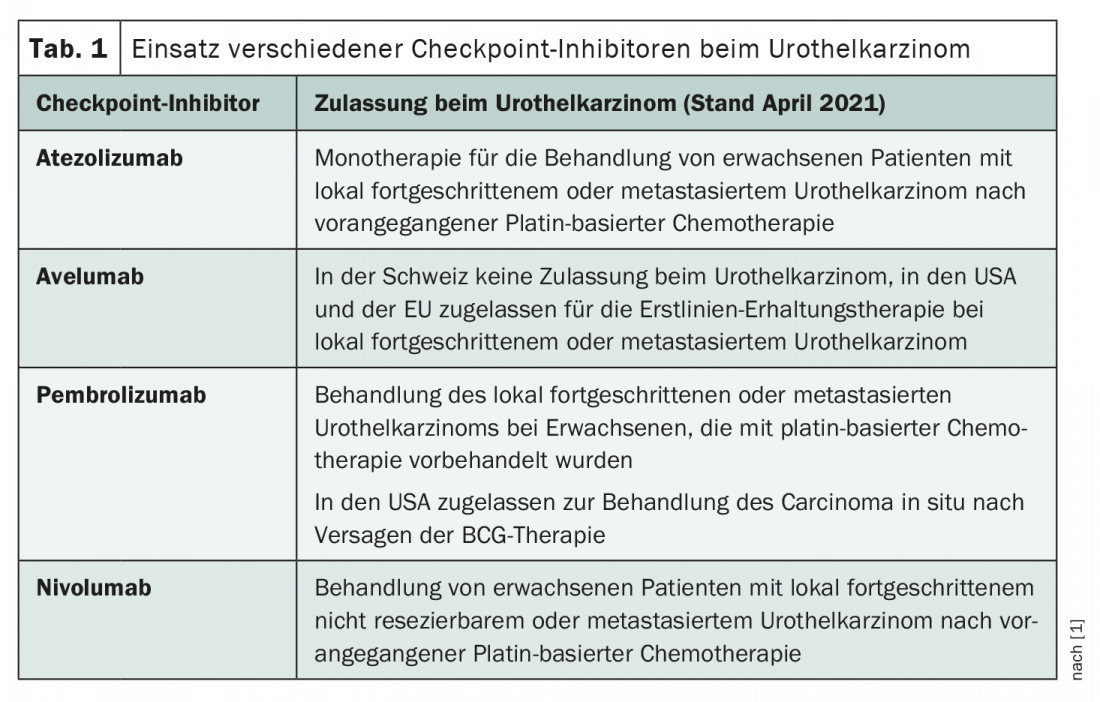
En Suisse, le traitement par inhibiteur de point de contrôle du carcinome urothélial est actuellement autorisé uniquement pour le traitement de deuxième ligne des tumeurs localement avancées ou métastatiques [1]. Cependant, les récentes extensions d’indications de l’avelumab et du pembrolizumab par l’EMA (European Medicines Agency) et la FDA (U.S. Food and Drug Administration) devraient préfigurer une utilisation plus large de ces molécules à l’avenir. Arlene O. Siefker-Radtke, professeur d’oncologie urogénitale à l’Université du Texas, s’est penchée sur le rôle des inhibiteurs de points de contrôle dans le cancer urothélial lors de la réunion annuelle du NCCN de cette année et a présenté un aperçu des questions de recherche les plus brûlantes dans ce domaine.
Standard établi pour les tumeurs avancées
Au fil des ans, les chimiothérapies à base de platine se sont révélées particulièrement efficaces dans le traitement du carcinome urothélial avancé. Ainsi, la gemcitabine/cisplatine et le MVAC (méthotrexate, vinblastine, doxorubicine et cisplatine) sont encore aujourd’hui les traitements de première ligne les plus courants [2]. Cependant, dès le début du millénaire, des efforts ont été faits pour explorer des options immunothérapeutiques. Par exemple, des tentatives ont été faites pour utiliser l’interféron-α2b [3]. Ceux-ci n’ont toutefois pas eu de succès notable – jusqu’à l’arrivée des inhibiteurs de point de contrôle. En deuxième ligne, l’immunothérapie s’est rapidement imposée, si bien que Swissmedic a autorisé l’atezolizumab, le nivolumab et le pembrolizumab pour cette indication. D’autres domaines d’application font actuellement l’objet de recherches intensives, et l’entrée des inhibiteurs de points de contrôle dans le traitement de première ligne est non seulement possible, mais probable dans un avenir proche. En effet, ce n’est qu’en janvier de cette année que l’avelumab a été approuvé en Europe pour le traitement d’entretien de première ligne du carcinome urothélial avancé, moins d’un an après le feu vert de la FDA (tableau 1) .
Dans le cas du carcinome urothélial avancé, Siefker-Radtke explique qu’il existe en principe trois approches de traitement incluant des inhibiteurs de points de contrôle, qui sont actuellement au centre des préoccupations. Dans sa présentation, elle a fait la distinction entre les thérapies combinées, les thérapies d’entretien et l’utilisation séquentielle.
Inhibiteur de point de contrôle oui – mais comment ?
Outre les combinaisons de chimiothérapie et d’inhibiteurs de points de contrôle, les médicaments d’immunothérapie sont actuellement évalués dans le cadre d’un traitement d’entretien après une réponse à la chimiothérapie et dans le cadre d’une utilisation séquentielle, c’est-à-dire en cas de progression de la maladie après un traitement de première ligne. Selon Siefker-Radtke, le moment optimal de l’intervention, en particulier, n’est pas encore clair. Les données les plus convaincantes concernent les avantages de la deuxième ligne. Par exemple, le pembrolizumab prolonge la survie globale médiane d’environ trois mois après la progression de la maladie par rapport à une chimiothérapie à base de taxane [4]. L’inhibiteur de point de contrôle peut également marquer des points grâce à des taux de réponse plus élevés et à un profil de toxicité plus favorable. Il n’est donc pas surprenant que les inhibiteurs de points de contrôle soient déjà autorisés dans cette indication, y compris en Suisse.
Les données sont un peu plus minces en ce qui concerne les bénéfices d’un traitement d’entretien après une réponse à la chimiothérapie de première ligne. L’avelumab est actuellement au centre de cette question. La substance a été approuvée par la FDA en 2020 et par l’EMA en janvier de cette année pour le traitement d’entretien. Les dernières données ont été présentées dans le cadre du congrès 2020 de l’ASCO (American Society of Clinical Oncology) et suscitent l’espoir que l’avelumab pourrait bientôt jouer un rôle important en tant que médicament de première ligne en Suisse également, avec au moins une légère amélioration du pronostic dans le carcinome urothélial avancé. Ainsi, la médiane de survie globale dans l’étude a été prolongée de 14,3 à 21,4 mois par le traitement d’entretien. Cependant, Siefker-Radtke a souligné qu’il existait également des données moins claires. Par exemple, le pembrolizumab n’a pas encore convaincu dans le cadre du traitement d’entretien. Une amélioration de la survie sans progression (PFS) a été observée, mais pas de prolongation de la survie globale [5]. L’experte a notamment expliqué cela par le fait que l’étude sur le pembrolizumab autorisait le cross-over, c’est-à-dire l’utilisation de l’immunothérapeutique en cas de progression, alors que celle sur l’avelumab excluait cette option. Siefker-Radtke a conclu que le moment de l’application n’était potentiellement pas si décisif et que l’utilisation d’inhibiteurs de points de contrôle pourrait être en soi le facteur déterminant. En d’autres termes, “It’s a question of EVER immunotherapy vs. NEVER Immunotherapy”. Dans cette optique, il pourrait être tout à fait judicieux de renoncer à une utilisation précoce et d’attendre une progression ou une récidive de la maladie avant d’administrer l’immunothérapie. Enfin, il ne faut pas oublier les effets secondaires. Il reste donc à voir si un traitement d’entretien avec des inhibiteurs de points de contrôle s’imposera.
Diverses études se concentrent également sur la recherche d’une utilisation parallèle de la chimiothérapie et de l’immunothérapie en première ligne. Lors du congrès de l’European Society of Medical Oncology (ESMO) 2018, des données prometteuses ont été présentées sur l’administration néoadjuvante d’un traitement combiné de gemcitabine et de pembrolizumab, et l’étude IMvigor130 étudie l’ajout d’atezolizumab à la chimiothérapie dans le carcinome urothélial avancé, pour ne citer que deux exemples. Pour l’instant, cette approche n’a été approuvée nulle part, mais les résultats d’études de plus grande envergure laissent présager des changements potentiels dans le traitement au cours des prochaines années. Dans sa présentation, Siefker-Radtke a discuté des raisons pour et contre la thérapie combinée.
Tension entre synergisme et antagonisme
L’effet de l’administration simultanée de chimiothérapie et d’immunothérapie n’est pas facile à évaluer pour diverses raisons. Les multiples influences sur le système immunitaire et diverses interactions conduisent à une situation extrêmement complexe. Alors que la chimiothérapie, par exemple, entraîne une présentation accrue d’antigènes et pourrait donc renforcer l’effet des inhibiteurs de points de contrôle, elle provoque également une immunosuppression.
Siefker-Radtke a souligné en particulier deux raisons pour lesquelles une thérapie simultanée est nécessaire. Outre l’augmentation de la présentation des antigènes par la chimiothérapie, qui peut être bénéfique pour l’immunothérapie, le blocage des points de contrôle est également potentiellement bénéfique pour l’efficacité de la chimiothérapie. Ainsi, une expression élevée de PD-L1 après une chimiothérapie serait un facteur de mauvais pronostic et pourrait être réduite par une attaque ciblée. Le blocage supplémentaire de PD1/PD-L1 pourrait donc contribuer à prévenir les résistances à la chimiothérapie [6,7]. Les études menées jusqu’à présent suggèrent qu’un traitement combiné pourrait être particulièrement intéressant pour les personnes atteintes de métastases hépatiques. Ce sous-groupe, dont la maladie progresse généralement rapidement, répond nettement moins bien à une monothérapie par inhibiteurs de points de contrôle, comme l’ont montré des études sur des patients non éligibles au cisplatine [8,9].
Il existe toutefois des considérations qui s’opposent à l’utilisation conjointe de chimiothérapies et d’immunothérapies. Ainsi, l’effet des inhibiteurs de points de contrôle pourrait être atténué par la neutropénie induite par la chimiothérapie [10]. Selon Siefker-Radtke, la chimiothérapie entraîne également divers autres mécanismes qui favorisent la tolérance du système immunitaire et s’opposent ainsi à l’immunothérapie. Par exemple, le nombre de cellules dendritiques diminue sous chimiothérapie, alors que le nombre de cellules T régulatrices augmente. Dans ce contexte de tensions entre effets synergiques et antagonistes, il faut attendre les résultats d’études de plus grande envergure pour pouvoir juger définitivement de l’utilité réelle de la thérapie combinée.
Inhibiteurs de points de contrôle à des stades plus précoces de la maladie
Il existe de plus en plus de données qui plaident également en faveur de l’utilisation d’inhibiteurs de points de contrôle à des stades plus précoces de la maladie. L’experte a présenté ici deux indications dans lesquelles l’immunothérapie pourrait bientôt être utilisée : Le carcinome in situ superficiel de la vessie et comme traitement adjuvant après une chirurgie radicale. En cas d’échec du BCG, le pembrolizumab est déjà autorisé aux États-Unis pour le traitement du carcinome in situ. Dans l’étude Keynote 057, dont les derniers résultats ont été présentés au congrès ASCO 2020, 40% des patients ont connu une réponse complète au pembrolizumab après trois mois, qui a duré en moyenne 16,2 mois.
En outre, l’administration adjuvante d’inhibiteurs de points de contrôle suscite de l’espoir, en particulier en cas d’expression de PD-L1. Ainsi, l’administration postopératoire de nivolumab pendant un an a été étudiée dans l’étude de phase III Checkmate-274 chez des patients à haut risque. Des données récemment publiées montrent une augmentation de la survie médiane sans maladie dans la population totale, qui passe de 10,9 mois sous placebo à 21 mois. Cet effet était encore plus impressionnant en cas d’expression de PD-L1 ≥1%. En particulier, un plateau s’est dessiné dans le sous-groupe exprimant PD-L1 – ce qui, selon Siefker-Radtke, indique un contrôle à long terme de la maladie.
En fin de compte, les choses évoluent donc dans le domaine du carcinome urothélial. Dans les années à venir, les inhibiteurs de points de contrôle pourraient être de plus en plus utilisés à des stades plus précoces de la maladie, notamment en situation adjuvante et en cas de carcinome in situ. L’avenir dira si son utilisation en tant que traitement d’entretien du carcinome urothélial avancé peut s’imposer. Les combinaisons de chimiothérapie et d’immunothérapie n’en sont actuellement qu’à leurs débuts, mais elles sont loin d’être impensables.
Source : Conférence “New Settings for Immune Checkpoint Inhibitors in Urothelial Bladder Cancer”, Arlene O. Siefker-Radtke, MD, dans le cadre de la réunion annuelle du NCCN, réalisation virtuelle 18-20.03.2021.
Congrès : Réunion annuelle du NCCN
Littérature :
- Information sur les médicaments de swissmedic. www.swissmedicinfo.ch (dernier accès le 28.03.2021)
- de Wit M, et al : Carcinome de la vessie (carcinome urothélial) – Onkopedia. Mise à jour mars 2019. www.onkopedia.com/de/onkopedia/guidelines/blasenkarzinom-urothelkarzinom (dernier accès le 28.03.2021)
- Siefker-Radtke AO, et al : Phase III trial of fluorouracil, interferon alpha-2b, and cisplatin versus methotrexate, vinblastine, doxorubicin, and cisplatin in metastatic or unresectable urothelial cancer. J Clin Oncol. 2002 ; 20(5) : 1361-1367.
- Bellmunt J, et al : Pembrolizumab as Second-Line Therapy for Advanced Urothelial Carcinoma. N Engl J Med. 2017 ; 376(11) : 1015-1026.
- Galsky MD, et al : Étude randomisée en double aveugle de phase II sur le maintien du pembrolizumab versus placebo après une chimiothérapie de première ligne chez des patients atteints de cancer urothélial métastatique. J Clin Oncol. 2020 ; 38(16) : 1797-1806.
- Shin J, et al : Effet de la chimiothérapie à base de platine sur l’expression de PD-L1 sur les cellules tumorales dans le cancer du poumon non à petites cellules. Cancer Res Treat. 2019 ; 51(3) : 1086-1097.
- Jiang Q, et al : CD19. Cancer Immunol Immunother. 2019 ; 68(1) : 45-56.
- Balar AV, et al : Atezolizumab as first-line treatment in cisplatin-ineligible patients with locally advanced and metastatic urothelial carcinoma : a single-arm, multicentre, phase 2 trial. Lancet . 2017 ; 389(10064) : 67-76.
- Balar AV, et al : Première ligne de pembrolizumab chez les patients acceptant le cisplatine et atteints d’un cancer urothélial localement avancé et non résécable ou métastatique (KEYNOTE-052) : étude multicentrique, à un seul bras, de phase 2. Lancet Oncol. 2017 ; 18(11) : 1483-1492.
- Galsky MD, et al. : Essai de phase 2 de gemcitabine, cisplatine, plus ipilimumab chez des patients atteints de cancer urothélial métastatique et impact des mutations du gène de réponse aux dommages de l’ADN sur les résultats. Eur Urol. 2018 ; 73(5) : 751-759.
InFo ONKOLOGIE & HÄMATOLOGIE 2021 ; 9(2) : 28-29 (publié le 11.4.21, ahead of print)











