Les enfants et les adolescents atteints de psoriasis et/ou d’arthrite psoriasique sont souvent en grande souffrance. La qualité de vie des personnes concernées et de leurs familles est souvent nettement réduite, en particulier lorsque les symptômes sont graves. Pour cette population de patients, des thérapies systémiques efficaces et bien tolérées sont une composante importante de la gestion individuelle de la maladie.
Le sécukinumab se lie à la cytokine interleukine-17A (IL-17A) et inhibe l’interaction avec son récepteur. Ainsi, la substance active déploie des effets anti-inflammatoires et immunomodulateurs. Cosentyx® (sécukinumab) est autorisé en Suisse depuis 2015 pour les adultes dans le traitement systémique du psoriasis en plaques et a depuis obtenu une autorisation de mise sur le marché pour le traitement de l’arthrite psoriasique. Récemment, il a été démontré que l’anticorps anti-IL17A est également une option de traitement efficace et sûre pour les patients pédiatriques atteints de psoriasis. Dans cette population de patients, il y a un besoin d’élargir l’éventail des traitements. “Vivre avec le psoriasis est un défi et peut être très stressant pour les enfants et les adolescents”, a déclaré Randy Beranek, président et PDG de la National Psoriasis Foundation [1]. “L’élargissement des options thérapeutiques pour cette population de patients est un pas dans la bonne direction pour réduire la charge de morbidité du psoriasis en plaques” [1].
EMA- et Swissmedic : autorisation de Cosentyx® pour le psoriasis en plaques juvénile
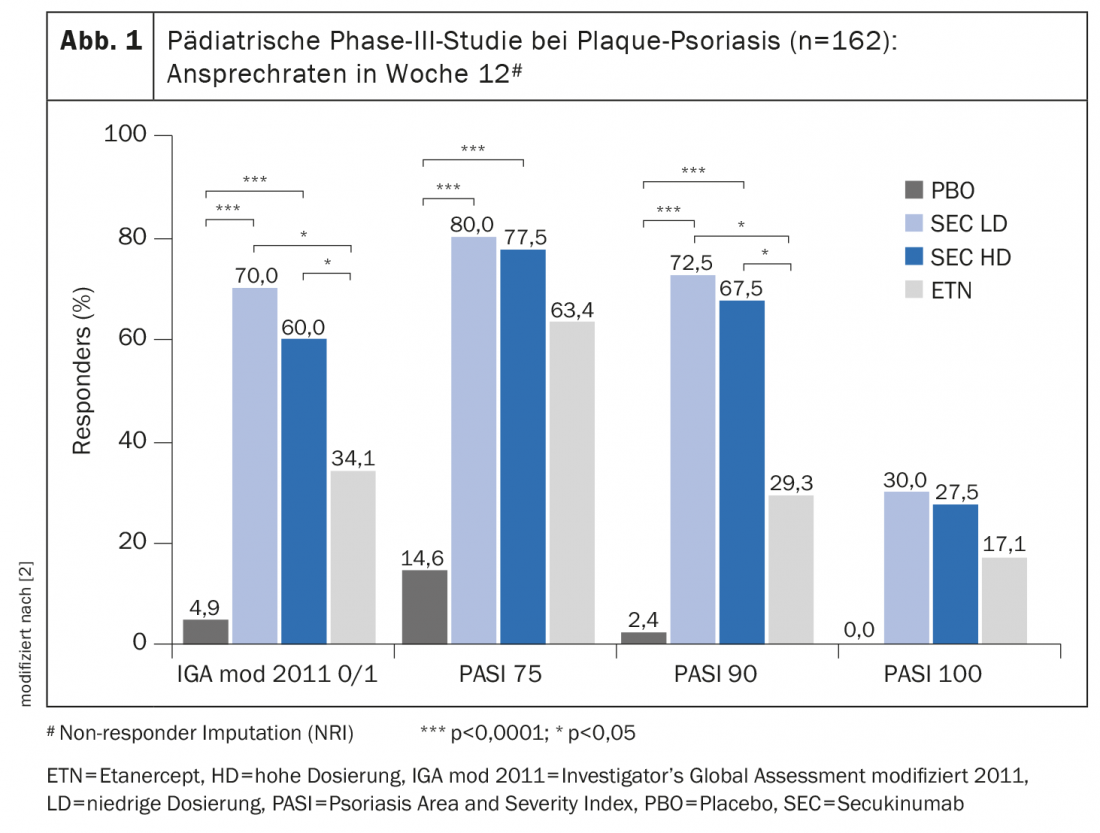
Dans le traitement des enfants et des adolescents, il est particulièrement important de trouver le meilleur équilibre possible entre les bénéfices et les risques d’une thérapie systémique. Le sécukinumab a notamment été étudié dans le cadre d’un essai clinique randomisé en double aveugle (NCT02471144) chez 162 enfants et adolescents âgés de 6 à <18 ans atteints de psoriasis en plaques sévère [2]. Le sécukinumab a obtenu une efficacité significativement supérieure à celle du placebo et de l’étanercept (encadré). L’innocuité du sécukinumab a été évaluée dans cette étude et dans une autre étude de phase III. La seconde étude est une étude ouverte portant sur 84 patients (âgés également de 6 à <18 ans) atteints de psoriasis en plaques modéré à sévère [1]. Le profil de sécurité rapporté dans ces deux études sur un total de 2874 patients-années correspondait aux signaux de sécurité du sécukinumab rapportés chez les patients adultes atteints de psoriasis en plaques [3]. “Dans l’étude pédiatrique centrale, la majorité des patients traités par Cosentyx® ont obtenu une peau sans lésion ou presque sans lésion, avec un profil de sécurité équivalent à celui des études cliniques précédentes chez l’adulte. En raison de la nature systémique de cette maladie, Cosentyx® est une option de traitement complémentaire bienvenue pour les familles confrontées à cette maladie difficile”, a déclaré le Dr John Browning, professeur adjoint de pédiatrie et de dermatologie, University of Texas Health Science Center, San Antonio (États-Unis) [1].

En Suisse, l’extension d’indication pour le traitement du psoriasis en plaques chez les enfants et les adolescents de plus de 6 ans a eu lieu en janvier 2021. Cette décision fait suite à l’approbation par la Commission européenne, quelques mois auparavant, du sécukinumab en traitement de première intention du psoriasis en plaques modéré à sévère chez les enfants et les adolescents. La dose recommandée dépend du poids corporel (tab. 1) et est administrée en injection sous-cutanée avec des doses de départ aux semaines 0, 1, 2, 3 et 4, suivies de doses d’entretien mensuelles [3]. Chaque dose de 75 mg est administrée sous la forme d’une injection sous-cutanée de 75 mg et la dose de 150 mg est administrée sous la forme d’une injection sous-cutanée de 150 mg chacune.
La FDA donne son feu vert pour une utilisation dans l’arthrite psoriasique juvénile (JPsA)
L’IL-17A n’est pas seulement pertinente dans la pathogenèse du psoriasis en plaques, mais joue également un rôle pathogène clé dans l’arthrite psoriasique (PsA). En Suisse, Cosentyx® (sécukinumab) n’est pour l’instant autorisé que pour les adultes atteints de PsA éligibles pour un traitement systémique [3]. L’année dernière, une demande d’autorisation de mise sur le marché a été déposée auprès de l’Agence européenne des médicaments (EMA) pour une extension de l’indication, étant donné que des succès thérapeutiques remarquables ont également été obtenus dans la population de patients pédiatriques atteints de PsA lors d’études cliniques de phase III. Aux États-Unis, Cosentyx® a déjà été approuvé par la FDA fin 2021 pour le traitement des enfants et des adolescents atteints d’arthrite liée à l’enthésite (ERA) et d’arthrite psoriasique (PsA) [4]. L’étude clinique pivot JUNIPERA a démontré une réduction du risque de poussées aiguës et une amélioration de l’activité de la maladie, tant en ce qui concerne l’ERA que la PsA, chez des patients pédiatriques sur une période d’observation de deux ans par rapport à un placebo. Le profil de sécurité était cohérent avec les signaux de sécurité du sécukinumab rapportés dans les études précédentes [4,5]. Cosentyx® a été approuvé par la FDA pour les enfants et les adolescents atteints d’ERA ou de PsA à une posologie ajustée au poids de 75 mg (15-50 kg de poids corporel) ou 150 mg (>50 kg de poids corporel), en injection sous-cutanée toutes les 4 semaines, après une dose de charge initiale. “Les résultats de l’étude de phase III JUNIPERA montrent que les patients pédiatriques traités par sécukinumab ont montré une réponse significative tout au long de la période d’étude. Cette approbation est une nouvelle encourageante pour les patients qui doivent faire face à des symptômes douloureux tels que l’inflammation des articulations et le gonflement des doigts et des orteils”, a déclaré le Dr Hermine Brunner, Cincinnati Children’s Hospital (États-Unis) [4]. “Les symptômes de la PsA et de l’ERA peuvent être pénibles pour les enfants et les adolescents atteints de ces maladies chroniques et affecter leur vie quotidienne”, a déclaré Tiffany Westrich-Robertson, PDG, International Foundation for Autoimmune & Autoinflammatory Arthritis (AiArthritis). “Il est encourageant de constater qu’il existe désormais une option de traitement complémentaire pour cette population de patients mal desservis”.
Littérature :
- “Novartis Cosentyx receives FDA approval for treatment of children and adolescents with moderate to severe plaque psoriasis”, Novartis, 01.06.2021
- Bodemer C, et al : Le sécukinumab démontre une efficacité élevée et un profil de sécurité favorable chez les patients pédiatriques atteints de psoriasis chronique sévère en plaques : 52-week Results from a Phase 3 Double-Blind Randomized, Controlled Trial. J Eur Acad Dermatol Venereol 2021 ; 35 : 938-947. doi : 10.1111/jdv.1700
- Compendium suisse des médicaments, https://compendium.ch, (dernière consultation 07.04.2022)
- “Novartis Cosentyx® reçoit l’approbation de la FDA pour le traitement des enfants et adolescents atteints d’arthrite liée à l’enthésite et d’arthrite psoriasique”, Novartis, 23.12.2021
- Menter A, et al : Joint American Academy of Dermatology-National Psoriasis Foundation guidelines of care for the management and treatment of psoriasis in pediatric patients. J Am Acad Dermatol 2020 ; 82(1) : 161-201.
DERMATOLOGIE PRATIQUE 2022 ; 32(2) : 36-37