L’étalon-or pour l’évaluation de l’AVC aigu est le scanner natif pour exclure une hémorragie, après quoi un traitement par thrombolyse iv peut être administré dans la fenêtre de temps de 4,5 heures actuellement autorisée et après avoir exclu les contre-indications possibles. Le plus grand défi dans la gestion interdisciplinaire des accidents vasculaires cérébraux est d’optimiser le temps de sélection des patients pour les thérapies disponibles (thérapie par thrombolyse iv, recanalisation ia, lyse ia, aucune thérapie). Des protocoles d’imagerie modernes et prometteurs aident à la prise de décision dans les situations aiguës et permettent d’évaluer en quelques minutes la pénombre et l’état des collatéraux vasculaires individuels. Celui-ci peut justifier des traitements endovasculaires même en dehors de la fenêtre de 4,5 heures en cas de bonne situation collatérale ou dans le territoire du courant vertébrobasilaire.
L’accident vasculaire cérébral (AVC) aigu représente la situation d’urgence neurologique la plus fréquente. La cause la plus fréquente est l’occlusion aiguë d’artères alimentant le cerveau. Pour que le traitement soit efficace, il est essentiel que la circulation cérébrale soit rétablie le plus rapidement possible. L’étendue des lésions tissulaires dépend essentiellement du temps d’ischémie et des collatéraux disponibles. L’ensemble de la chaîne de traitement doit donc être optimisé en termes de temps : depuis la survenue de l’AVC, le transport vers l’hôpital, le diagnostic, le traitement aigu, jusqu’à l’unité d’AVC. Les soins postopératoires et la rééducation sont tout aussi importants, mais le temps est moins critique.
Le rôle de la neuroradiologie réside dans le diagnostic primaire par imagerie et dans la revascularisation neurointerventionnelle. Tout commence par la distinction entre l’infarctus cérébral ischémique (environ 80%) et l’hémorragie cérébrale (diagnostic différentiel le plus fréquent), qui n’est pas possible sur le plan neurologique clinique. Seuls les patients ayant subi un AVC ischémique se qualifient pour toute forme de traitement de revascularisation. L’étalon-or pour l’évaluation de l’AVC aigu est la tomodensitométrie native (TDM native) en raison de sa large disponibilité et de sa grande sensibilité pour exclure une hémorragie cérébrale. Cela suffit pour initier à temps un traitement par thrombolyse iv, s’il existe des déficits fonctionnels pertinents et aucune contre-indication (par ex. traumatisme crânien, opération récente, coagulation sanguine déréglée). En 2010, suite à de nouvelles connaissances scientifiques basées sur des résultats correspondants, la fenêtre temporelle entre le début des symptômes et le début du traitement par thrombolyse a été prolongée de 3 à 4,5 heures (ECASS III) [1].
La TDM native est connue pour avoir une faible sensibilité pour détecter l’infarctus cérébral dans les premières heures après le début de l’infarctus et varie en fonction du délai et de l’expérience radiologique. Les protocoles d’examen modernes (CT-perfusion) augmentent significativement la sensibilité [2], fournissent des informations supplémentaires utiles sur l’AVC individuel et l’état des collatéraux vasculaires et aident à prendre des décisions thérapeutiques individuelles. Outre la thérapie par thrombolyse iv basée sur des preuves dans une fenêtre de 4,5 heures, il existe également des approches thérapeutiques endovasculaires en neuroradiologie interventionnelle, par exemple pour les occlusions vasculaires proximales. Ces procédures de recanalisation mécanique ont permis d’obtenir de meilleurs taux de recanalisation des artères cérébrales proximales occluses par rapport à la thrombolyse iv [3], mais n’ont pas permis d’améliorer significativement le résultat fonctionnel des patients traités (IMS III) dans les études récentes de plus grande envergure qui ont fait l’objet de nombreuses discussions [4]. Il faut attendre d’autres études avec un design optimisé, une meilleure sélection des patients et un équipement de revascularisation uniforme. La revascularisation ia est actuellement utilisée jusqu’à 6-8 heures après le début des symptômes, sans limite de temps pour les occlusions vertébro-basilaires. Le véritable défi dans l’évaluation neuroradiologique et le traitement interdisciplinaire de l’AVC aigu est de décider du traitement individuel le meilleur/le plus efficace. La question centrale dans le centre interdisciplinaire de l’AVC est la suivante : quel patient bénéficie le mieux et à quel moment d’une thrombolyse iv, d’une recanalisation ia, d’une thrombolyse ia ou d’aucune thérapie ? Outre l’âge, la taille de l’infarctus, la gravité des déficits neurologiques, l’emplacement et la taille de l’occlusion vasculaire ainsi que la fenêtre temporelle, d’autres facteurs (comorbidités, médication, anatomie vasculaire individuelle et contre-indications éventuelles) jouent un rôle important dans la décision de recourir ou non à une forme de traitement spécifique. Les nouvelles techniques de tomodensitométrie (CT-Perfusion) sont utiles pour la prise de décision. Associées à la tomodensitométrie native et à l’angiographie par tomodensitométrie (CTA), elles permettent d’exclure une hémorragie cérébrale en quelques minutes dans un contexte de soins aigus et fournissent des informations utiles sur l’état des collatéraux vasculaires et la taille approximative du parenchyme cérébral irrémédiablement endommagé et de celui qui peut encore être sauvé (concept de pénombre).
Par rapport à l’IRM, un protocole CT-Stroke présente des avantages évidents en termes de temps et de logistique (acquisition plus rapide des données, disponibilité plus large, effort réduit, meilleure surveillance des patients), en accord avec la devise “time is brain”. De nombreux centres d’AVC appliquent déjà cliniquement de tels protocoles de tomodensitométrie pour les AVC. Des études comparatives directes entre la perfusion par scanner et par IRM ont donné des résultats comparables [5], mais jusqu’à présent, il n’existe pas de comparaisons multicentriques valables en raison d’une standardisation insuffisante des algorithmes d’évaluation/du “postprocessing” [6].
Nous allons maintenant présenter les possibilités de diagnostic neuroradiologique dans l’AVC aigu, en les illustrant par des cas cliniques. Nous prenons également position sur les sources d’erreur possibles et le diagnostic différentiel.
T natif
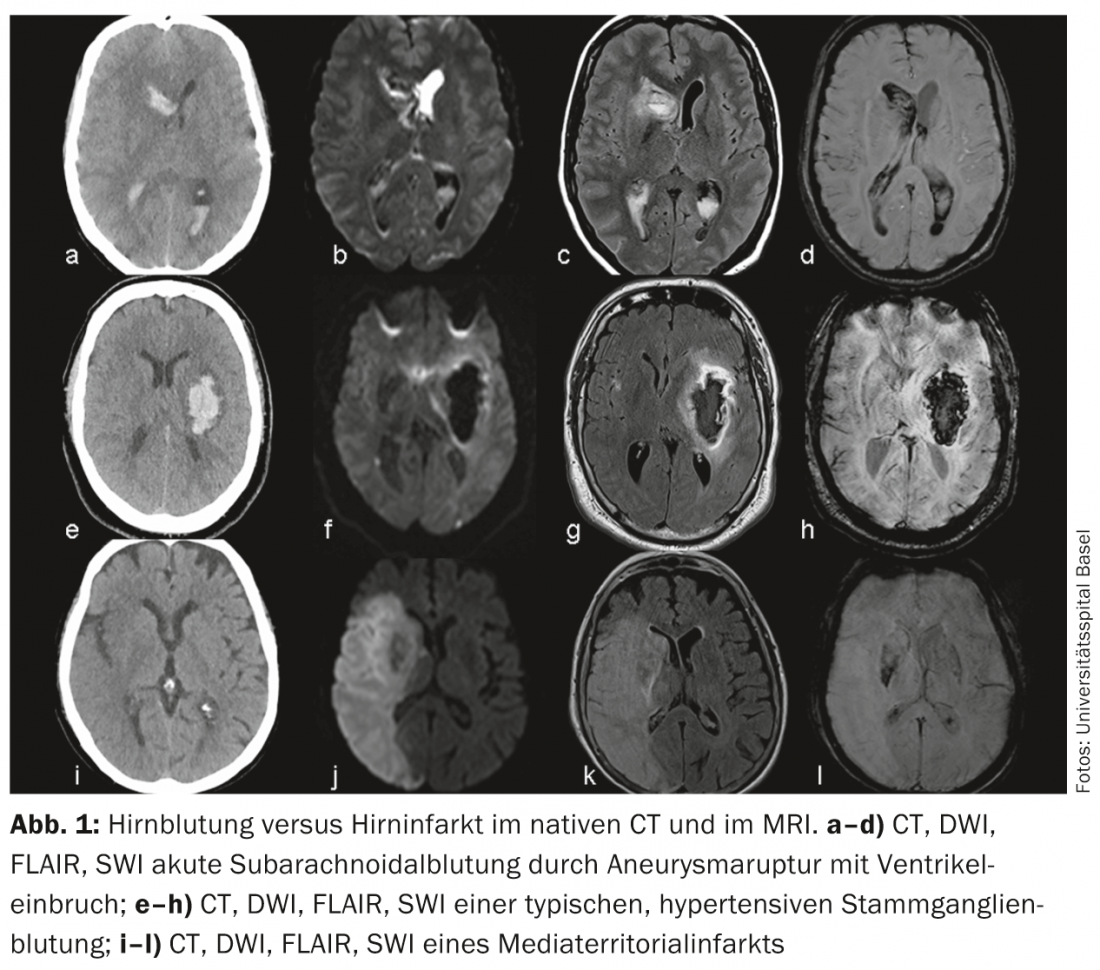
Infarctus cérébral versus hémorragie cérébrale : le diagnostic différentiel le plus courant de l’AVC ischémique est l’hémorragie intracrânienne. Il est possible de différencier les hémorragies sous-arachnoïdiennes (anévrismales) des hémorragies intraparenchymateuses (hypertensives et non hypertensives). La détection ou l’exclusion de l’hémorragie cérébrale est rapide et fiable avec le scanner natif, mais peut tout aussi bien être réalisée avec des séquences modernes (SWI, DWI, FLAIR) et un peu plus d’efforts en IRM (Fig. 1).
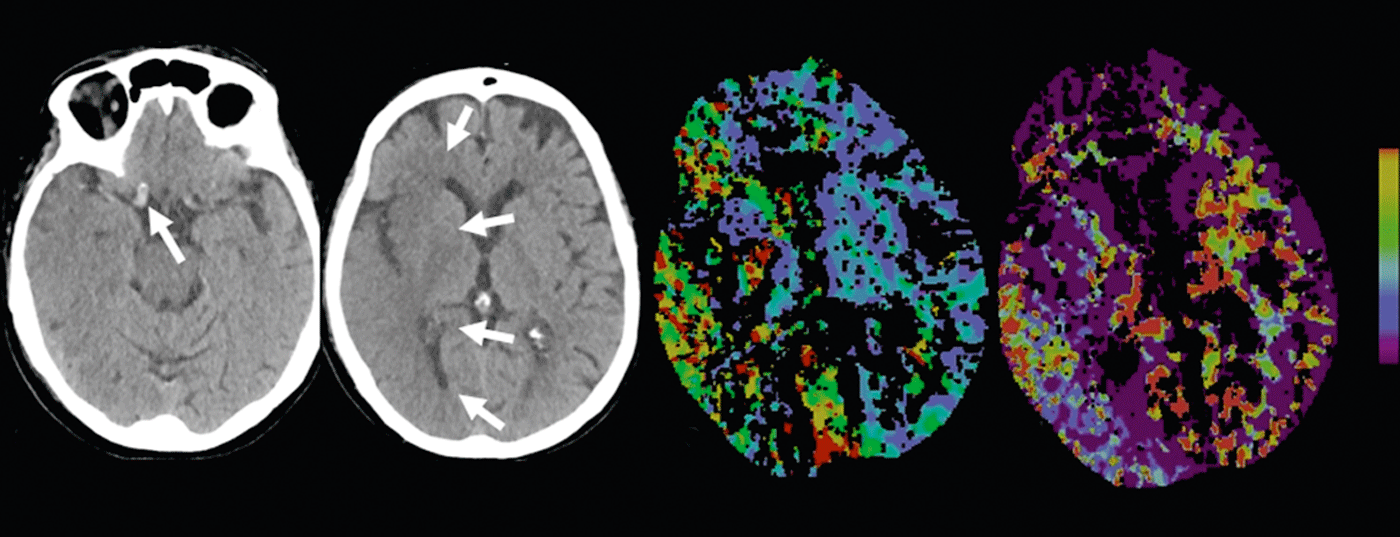
Infarctus cérébral : le scanner natif peut montrer ce que l’on appelle des signes précoces d’infarctus. Par exemple, une diminution de la densité de la substance grise avec une dédifférenciation corticomédullaire due à l’œdème de l’infarctus – ou le signe de l’artère hyperdense, dû à une augmentation de la densité en cas de thrombus intraluminal (fig. 2 et 3).
Selon la littérature, la sensibilité dans la détection des signes précoces d’infarctus varie entre 12 et 92% et dépend principalement de la durée de l’ischémie. Les zones d’infarctus délimitées au scanner natif sont hautement spécifiques d’une atteinte parenchymateuse irréversible et ont une importance pronostique [7]. Par exemple, si plus d’un tiers du territoire médian présente une marque d’infarctus, le risque d’hémorragie augmente pour le patient sous traitement par thrombolyse iv.
IRM
La meilleure méthode pour visualiser les lésions parenchymateuses ischémiques est l’IRM, qui peut montrer l’infarctus en quelques minutes, en raison de l’œdème cytotoxique. Celui-ci entraîne une diminution du mouvement moléculaire brownien et donc une perturbation détectable de la diffusion dans DWI, qui correspond au noyau d’infarctus irréversiblement endommagé. Les études de perfusion par IRM peuvent mettre en évidence des déficits de perfusion qui, en l’absence de reperfusion, s’infiltrent également (“tissue at risk”). Ce mismatch diffusion-perfusion (concept de penumbra) a fait l’objet d’études approfondies au cours de la dernière décennie et a été considéré comme un concept attrayant pour la sélection des patients pour les thérapies de reperfusion [5]. L’angiographie par résonance magnétique permet également de visualiser l’état vasculaire intra- et extracrânien du patient et de mettre en évidence des occlusions vasculaires.
En routine clinique, peu de cliniques peuvent disposer d’une IRM pour le diagnostic aigu d’AVC, de plus le temps d’examen est plus long, la logistique plus complexe et ne peut finalement être établie comme diagnostic aigu standard que si l’infrastructure est très bonne.
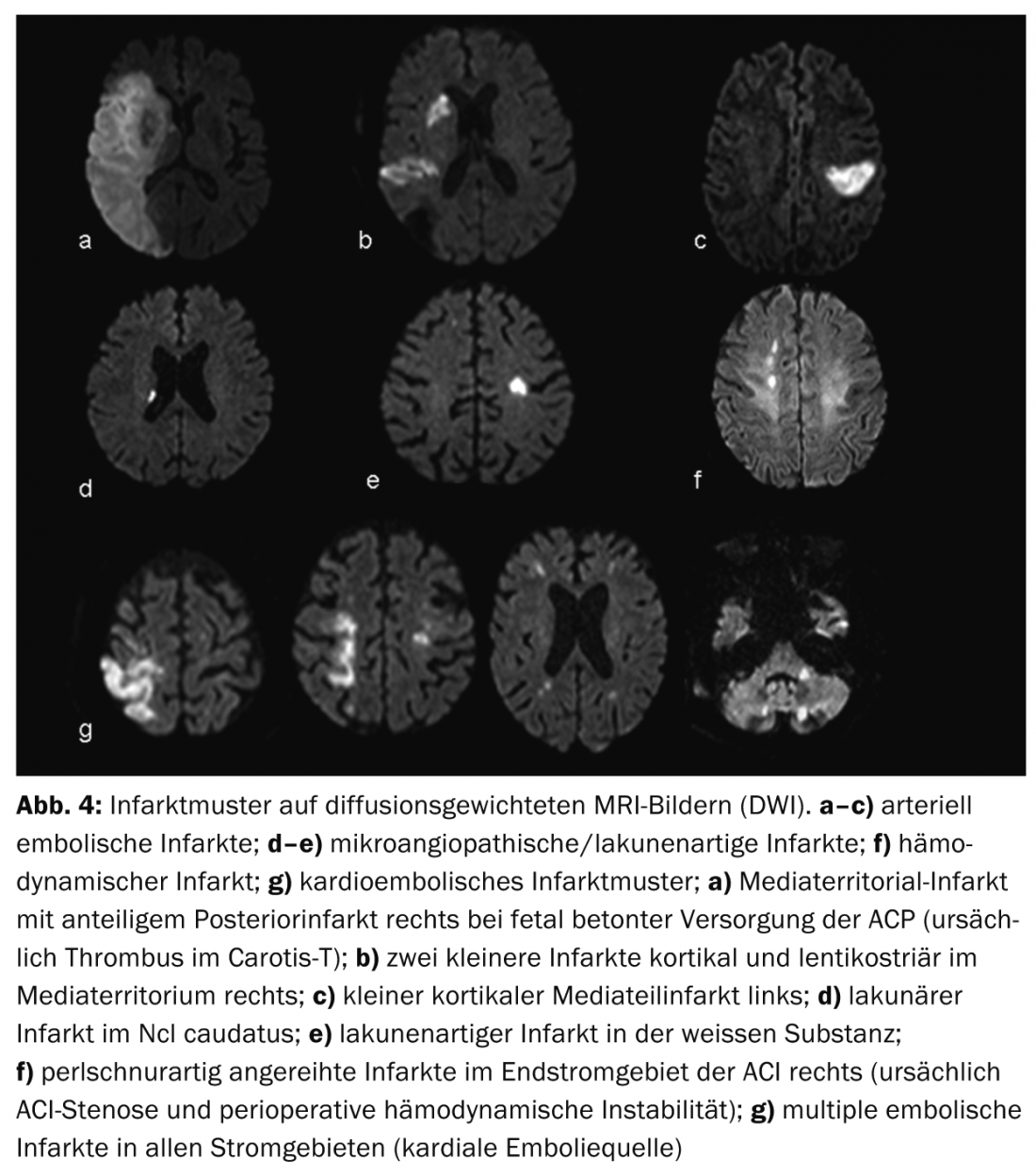
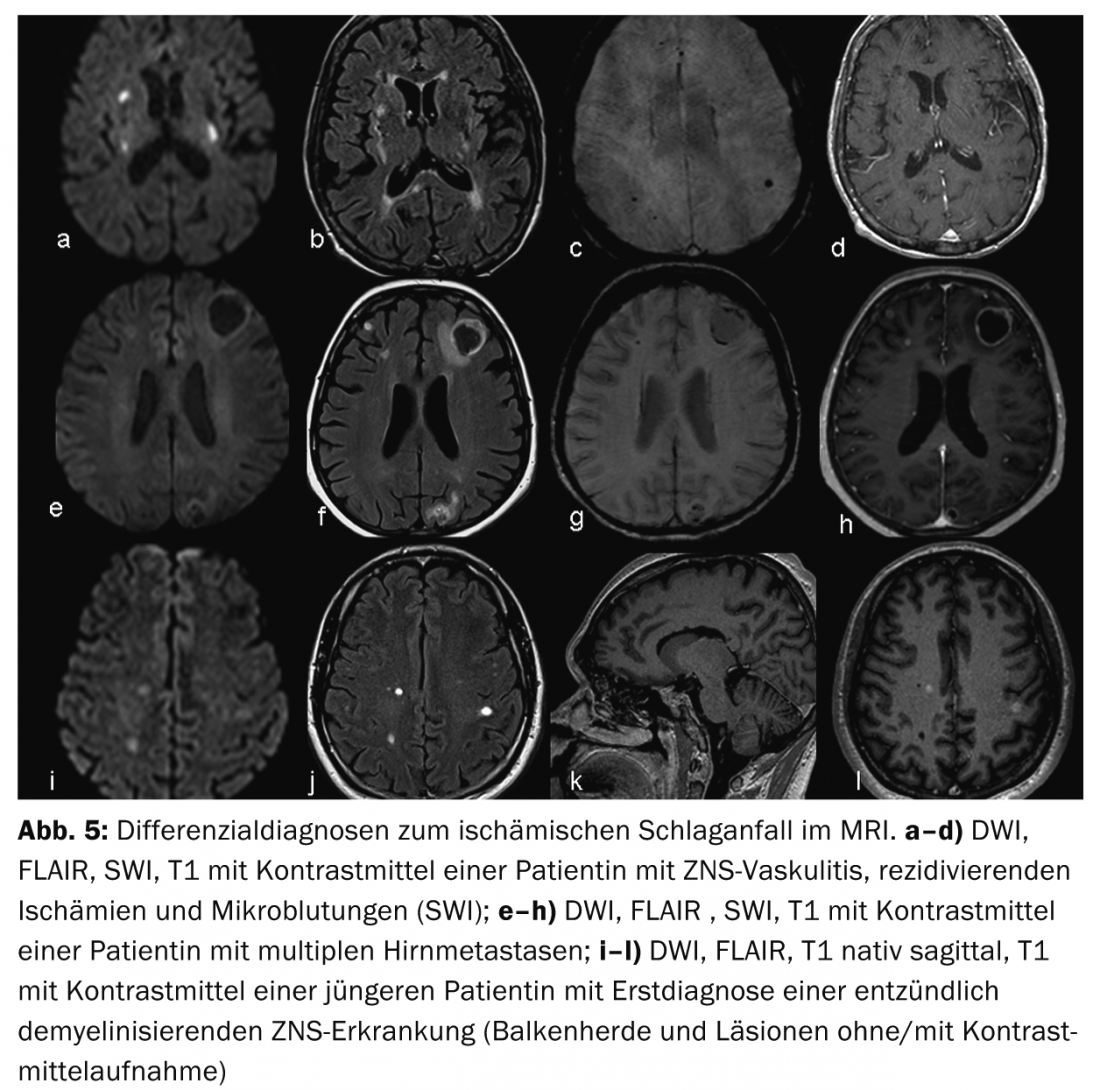
Les avantages de l’IRM sont une meilleure représentation des modèles d’infarctus et donc une meilleure évaluation de l’étiologie de l’infarctus. (ill.4) ainsi qu’une meilleure délimitation des diagnostics différentiels, appelés “stroke mimics”, par ex. vasculite, tumeur ou maladies inflammatoires démyélinisantes du SNC (Fig.5). Le concept de pénombre est particulièrement utile pour prendre des décisions thérapeutiques en cas d’AVC survenant dans un laps de temps incertain (appelé “wake up stroke”).
Protocole CT-Stroke moderne
Grâce aux techniques modernes de tomodensitométrie, la sensibilité de la détection d’un infarctus cérébral ischémique peut être considérablement augmentée en ajoutant une perfusion et une angiographie par tomodensitométrie amplifiées par KM.
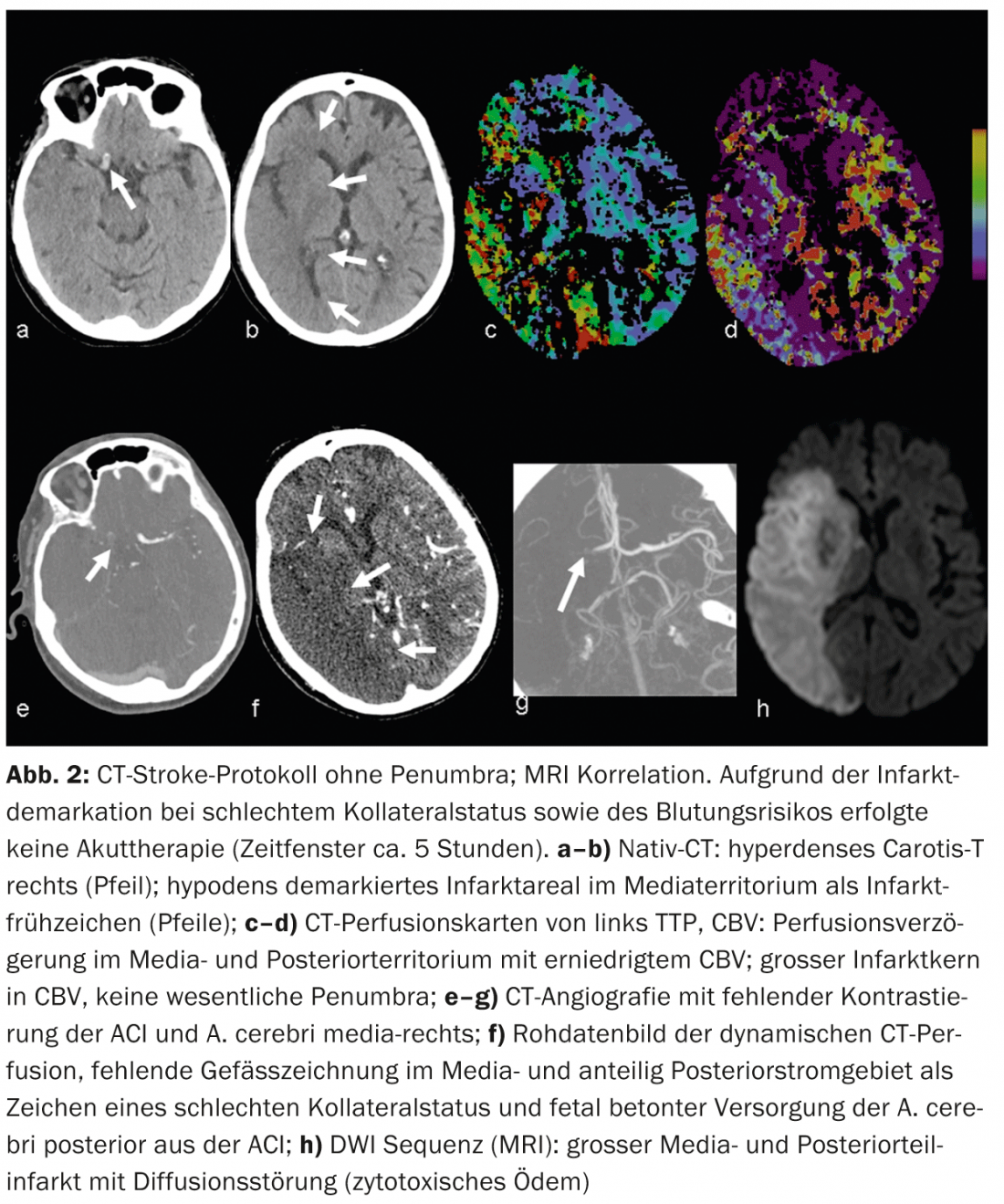
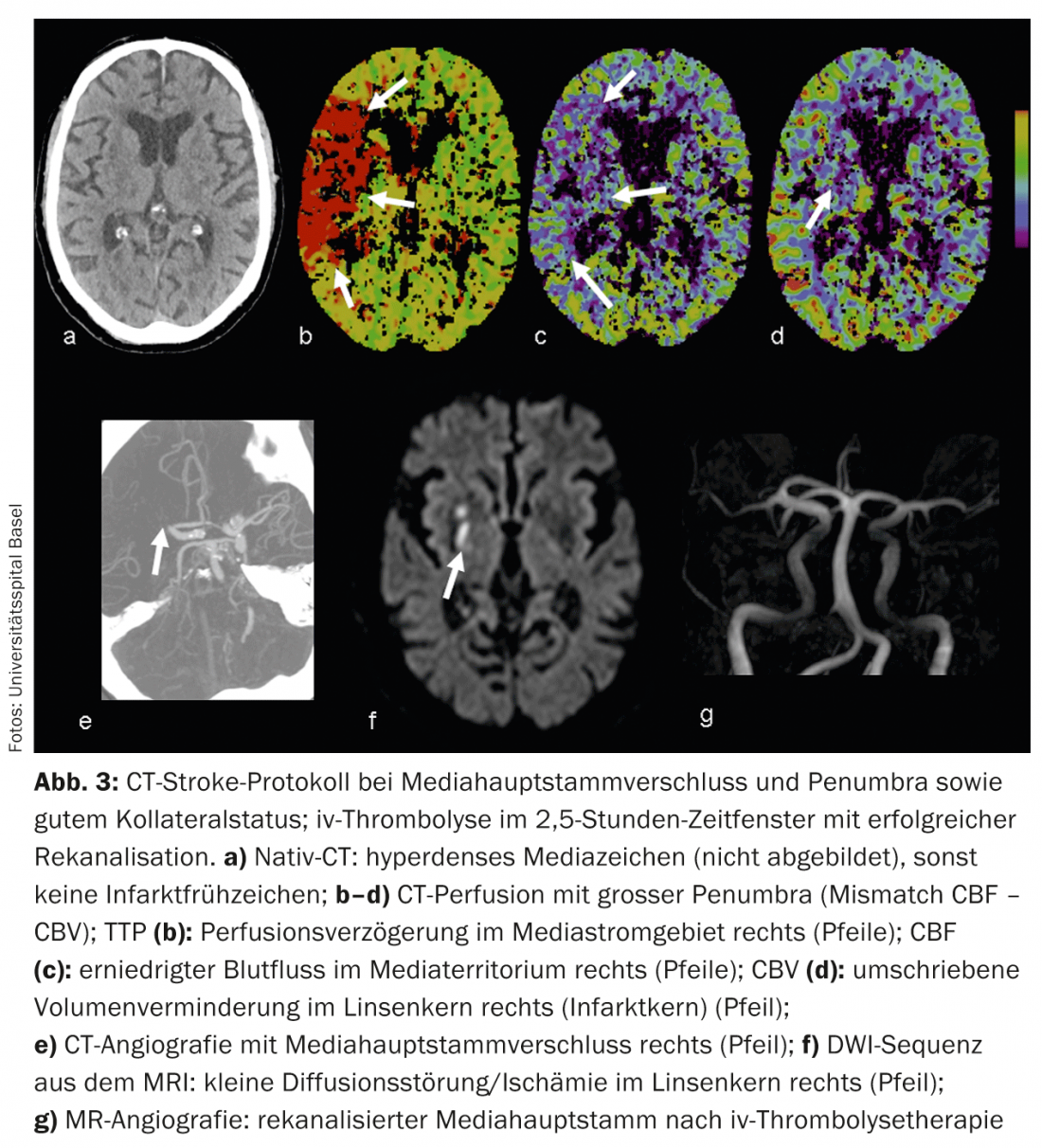
CTA : le CTA à contraste amélioré représente de manière fiable l’anatomie, la pathologie et la collatéralité des vaisseaux. Le statut de collatéral vasculaire fait l’objet d’un intérêt clinique et scientifique croissant. Individuellement, l’état des collatéraux peut avoir une influence considérable sur le déroulement temporel de la cascade ischémique. La collatéralisation intacte a une importance pronostique [8], on parle aussi de “collateralization is brain” en plus de la devise “time is brain”. L’apport collatéral au parenchyme cérébral se fait par le biais du cercle artériel de Willisi, anatomiquement variable selon les individus, en tant que réseau primaire, et également par des anastomoses leptoméningées entre les différents territoires vasculaires en tant que réseau secondaire. L’étendue et le nombre d’anastomoses, ainsi que leur capacité compensatoire, varient d’un individu à l’autre [9]. Le statut collatéral d’un patient peut justifier un traitement de recanalisation mécanique même en dehors de la fenêtre de 4,5 heures. En connaissant le statut collatéral individuel, les patients peuvent être mieux sélectionnés pour différentes formes de traitement (fig. 2 et 3).
CTP : la perfusion CT est un CT-scan dynamique après administration d’un bolus de produit de contraste iv pendant environ 45 secondes. Des algorithmes de déconvolution complexes transfèrent les données dans des cartes de paramètres fonctionnels. CBV désigne le volume sanguin cérébral (physiologiquement 4-5 ml/100 g de masse cérébrale), CBF le débit sanguin cérébral, MTT le “mean transit time” en tant qu’intervalle de temps entre l’afflux artériel et l’écoulement veineux et TTP le “time to peak” en tant qu’intervalle de temps entre l’injection du bolus et le pic maximal de produit de contraste. L’analyse des données brutes est semi-automatisée et rapide. Selon le concept de mismatch, l’évaluation des cartes fonctionnelles permet de déterminer l’importance du trouble de la perfusion (“tissue at risk”) et du noyau d’infarctus irréversiblement endommagé. Ainsi, il est également possible d’estimer une pénombre en quelques minutes au scanner.
En cas d’ischémie aiguë, le débit sanguin cérébral diminue. En raison de l’élargissement réactif du lit capillaire – avec une autorégulation initialement intacte – le volume sanguin reste initialement stable. En cas de décompensation de l’autorégulation, notamment en cas de mauvais état collatéral, le CBV diminue [10]. Les zones de diminution du CBV correspondent au parenchyme cérébral irréversiblement infarci et sont en bonne corrélation avec les zones de diffusion perturbée à l’IRM. (Fig.2 et 3). Les zones avec un CBV normal mais un MTT ou un CBF perturbé correspondent au “tissue at risk”, c’est-à-dire au tissu potentiellement récupérable. (Fig.3). La sensibilité pour la détection de l’infarctus est significativement plus élevée pour le CT-perfusion (68-83%) par rapport au CT-natif seul (19-45%) ou au CT-natif plus CTA (jusqu’à 58%), toujours en fonction de la taille de l’infarctus [2]. Les résultats faussement négatifs de la TDM de perfusion se rencontrent dans les infarctus de petite taille/lacunaires ou dans les infarctus situés en dehors de la section du cerveau examinée, bien que les scanners multislice modernes puissent désormais couvrir presque tout le cerveau en un seul examen.
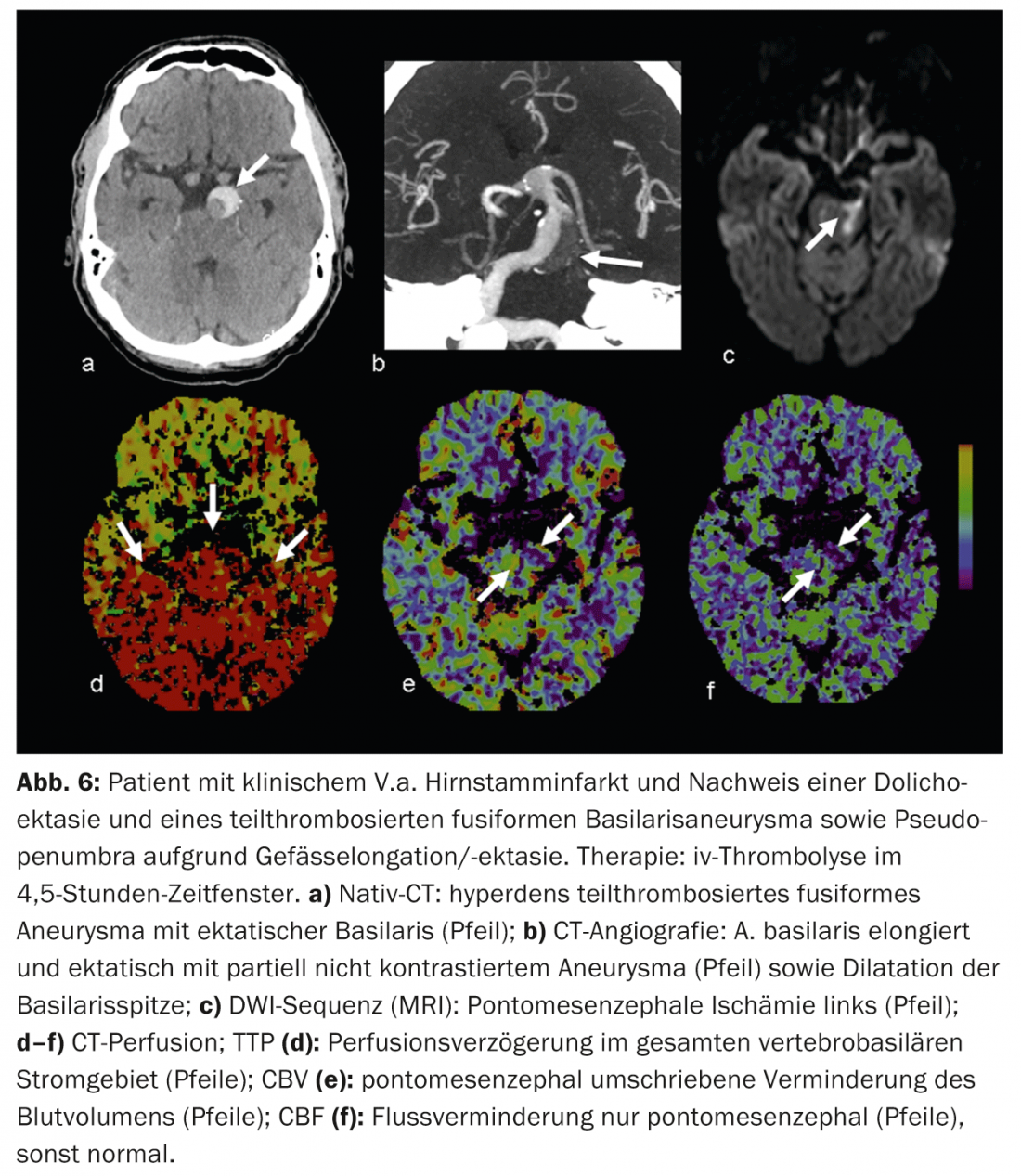
Les faux positifs sont dus, par exemple, à des maladies cardiovasculaires concomitantes qui peuvent entraîner un retard de perfusion chronique et ne doivent pas être confondues avec une “pseudo-pénumbra”, par exemple une fonction de débit cardiaque réduite en cas d’insuffisance cardiaque, des sténoses vasculaires de haut grade en amont (généralement des sténoses de l’ACI), des occlusions ou encore des dolichoectasies (par exemple la circulation postérieure) (Fig. 6).
Dr. méd. Johanna M. Lieb
Littérature :
- Hacke W, et al : Thrombolysis with alteplase 3 to 4.5 hours after acute ischemic stroke. N Engl J Med 2008 ; 359 : 1317-1329.
- Campbell BCV, et al : CT Perfusion improves diagnosis accuracy and confidence in acute ischemic stroke. J Neurol Neurosurg Psychiatry 2013 ; 84 : 613-618.
- Mokin M, et al : Traitement endovasculaire des accidents vasculaires cérébraux ischémiques aigus : la fin ou juste le début ? Neurosurg Focus 2014 Jan ; 36(1) : 1-10.
- Broderick JP, et al. : Interventional Management of Stroke (IMS) III Investigators. Traitement endovasculaire après t-PA intraveineux versus t-PA seul pour l’AVC. N Engl J Med 2013 Mar 7 ; 368(10) : 893-903
- Campbell BC, et al : Comparaison de la perfusion par tomographie computérisée et de la perfusion-diffusion par imagerie par résonance magnétique dans les accidents vasculaires cérébraux ischémiques. Accident vasculaire cérébral 2012 Oct ; 43(10) : 2648-2653.
- Dani KA, et al : Systematic review of perfusion imaging with computed tomography and magnetic resonance in acute ischemic stroke : heterogeneity of acquisition and postprocessing parameters : a translational medicine research collaboration multicentre acute stroke imaging study. Stroke 2012 Feb ; 43(2) : 563-566.
- Nabavi DG, et al : MOSAIC : Multimodal Stroke Assessment Using Computed Tomography : novel diagnostic approach for the prediction of infarction size and clinical outcome. Accident vasculaire cérébral 2002 ; 33 : 2819-2826.
- Nambiar V, et al : CTA-Collateral Status and Response to Recanalization in Patients with Acute Ischemic Stroke. AJNR Am J Neuroradiol 2013 Dec 26. [Epub ahead of print]
- Liebeskind DS : circulation collatérale. Accident vasculaire cérébral 2003 ; 34 : 2279-2284.
- Ahlhelm F, et al : Diagnostic neuroradiologique focalisé en cas d’accident vasculaire cérébral aigu. Therapeutische Umschau 2012 ; 69(9) : 6.1-6.6.
InFo Neurologie & Psychiatrie 2014 ; 12(2) : 8-13