Le fait que les inhibiteurs de l’IL17 se distinguent par un début d’action rapide a été démontré empiriquement à plusieurs reprises et se reflète également dans une récente étude tête-bêche. Des développements passionnants se profilent à l’avenir : le pipeline contient notamment un nouvel anticorps, le bimekizumab, qui cible les sous-unités IL-17A et IL-17F et qui a obtenu des résultats prometteurs dans des études récentes.
Les premiers médicaments biologiques autorisés pour le traitement du psoriasis ont été les inhibiteurs du TNF-alpha adalimumab, étanercept et infliximab. Bien que cela représentait déjà une amélioration considérable des possibilités de traitement, la majorité des patients ne parvenaient pas à une disparition totale des symptômes. Toutefois, d’énormes progrès ont été réalisés entre-temps à cet égard.
anti-IL17 : un début d’action rapide comme marque de fabrique
L’ustékinumab, un inhibiteur de l’IL12/23, a été suivi par deux inhibiteurs de l’IL17A, le sécukinumab et l’ixekinumab, ainsi que par le brodalumab, un antagoniste des récepteurs de l’IL17 (actuellement non autorisé en Suisse) [1]. Le blocage de l’IL17 s’est révélé très efficace et a permis d’optimiser les taux de réponse. La dernière génération de médicaments biologiques très efficaces comprend également le guselkumab, le tildrakizumab et le risankizumab, des inhibiteurs de l’IL23. Il existe quelques différences entre les classes de substances. “La thérapie anti-IL17 agit vite, très vite”, souligne le professeur Diamant Thaci, de l’Institut et du Centre d’excellence, Université de Lübeck [2]. C’est ce qui ressortait déjà de l’étude CLEAR publiée en 2015, dans laquelle le sécukinumab, un inhibiteur de l’IL17A, a montré une réponse PASI75 précoce, à savoir à la semaine 4 après la ligne de base [3]. Après 16 semaines de traitement, le sécukinumab s’est avéré supérieur à l’ustékinumab, un inhibiteur d’IL12/23, en termes de réponse PASI90 (79% vs 57,6% ; p<0,0001) et a permis une amélioration plus importante et plus durable de l’état de la peau jusqu’à la semaine 52.
Les données d’une étude tête-bêche publiées en 2020 le confirment à nouveau. L’étude IXORA est une étude randomisée en double aveugle qui a inclus des patients atteints de psoriasis en plaques modéré à sévère (PASI ≥12, sPGA ≥3 et ≥10% de surface corporelle affectée) [4]. Le critère d’évaluation principal était le PASI100 à 12 semaines, les critères d’évaluation secondaires comprenaient d’autres valeurs de PASI et de sPGA. Sur les 1027 patients inclus dans l’étude, 520 ont reçu de l’ixekizumab et 507 du guselkumab. 41% des patients sous ixekizumab ont atteint le PASI100 après 12 semaines, contre seulement 25% sous guselkumab. Dans l’ensemble, l’ixekizumab s’est révélé supérieur au guselkumab. L’effet s’est manifesté plus rapidement et un plus grand nombre de patients ont obtenu une peau sans apparence, les profils de sécurité étant comparables. Ces résultats soulignent la réponse rapide, mais ne se prononcent pas sur l’effet à long terme, qui fait l’objet d’autres études.

Place du sécukinumab dans le traitement de la PsA
Dans les recommandations actuelles de traitement de l’EULAR, les inhibiteurs du TNF-alpha et les inhibiteurs de l’IL17 sont cités comme des agents biologiques de première ligne équivalents après l’échec des DMARDS conventionnels [5]. Cette évaluation est basée sur les résultats de l’étude comparative EXCEED sur le traitement de première ligne de l’arthrite psoriasique. L’étude multicentrique de phase IIIb en double aveugle a inclus 853 patients adultes atteints d’arthrite psoriasique active. 426 patients ont reçu 300 mg de sécukinumab par voie sous-cutanée à la ligne de base, aux semaines 1, 2, 3, 4, puis toutes les 4 semaines jusqu’à la semaine 48. L’adalimumab a été administré par voie sous-cutanée à 427 patients toutes les 2 semaines. Sous sécukinumab, 67% des participants à l’étude ont atteint l’ACR20 après 52 semaines et 62% sous adalimumab [6]. Le profil de sécurité du sécukinumab et de l’adalimumab était largement conforme aux signaux de sécurité connus à ce jour. Les critères de décision pour déterminer si le sécukinumab ou l’adalimumab doit être utilisé après l’échec d’un csDMARDS sont proposés en fonction des caractéristiques individuelles des patients (par exemple, les comorbidités).
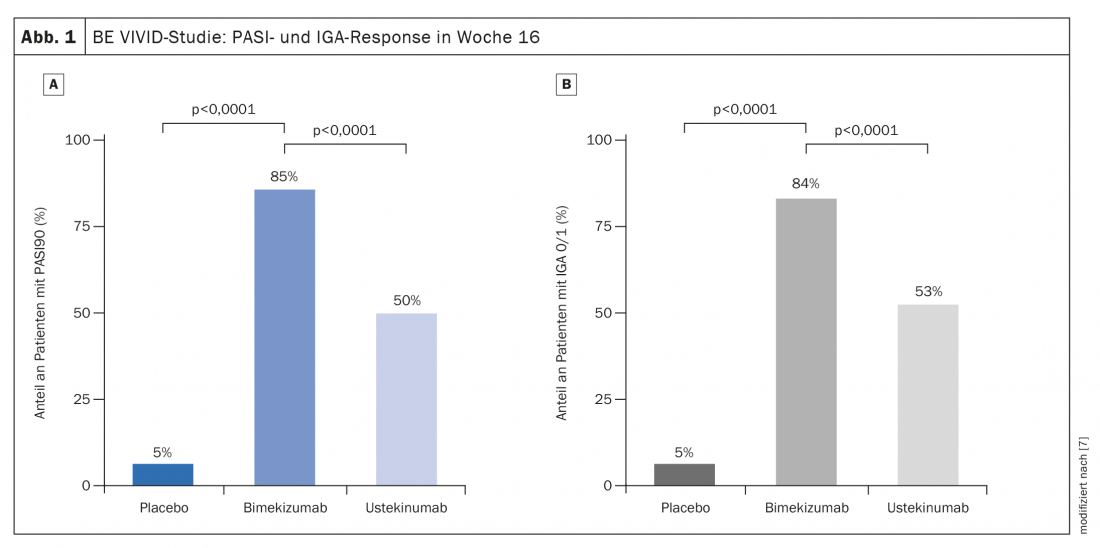
Perspectives : résultats prometteurs du blocage de l’IL-17A/F
Dans une étude comparative publiée en 2021, le bimekizumab, un inhibiteur anti-IL17A/F, a brillé par son entrée en action très rapide et ses faibles pertes d’efficacité au cours de l’étude. Le bimekizumab a obtenu le PASI75 en 4 semaines, ce que l’ustékinumab n’a obtenu qu’après 4 mois, a résumé le professeur Thaci. L’étude comparative multicentrique randomisée, en double aveugle, active et contrôlée par placebo BE VIVID a porté sur 567 adultes [7]. 321 participants à l’étude ont reçu du bimekizumab 320 mg toutes les 4 semaines et 163 sujets ont été traités avec de l’ustékinumab 45 mg ou 90 mg (adapté au poids) toutes les 12 semaines, 83 patients ont reçu un placebo toutes les 4 semaines. A la semaine 16 après la ligne de base, 85% des patients du bras bimekizumab ont atteint le PASI90, contre 50% dans le bras ustékinumab (différence de risque 35 [95%-KI 27–43]; p<0,0001) (Fig. 1A). Dans le groupe placebo, cette proportion était de 5% (différence de risque 80 [95%-KI 74–86]; p<0,0001). Environ 84% des patients sous bimekizumab ont eu un score IGA de 0 ou 1, contre 53% sous ustékinumab (différence de risque 30 [95%-KI 22–39]; p<0,0001) et 5% sous placebo (différence de risque 79 [95%-KI 73-85] p<0,0001) (Fig. 1B). Le bimekizumab a également permis d’obtenir une réponse plus rapide. À la semaine 4, après une dose unique, un score PASI75 a été observé chez 77% des patients du groupe bimekizumab, contre seulement 15% des patients du groupe ustékinumab (OR 18,2 ; IC à 95% 11-30,1, p<0,0001). Il convient également de noter que non seulement les valeurs PASI90 étaient significativement meilleures à 4 mois, mais que le bimekizumab n’a pratiquement pas entraîné de perte d’efficacité au cours de l’étude. Selon l’orateur, cela indique un potentiel prometteur pour un traitement anti-IL17 à long terme.
Congrès : Réunion DDG 2021
Littérature :
- Sawyer LM, et al : Assessing the relative efficacy of interleukin-17 and interleukin-23 targeted treatments for moderate-to-severe plaque psoriasis : A systematic review and network meta-analysis of PASI response. PLoS One 2019 ; 14(8) : 1-31.
- Thaci D : Les produits biologiques au fil du temps – Approches thérapeutiques hier, aujourd’hui et demain. Diamant Thaci, S09 : Track Inflammations : La dermatite atopique et le psoriasis en tant que maladies systémiques, congrès DDG 2021, 17.04.2021.
- Thaci D, et al : Le sécukinumab est supérieur à l’ustekinumab dans le nettoyage de la peau de sujets atteints de psoriasis en plaques modéré à sévère : CLEAR, un essai contrôlé randomisé. JAAD 2015 ; 73(3) : 400-409.
- Blauvelt A, et al. : Groupe d’étude IXORA-R. A head-to-head comparison of ixekizumab vs. guselkumab in patients with moderate-to-severe plaque psoriasis : 12-week efficacy, safety and speed of response from a randomized, double-blinded trial. Br J Dermatol 2020 ; 182(6) : 1348-1358.
- Gossec L, et al : Recommandations EULAR pour la prise en charge de l’arthrite psoriasique avec des traitements pharmacologiques : mise à jour 2019. Ann Rheum Dis 2020 ; 79(6) : 700-712.
- McInnes IB, et al : Secukinumab versus adalimumab pour le traitement de l’arthrite psoriasique active (EXCEED) : un essai de phase 3b, en double aveugle, en groupes parallèles, randomisé et contrôlé. The Lancet 2020 ; 395(10235) : 1496-1505.
- Reich K, et al. : Bimekizumab versus ustekinumab pour le traitement du psoriasis en plaques modéré à sévère (BE VIVID) : efficacité et sécurité issues d’un essai de phase 3, multicentrique, en double aveugle, avec comparateur actif et contrôle par placebo, d’une durée de 52 semaines. Lancet 2021 ; 397(10273) : 487-498.
- NCT03440736, https://clinicaltrials.gov/ct2/show/NCT03440736
DERMATOLOGIE PRAXIS 2021 ; 31(3) : 20-22 (publié le 1.6.21, ahead of print)