L’introduction du ruxolitinib, un inhibiteur de la Janus kinase (JAK), a modifié de manière spectaculaire le traitement de la myélofibrose au cours des dernières années. Néanmoins, il faut continuer à innover, en particulier dans la deuxième ligne. Des données prometteuses sur de nouvelles options thérapeutiques ont été présentées lors du dernier ASH Annual Meeting en décembre 2020.
Outre la transplantation de cellules souches, la myélofibrose a longtemps manqué d’outils thérapeutiques efficaces. Le développement d’inhibiteurs de JAK a permis de franchir des étapes importantes dans la lutte contre la maladie au cours des dernières années, mais aucun remède n’est encore en vue. Peut-être que l’utilisation de nouvelles substances innovantes permettra au moins de contrôler les symptômes à plus long terme.
État de l’art
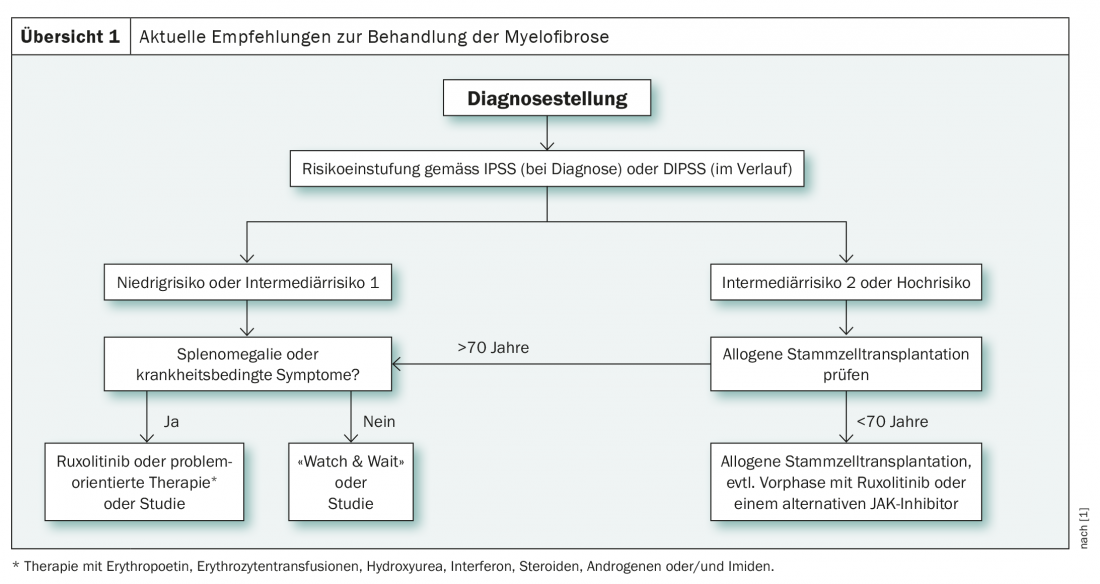
Le choix du traitement en cas de diagnostic de myélofibrose est déterminé par la stratification du risque, qui s’effectue au moment du diagnostic selon l’IPSS(International Prognostic Scoring System) et par la suite selon le DIPPS (Dynamic International Prognostic Scoring System) en quatre groupes (faible risque, intermédiaire-1, intermédiaire-2 et haut risque). Il s’agit de systèmes de scoring clinique qui peuvent être complétés par d’autres méthodes de classification en fonction des besoins. Par exemple, le GIPSS (Genetically Inspired Prognostic Scoring System) prend également en compte les facteurs cytogénétiques et moléculaires. Ils peuvent faciliter la décision pour ou contre une transplantation de cellules souches dans les cas incertains et sont donc particulièrement utiles dans le groupe de risque intermédiaire 1 [1]. En effet, dans ce groupe, selon les nouvelles directives internationales, la transplantation de cellules souches est recommandée chez les personnes de moins de 65 ans si certains critères sont remplis. Il s’agit notamment d’une anémie réfractaire liée à la transfusion, de blastes circulants >2% et d’une cytogénétique ou d’une génétique moléculaire défavorable [2].
Contrairement au groupe à risque intermédiaire 1, la recommandation d’une allogreffe de cellules souches est claire dans le groupe à risque intermédiaire 2 ainsi que dans le groupe à haut risque des moins de 70 ans (aperçu 1). En outre, depuis 2017, le ruxolitinib, un inhibiteur de tyrosine kinase, est de plus en plus utilisé. Celui-ci est notamment utilisé dans la phase préliminaire d’une transplantation de cellules souches ainsi que dans le traitement des personnes atteintes présentant un risque faible à intermédiaire, en particulier en présence de symptômes liés à la maladie ou de splénomégalie. Comme alternative au traitement par ruxolitinib, les patients symptomatiques à risque faible et intermédiaire peuvent également être traités en fonction de leur problème. Cette approche comprend notamment l’utilisation d’érythropoïétine, de transfusions de globules rouges, d’hydroxyurée et de stéroïdes [1].
Le ruxolitinib, mais aussi d’autres inhibiteurs JAK, sont donc en train de gagner du terrain, tant dans le domaine des traitements à faible risque que dans celui des traitements à haut risque. D’une part, ces agents servent à contrôler les symptômes et d’autre part, selon des études récentes, ils peuvent soutenir la transplantation de cellules souches. Près de dix ans après les premières données d’étude sur le ruxolitinib, il apparaît aujourd’hui que l’inhibiteur de JAK a des effets durables sur la splénomégalie ainsi que sur les symptômes liés à la maladie de la myélofibrose, avec une amélioration à long terme de la qualité de vie [3,4]. Lors de la réunion annuelle 2020 de l’ASH , il a également été question de l’allongement potentiel de la durée de survie du médicament, pour lequel les données prometteuses sont de plus en plus nombreuses, même si elles n’étaient jusqu’à présent que rétrospectives [5]. Néanmoins, la progression, notamment vers une leucémie myéloïde aiguë, reste un problème important [5].
Une marge d’amélioration
Malgré les nets progrès thérapeutiques de ces dernières années, il existe encore une grande marge d’amélioration. Les possibilités sont actuellement encore très limitées, en particulier en cas d’échec du traitement par ruxolitinib et d’intolérance à la substance active. Si la résistance primaire est rare, les réponses insuffisantes et la perte de réponse sont plus fréquentes. Ainsi, la durée médiane d’action du ruxolitinib sur la splénomégalie est d’un peu plus de trois ans, ce qui limite souvent l’utilisation de la molécule dans le temps et pose la question des options thérapeutiques complémentaires [3,4]. Ce besoin médical est également mis en évidence par les taux d’abandon du traitement par ruxolitinib analysés dans une étude récente, qui sont de 50 à 60% à trois ans [6]. La durée médiane de survie après l’arrêt du médicament n’est que de 14 mois et est encore plus courte en présence d’aberrations clonales ou d’un faible taux de plaquettes [7].
En outre, l’effet de la substance sur l’anémie, la leucopénie et la thrombocytopénie est souvent insuffisant. Pour pouvoir traiter de manière adéquate les cytopénies survenant dans le cadre de la myélofibrose, il est urgent de mettre en place des stratégies thérapeutiques alternatives. Après tout, près de 40% des patients ont des taux d’hémoglobine inférieurs à 10 g/dl au moment du diagnostic et 20% sont déjà dépendants des transfusions à ce moment-là [8].
Les effets positifs du ruxolitinib ne peuvent pas non plus masquer une lacune évidente : Les rémissions réelles sous le traitement actuel sont extrêmement rares dans le cadre d’un traitement en situation réelle [9]. Cela peut notamment s’expliquer par le mécanisme d’action, la mutation cible JAK2V617F n’étant pas la seule responsable du développement de la myélofibrose. On ne peut donc pas s’attendre à une élimination de la maladie en cas de blocage approprié par un inhibiteur de JAK.
Un regard sur l’avenir
Bien qu’une guérison par cette classe de substances ne soit guère possible d’un point de vue mécanique, l’espoir dans le traitement de la myélofibrose repose toujours principalement sur le développement de nouveaux inhibiteurs de JAK. Ainsi, des données sur trois nouvelles substances ciblant les JAK ont été présentées à l’ASH Annual Meeting 2020 (aperçu 2). Celles-ci devraient à l’avenir compléter le traitement par ruxolitinib. Le fedratinib est déjà autorisé en première ligne aux États-Unis et au Canada, et des études de phase III sont en cours pour l’utilisation du momelotinib et du pacritinib.

Les résultats de l’étude JAKARTA-2 [10] montrent que le fedratinib est également prometteur en deuxième ligne de traitement. Dans ce cas, le médicament a démontré une forte efficacité sur la splénomégalie et les symptômes liés à la maladie dans tous les sous-groupes prétraités par le ruxolitinib. Le taux de réponse était de 55,4%. Le fedratinib pourrait donc bientôt être utilisé en cas de résistance et d’intolérance au ruxolitinib, en particulier si les résultats de JAKARTA-2 sont confirmés dans l’étude randomisée contrôlée FREEDOM-2 actuellement en cours – à condition qu’elle soit autorisée en Suisse et en Europe.
Avec le développement de nouvelles options thérapeutiques, diverses questions sont également mises sur la table. Par exemple, le moment optimal pour passer à un inhibiteur JAK alternatif doit être évalué. Dans ce cas, la devise est jusqu’à présent que le traitement par ruxolitinib doit être arrêté avant le changement afin d’éviter un rebond. Aujourd’hui, on attend la réponse pendant trois mois entiers avant de considérer le traitement comme un échec. De même, le nombre croissant de possibilités rend le choix du traitement plus difficile. Les préférences individuelles, par exemple en ce qui concerne la fréquence des prises, ainsi que le spectre des effets secondaires respectifs, pourront probablement jouer un rôle plus important à l’avenir.
Source : 62e réunion annuelle de l’American Society of Hematology (ASH Annual Meeting), 5-8 décembre 2020, réalisation virtuelle
Littérature :
- Griesshammer M, et al. : Lignes directrices Onkopedia : Myélofibrose primaire (PMF). www.onkopedia.com/de/onkopedia/guidelines/primaere-myelofibrose-pmf/@@guideline/html/index.html (dernier accès le 03.01.2021)
- Barbui T, et al : Philadelphia chromosome-négatif néoplasmes myéloprolifératifs classiques : recommandations de prise en charge révisées de European LeukemiaNet. Leukemia 2018 ; 32(5) : 1057-1069.
- Verstovsek S, et al : Traitement à long terme par ruxolitinib pour les patients atteints de myélofibrose : mise à jour sur 5 ans de l’essai COMFORT-I randomisé, en double aveugle, contrôlé par placebo, phase 3. J Hematol Oncol 2017 ; 10(1) : 55.
- Harrison CN, et al : Long-term findings from COMFORT-II, a phase 3 study of ruxolitinib vs best available therapy for myelofibrosis. Leucémie 2016 ; 30(8) : 1701-1707.
- Al-Ali HK, et al : Primary analysis of JUMP, a phase 3b, expanded-access study evaluating the safety and efficacy of ruxolitinib in patients with myelofibrosis, including those with low platelet counts. Br J Haematol 2020 ; 189(5) : 888-903.
- Harrison CN, Schaap N, Mesa RA. : Gestion de la myélofibrose après un échec du ruxolitinib. Ann Hematol 2020 ; 99(6) : 1177-1191.
- Newberry KJ, et al : Clonal evolution and outcomes in myelofibrosis after ruxolitinib discontinuation. Blood 2017 ; 130(9) : 1125-1131.
- Naymagon L, Mascarenhas J. : Myelofibrosis-Related Anemia : Current and Emerging Therapeutic Strategies. Hemasphere 2017 ; 1(1) : e1.
- Gill H, et al. : Myeloproliferative neoplasms treated with hydroxyurea, pegylated interferon alpha-2A or ruxolitinib : clinicohematologic responses, quality-of-life changes and safety in the real-world setting. Hématologie 2020 ; 25(1) : 247-257.
- Harrison CN, et al : Janus kinase-2 inhibitor fedratinib in patients with myelofibrosis previously treated with ruxolitinib (JAKARTA-2) : a single-arm, open-label, non-randomised, phase 2, multicentre study. Lancet Haematol 2017 ; 4(7) : e317-e24.
InFo ONKOLOGIE & HÄMATOLOGIE 2021 ; 9(1) : 32-33 (publié le 24.2.21 ; ahead of print)