Les lésions traumatiques de la moelle épinière, en plus de la lésion primaire liée au choc initial, s’étendent avec le temps et forment des lésions secondaires non réversibles. L’environnement est très hostile et limite donc les possibilités de régénération et de réparation. Parmi les phénomènes responsables de cette situation, l’inflammation chronique, caractérisée par une concentration élevée de TNFα, et la perte de myéline, causée entre autres par la mort des oligodendrocytes, sont deux acteurs majeurs de cette problématique. De multiples stratégies ont été développées pour adresser ces problèmes. Dans cette étude, avec le soutien de la Fondation Internationale pour la recherche en paraplégie (IRP), nous avons évalué comment est-ce que des cellules souches humaines mésenchymateuses de source dentaire (SCAP) pouvaient jouer sur l’inflammation de la moelle épinière et sur la différentiation des cellules progénitrices d’oligodendrocytes (OPC).
Comment peut-on protéger la moelle épinière de dommages supplémentaires, et idéalement stimuler sa réparation, suite à une lésion traumatique? Nos travaux sur cette question, réalisés grâce au soutien généreux de la Fondation Internationale pour la recherche en paraplégie (IRP), du Fond National pour la Recherche Scientifique (FNRS) et de l’Université Catholique de Louvain (UCL-FSR), ont récemment été publiés dans «Cellular and Molecular Life Sciences». Voici en bref les points majeurs de cette étude.
Une des raisons pour lesquelles le système nerveux central est très peu capable de se régénérer après une lésion est le développement d’un environnement peu permissif. En effet, suite à une lésion traumatique, une cascade d’évènements se produit, incluant des saignements, des processus nécrotiques ou apoptotiques, l’installation d’une inflammation chronique et une démyélinisation, qui conduisent à un élargissement de la zone lésée.
Le rôle de l’inflammation suite à une lésion de la moelle épinière est à la fois bénéfique et délétère, en fonction de sa chronologie [1]. En effet, l’activation des microglies par exemple en un phénotype phagocytaire est bénéfique dans les quelques heures à quelques jours qui suivent la lésion car ces cellules peuvent phagocyter les débris de myéline, inhibiteurs de la repousse axonale. Cependant, si le phénotype des cellules microgliales n’évolue pas en phénotype pro-résolutif, une inflammation chronique s’installe. Il a été ainsi démontré que la présence de cytokines pro-inflammatoires au site de la lésion telles que TNFα induisait la mort cellulaire et donc intensifiait les dommages secondaires [2], alors que la présence de microglies exprimant l’arginase-1 était associée à une meilleure préservation des axones et de la myéline, une diminution de la cicatrice gliale et une amélioration de la fonction motrice [3].
Lors d’une lésion traumatique, la mort des oligodendrocytes est soit directement liée au choc mécanique, soit est induite par la forte inflammation présente au site de la lésion. Il en résulte une démyélinisation progressive, ce qui impacte la fonction axonale et conduit à leur dégénération. La population d’oligodendrocytes peut être régénérée grâce à la prolifération et différentiation de cellules progénitrices d’oligodendrocytes (OPC) présentes dans la moelle épinière. Cependant, en cas de lésion, le potentiel de réparation des OPC est restreint et si remyélinisation il y a, elle est imparfaite, un des problèmes étant une différentiation limitée des OPC.
Ainsi, l’inflammation et la différentiation des OPC sont deux aspects des lésions de la moelle épinière qu’il est important d’adresser. Nous avons émis l’hypothèse que les cellules souches humaines de la papille apicale, tissu dentaire qui donne naissance à la racine dentaire, pouvaient potentiellement améliorer ces aspects. En effet, les cellules souches mésenchymateuses (MSC) sont connues pour leur potentiel régénératif, notamment via leur sécrétome. Les SCAP, un type de MSC, présentent l’avantage d’être faciles à isoler (à partir de dents de sagesses extraites) et d’avoir un potentiel neurogénique élevé, mais elles sont peu étudiées. Nous avons donc, au cours d’études in vitro et ex vivo, évalué l’impact de ces SCAP sur l’activation des cellules microgliales et sur la différentiation des OPC [4] (Fig. 1).
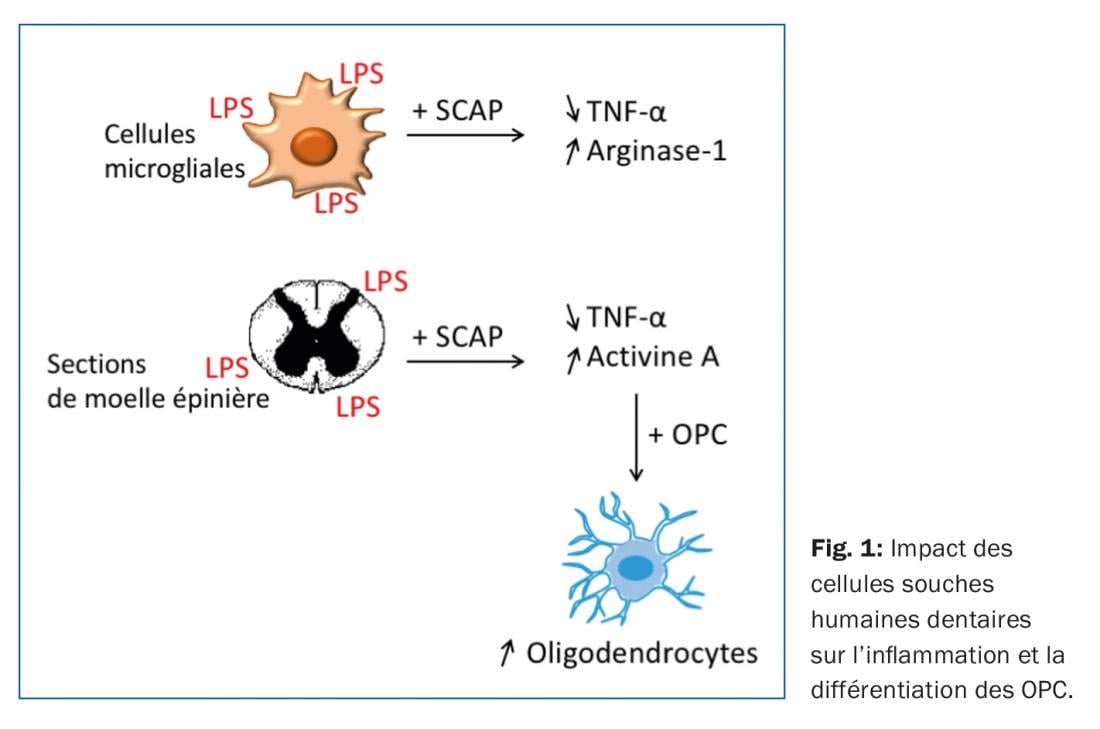
Les SCAP sont ainsi capables d’induire une diminution de l’expression et de la sécrétion de TNFα et une augmentation de l’expression d’arginase-1, quand des cellules microgliales activées (incubation avec du LPS) sont cultivées en leur présence. Elles sont également capables d’induire une augmentation de la quantité d’oligodendrocytes matures (marquages positifs pour MBP et CC1) dans des tranches de moelle épinière de rat en culture en présence d’un stimulus inflammatoire (LPS).
Il apparait que des concentrations en Activin-A plus élevées que dans les contrôles sont observées dans le milieu de culture des tranches de moelle épinière cultivées avec les SCAP. L’Activine-A est une cytokine pléthorique mais à qui on a attribué récemment la propriété de stimuler la différentiation des OPC [5]. Ainsi, la production d’Activine-A dans les co-cultures moelle-SCAP pourrait expliquer pourquoi on observe plus d’oligodendrocytes matures dans les tranches de moelle en présence de SCAP. Il nous a été possible d’établir un lien direct entre la production d’Activine-A et la différentiation des OPC mais il est fort possible que l’Activine-A ne soit pas la seule molécule responsable de ce phénomène.
Ces résultats indiquent que les SCAP sont des cellules intéressantes pour la réparation du système nerveux central. La prochaine étape, qui est en cours, en collaboration avec le Dr Lisa White (Université de Nottingham, UK), est de développer des systèmes de délivrance injectables qui permettent de maintenir les SCAP en vie dans la zone de la lésion et de préserver leur effet sur les microglies et les OPC.
Références:
- Kyritsis N, Kizil C, Brand M: Neuroinflammation and central nervous system regeneration in vertebrates. Trends in cell biology 214, 24(2), 128–135.
- Held KS, Lane TE: Spinal cord injury, immunodepression, and antigenic challenge. In Seminars in immunology 2016; 26(5): 415–420. Academic Press.
- Nakajima H, Uchida K et al.: Transplantation of mesenchymal stem cells promotes an alternative pathway of macrophage activation and functional recovery after spinal cord injury. Journal of neurotrauma 2012; 29(8): 1614–1625.
- De Berdt P, et al.: Cellular and Molecular Life Sciences, (2018 [in Press]).
- Miron VE, Boyd A et al.: M2 microglia and macrophages drive oligodendrocyte differentiation during CNS remyelination. Nature neuroscience 2013: 16(9): 1211.
HAUSARZT PRAXIS 2018; 13(5): 9–10