Dans les processus inflammatoires des maladies dermatologiques, les pro-cytokines inflammatoires jouent un rôle central. C’est pourquoi ils sont au centre de l’attention des approches thérapeutiques lorsqu’il s’agit de briser des voies de signalisation critiques. Outre les anticorps monoclonaux, on utilise de plus en plus des agents de faible poids moléculaire qui ciblent les Janus kinases (JAK). Les premières autorisations de mise sur le marché d’inhibiteurs de JAK ont déjà été accordées dans le cas de la dermatite atopique et du psoriasis, mais les données actuelles sont également prometteuses dans d’autres maladies inflammatoires de la peau telles que le vitiligo et l’alopécie areata.
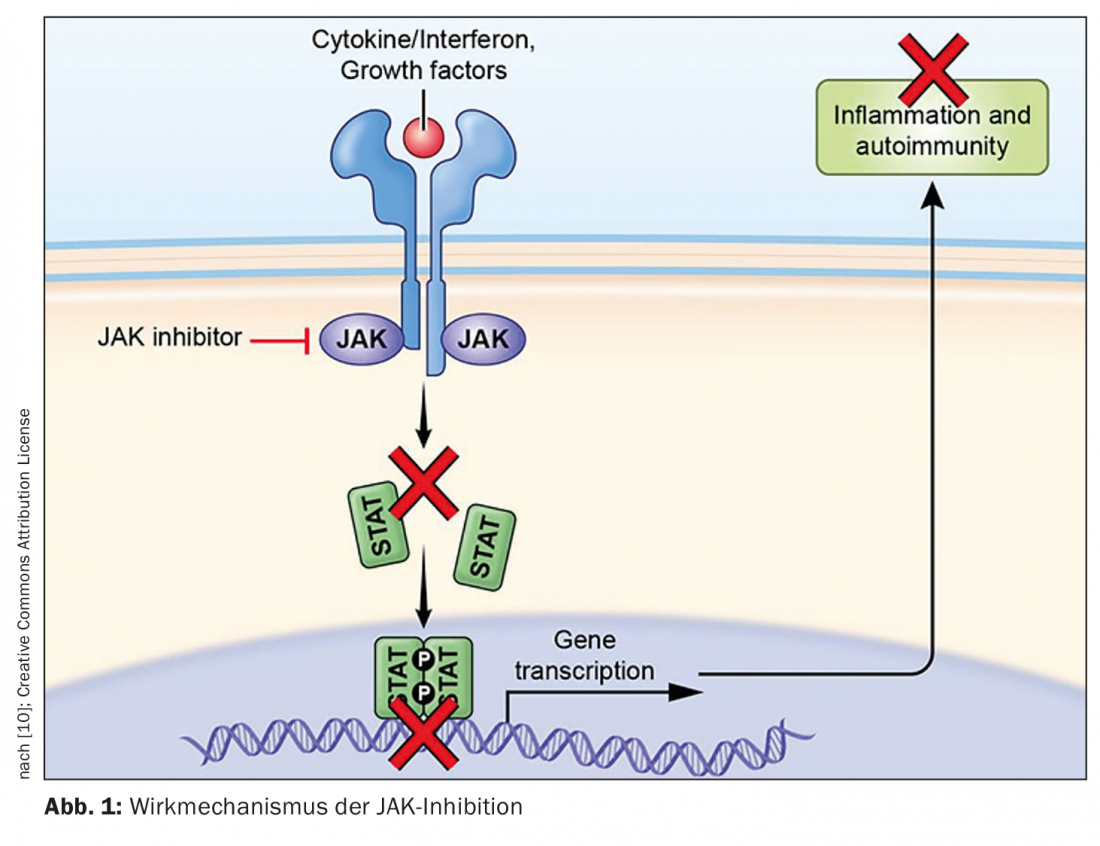
Les inhibiteurs de JAK constituent une extension précieuse des stratégies de traitement systémique des maladies inflammatoires de la peau. “La voie de signalisation JAK-STAT est une clé essentielle dans le traitement des maladies immunologiques et inflammatoires chroniques. Michael Hertl, président en exercice de la Société allemande de dermatologie (DDG) et directeur de la Clinique de dermatologie et d’allergologie de l’Université Philipps et de l’Hôpital universitaire de Marbourg [1]. En occupant les sites d’ancrage STAT, les inhibiteurs JAK inhibent la voie de signalisation JAK-STAT et donc la cascade de signalisation pro-inflammatoire (Fig. 1).
Des voies de signalisation intracellulaires spécifiques sont modulées
La voie de signalisation de la Janus kinase (JAK) dérégulée et activée, transductrice du signal et activatrice de la transcription (STAT), joue un rôle clé dans la pathogenèse de nombreuses dermatoses inflammatoires. Quatre sous-unités de Janus kinases (JAKs) sont présentes dans les cellules humaines : JAK1, JAK2, JAK3 et TYK2. La transduction du signal intracellulaire de nombreuses cytokines pro-inflammatoires est médiée par les Januskinases. Après dimérisation et autophosphorylation, les protéines STAT sont recrutées et phosphorylées, et dirigent la transcription des gènes cibles dans le noyau. Les Janus kinases produisent des homo- ou hétérodimères, la JAK2 étant également présente sous forme d’homodimère [2]. L’inhibition pharmacologique des JAK permet de réduire l’activité de la voie de signalisation JAK-STAT, de sorte que la transduction du signal intracellulaire de plusieurs cytokines pro-inflammatoires est inhibée [1,2].
Les inhibiteurs JAK conquièrent divers domaines d’indications dermatologiques
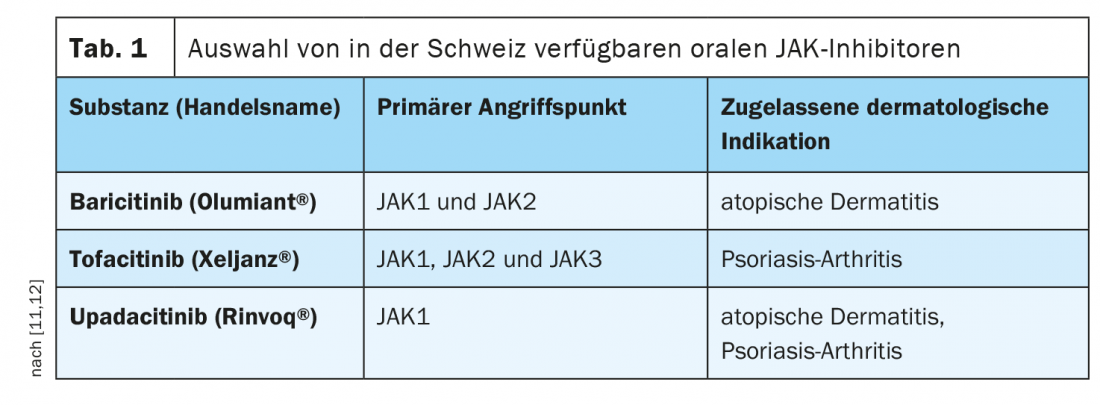
Pour le traitement des patients adultes atteints de dermatite atopique modérée à sévère, le baricitinib (Olumiant®) a été le premier représentant du groupe des inhibiteurs JAK oraux à être autorisé en Suisse au premier trimestre de l’année dernière et, en novembre, l’upadacitinib (Rinvoq®) a également franchi l’obstacle de l’autorisation [4]. Le baricitinib présente notamment une puissance d’action et une sélectivité élevées pour les sous-types JAK1 et JAK2, tandis que l’upadacitinib a pour cible principale JAK1 (tableau 1). Avec l’abrocitinib, un troisième représentant des inhibiteurs de Janus kinase a déjà été autorisé dans l’UE pour cette indication [5]. Pour le traitement des adultes atteints d’arthrite psoriasique active, le tofacitinib (Xeljanz®) est autorisé en Suisse en association avec un DMARD synthétique conventionnel. En outre, une étude de phase II a montré l’efficacité d’une inhibition du TYK2 par le deucravacitinib-BMS986165 par rapport à un placebo [6].
Les données relatives aux inhibiteurs de JAK semblent également prometteuses en ce qui concerne les possibilités d’utilisation dans l’alopécie areata. Dans une méta-analyse de 30 petites études sur les inhibiteurs de JAK dans l’alopécie areata, 72,4% des patients ont répondu au traitement, dont 45,7% avec une bonne réponse (50-100% de repousse des cheveux) et 21,4% avec une réponse partielle (5-50% de repousse des cheveux) [7]. L’efficacité des inhibiteurs de JAK chez les femmes et les hommes atteints d’alopécie areata a également été évaluée dans le cadre de l’étude ALLEGRO, un essai randomisé et contrôlé en double aveugle. Au départ, tous les participants présentaient une perte de cheveux de plus de 50 % sur le cuir chevelu. Le traitement de 24 semaines a été efficace et bien toléré : par rapport au groupe placebo, les participants du groupe placebo ont perdu 20% de leurs cheveux ou moins [8]. Le profil d’effets secondaires des inhibiteurs JAK est clair, explique le professeur Hertl. Les infections peuvent être plus fréquentes, par exemple dans le nez et la gorge ou dans les voies respiratoires. Des infections urinaires, des troubles gastro-intestinaux et de l’acné ont également été observés. “Si l’infection est aiguë, le traitement par inhibiteurs JAK doit bien sûr être interrompu”, a déclaré le président de la DDG. Mais cela fonctionne très bien grâce à l’administration orale et à la courte demi-vie des médicaments, ajoute l’expert [1]. Les inhibiteurs de JAK à application topique font partie des derniers développements. Un inhibiteur de JAK 1/2, administré par crème, a amélioré la peau malade du visage (repigmentation des lésions de vitiligo) chez environ 50% des patients contre 3% pour le placebo dans le traitement du vitiligo d’origine auto-immune [9]. “Ce sont des résultats prometteurs qui suggèrent que cette crème pourrait être une option thérapeutique efficace pour les patients atteints de vitiligo”, souligne le professeur Hertl, qui ajoute : “Les effets secondaires connus avec les pommades à la cortisone n’ont pas été observés” [1].
Congrès : Dermatologie compacte et pratique
Littérature :
- “Petites molécules contre la dermatite atopique, le psoriasis, le vitiligo et l’alopécie circulaire : les inhibiteurs de JAK dans les maladies inflammatoires de la peau élargissent l’éventail des traitements”, Deutsche Dermatologische Gesellschaft e. V. (DDG), 31.01.2022
- Schwartz DM, et al : L’inhibition de JAK comme stratégie thérapeutique pour les maladies immunitaires et inflammatoires. Nat Rev Drug Discov 2017 ; 16 : 843-862.
- Damsky W, et al : Le rôle émergent des inhibiteurs de Janus kinase dans le traitement des maladies auto-immunes et inflammatoires. J Allergy Clin Immunol 2021 ; 147 : 814-826.
- Information sur les médicaments, www.swissmedicinfo.ch, (dernière consultation 07.03.2022)
- Klein B, Treudler R, Simon JC : Inhibiteurs de JAK en dermatologie – petites molécules, grands effets ? Aperçu du mécanisme d’action, des résultats des études et des effets indésirables possibles. J Dtsch Dermatol Ges 2022 ; 20(1) : 19-25.
- Papp K, et al : Phase 2 trial of selective tyrosine kinase 2 inhibition in psoriasis. N Engl J Med 2018 ; 379 : 1313-1321.
- Phan K, Sebaratnam DF : JAK inhibitors for alopecia areata : a systematic review and meta-analysis. J Eur Acad Dermatol Venereol 2019 ; 33 : 850-856.
- King B, et al : A phase 2a randomised, placebo-controlled study to evaluate the efficacy and safety of the oral Janus kinase inhibitors ritlecitinib and brepocitinib in alopecia areata : 24-week results. J Am Acad Dermatol 2021 ; 85(2) : 379-387.
- Rosmarin D, et al : Ruxolitinib cream for treatment of vitiligo : a randomised, controlled, phase 2 trial. Lancet 2020 ; 396 : 110-120.
- Alexander M, et al : Jakinibs of All Trades : Inhibiting Cytokine Signaling in Immune-Mediated Pathologies. Pharmaceuticals 2022 ; 15(1) : 48.
- Bonnekoh H, Butze M, Metz M : Caractérisation des effets des nouvelles thérapies pour le traitement de la dermatite atopique sur le prurit. J Dtsch Dermatol Ges 2022 ; 20(2) : 150-156,
- Karonitsch T : Place des inhibiteurs JAK (“small is beautiful”). J Miner Métabolisme Musculosquelettique Maladie 2021 ; 28 : 78-83.
DERMATOLOGIE PRAXIS 2022 ; 32(2) : 30-31 (publié le 20.4.22, ahead of print)