En 2018, environ 10 millions de personnes ont contracté la tuberculose et 1,45 million en sont décédées. La prise en charge des patients atteints de tuberculose multirésistante (MDR-TB), pour lesquels les deux principaux médicaments du traitement permanent de la tuberculose – l’isoniazide et la rifampicine – ont perdu leur efficacité, représente un défi de plus en plus important.
En 2018, environ 10 millions de personnes ont contracté la tuberculose et 1,45 million en sont décédées. La prise en charge des patients atteints de tuberculose multirésistante (MDR-TB), pour lesquels les deux principaux médicaments du traitement permanent de la tuberculose – l’isoniazide et la rifampicine – ont perdu leur efficacité, représente un défi de plus en plus important. La résistance aux médicaments n’est probablement pas étrangère aux différences de pharmacocinétique entre les médicaments antituberculeux [1]. Cependant, dans les régions où la TB-MR représente une part importante des nouveaux diagnostics, on observe de plus en plus souvent des transmissions directes de l’agent pathogène MDR [2]. La thérapie est longue et peut avoir des effets secondaires, c’est pourquoi une équipe interdisciplinaire et expérimentée est nécessaire pour gérer le traitement. Selon le rapport annuel de l’Organisation mondiale de la santé (OMS), le succès du traitement de la forme multirésistante de la tuberculose n’était actuellement que de 55 à 56% dans le monde [2,3]. Le faible taux de détection des cas de tuberculose-MR dans le monde reste problématique. Avant de pouvoir prendre une décision thérapeutique judicieuse, il faut disposer d’un diagnostic qui permette d’identifier, dans la mesure du possible, toutes les résistances aux médicaments pertinentes. Par exemple, sur les 500 000 nouveaux cas de TB-MR estimés pour l’année 2018, seuls 187 000 ont été diagnostiqués et déclarés. En conséquence, le nombre de cas qui ont pu être traités a été faible (156 000). Selon les statistiques de l’OMS, seule la moitié d’entre eux réussissent à terminer le traitement, ce qui signifie qu’il reste plus de 80% des cas estimés de MDR qui contribuent à la propagation incontrôlée [2].
En Allemagne, 118 cas de TB-MR ont été déclarés en 2018, ce qui représente 3,1% des nouveaux diagnostics, un chiffre stable au cours des dernières années. Dans le rapport de 2019 de l’Institut Robert Koch (RKI), les résultats du traitement des cas de tuberculose MDR de 2017 sont disponibles et un traitement réussi n’a pu être documenté que pour 39% des patients [4]. La date limite pour l’évaluation de ces résultats de traitement transmis au RKI était le 1er mars 2019. Cependant, pour près de 45% des patients, le traitement n’était pas terminé au moment de l’évaluation et le résultat du traitement était donc inconnu. En Suisse, selon les données de l’Office fédéral de la santé publique, sept cas ont été diagnostiqués en 2018 et dix cas en 2019 avec la tuberculose MDR (Office fédéral de la santé publique, communication personnelle).
Les recommandations de l’OMS pour le diagnostic et le traitement de la tuberculose pharmacorésistante, qui ont été considérablement modifiées en 2019 et 2020, sont décrites plus en détail ci-dessous.
Diagnostic
Chez les patients suspects de tuberculose pulmonaire en raison de symptômes typiques ou d’une radiographie thoracique anormale, les recommandations de l’OMS préconisent la recherche de mycobactéries dans au moins 2 échantillons d’expectoration de bonne qualité [5,6]. Ces dernières années, les tests d’amplification des acides nucléiques (NAAT) pour les formes pulmonaires et extrapulmonaires de la tuberculose ont pris une place prépondérante dans le diagnostic initial. Les NAAT permettent de distinguer le complexe M. tuberculosis des mycobactéries non tuberculeuses (NTMs). Avec des méthodes automatisées telles que Xpert® MTB/RIF, un résultat de test d’identification de l’agent pathogène et de résistance à la rifampicine peut être attendu après quelques heures seulement. La nouvelle version du Xpert® MTB/RIF Ultra a montré une amélioration de la sensibilité globale par rapport à la version précédente (90% contre 85% [6]), en particulier pour la tuberculose pulmonaire paucibacillaire sans détection microscopique des mycobactéries (sensibilité de 77% contre 67% [7]). Cette amélioration s’est toutefois accompagnée d’une détérioration de la spécificité (96% contre 99% [6]). Les faux positifs sont plus fréquents, en particulier chez les patients ayant des antécédents de tuberculose au cours des 5 dernières années [7].
La microscopie des crachats pour détecter les bâtonnets acido-alcoolo-résistants donne une indication de la charge bactérienne des crachats et donc du risque d’infection. Cependant, la transmission est possible même si la microscopie est négative et la TAAN positive [8]. Toute suspicion de tuberculose doit faire l’objet d’une culture de l’agent pathogène. La culture est toujours la méthode standard de diagnostic de la tuberculose. Par rapport aux milieux de culture solides, la culture liquide présente une sensibilité légèrement plus élevée, et la croissance des mycobactéries est détectable environ deux semaines plus tôt pour des raisons méthodologiques.
Diagnostic de la résistance aux médicaments
Malgré les défis méthodologiques, les tests de résistance culturelle ou phénotypique ont actuellement encore une grande importance pour les décisions thérapeutiques cliniques en Allemagne et en Suisse [9]. Le test phénotypique de résistance à l’isoniazide, à la rifampicine, aux fluoroquinolones, aux aminoglycosides et aux polypeptides semble plus fiable que pour les autres médicaments antituberculeux [10]. D’une part, cela s’explique par des raisons techniques, comme l’instabilité de substance des carbapénèmes. Dans certains cas, les valeurs limites pour la catégorisation “sensible”/”résistant” font défaut ou ne sont pas suffisamment étayées scientifiquement. Cela concerne en particulier les substances importantes que sont la cyclosérine/terizidone et l’acide para-aminosalicylique (PAS) [11].
La culture de l’agent pathogène et le test phénotypique de résistance peuvent prendre de 2 à 10 semaines. Pendant cette période, un traitement calculé devrait être mis en œuvre, en fonction des schémas de résistance locaux [12,13]. Les résultats d’un test de résistance par biologie moléculaire ou génotypique sont disponibles beaucoup plus rapidement. Dans de nombreux cas, elle peut être réalisée à partir de matériel direct (par exemple, des crachats contenant des agents pathogènes). Les résultats devraient être disponibles au bout de quelques heures à quelques jours et permettent d’initier un traitement ciblé. Cependant, les techniques de biologie moléculaire ne permettent pas actuellement de détecter les résistances à tous les médicaments disponibles. De plus, il est possible de passer à côté de résistances qui ne sont pas associées aux mutations génétiques détectées par les tests rapides. Par conséquent, les résultats des tests rapides de biologie moléculaire doivent généralement être confirmés par le test de résistance phénotypique. De plus en plus, le séquençage du génome entier fournit des résultats supplémentaires et remplace déjà, dans certains pays, le test phénotypique de résistance pour les médicaments de première ligne [14,15].
Nouvelles recommandations de l’OMS en matière de diagnostic
Les résultats des tests de biologie moléculaire montrent, pour certains médicaments, une bonne concordance avec les résultats phénotypiques [15]. C’est pourquoi, depuis 2020, l’OMS recommande d’utiliser des tests rapides de biologie moléculaire plutôt que des méthodes microscopiques et de culture pour le diagnostic initial de l’agent pathogène ainsi que pour le diagnostic de la résistance. C’est notamment le cas du NAAT Xpert® MTB/RIF et du Xpert® MTB/RIF Ultra de la société Cepheid en cas de tuberculose pulmonaire. Ces deux tests indiquent, en plus du diagnostic de l’agent pathogène, une résistance à la rifampicine. Selon l’OMS, les tests Truenat® MTB, MTB Plus et MTB-RIF Dx de la société Molbio peuvent également être utilisés. Pour le diagnostic du LCR en cas de suspicion de méningite tuberculeuse, il est fortement recommandé d’utiliser le Xpert® MTB/RIF Ultra comme test initial. Pour les autres matériaux de prélèvement en cas de suspicion de tuberculose extrapulmonaire, les données analysées ne justifient qu’une faible recommandation, en premier lieu pour le Xpert MTB/RIF [7].
Les Line Probe Assays (LPA), tels que ceux commercialisés par la société Hain Lifescience , peuvent être utilisés pour diagnostiquer la résistance à la rifampicine et à l’isoniazide (GenoType® MTBDRplus) dans les échantillons de crachats positifs au microscope ou par culture. Les LPA pour les médicaments de deuxième ligne (GenoType® MTBDRsl) peuvent être utilisés à la place des tests phénotypiques pour déterminer la résistance aux fluoroquinolones (FQs) et à l’amikacine lorsqu’une résistance à la rifampicine a été détectée auparavant. La même recommandation s’applique en cas de monorésistance à l’isoniazide avant l’introduction d’un traitement par fluoroquinolones. Les tests de résistance phénotypique continuent d’être recommandés par l’OMS lorsqu’aucune résistance n’est détectée lors des tests avec les LPA, mais que la probabilité d’une résistance supplémentaire au-delà de la TB-MR semble élevée [6,7].
Cette année, le nouveau test rapide NAAT Xpert® MTB/XDR pour la détermination simultanée de la résistance à l’isoniazide, aux fluoroquinolones, à l’amikacine, à la kanamycine, à la capréomycine et à l’éthionamide devrait être évalué par l’OMS.
Séquençage
Le séquençage du génome entier (WGS) est une technique qui permet de détecter les mutations rares associées à la résistance aux médicaments. En outre, le séquençage peut être utilisé pour analyser les données épidémiologiques et retracer l’origine des épidémies de tuberculose [16–18]. Un test de résistance phénotypique et génotypique complet, incluant le séquençage, est proposé en Allemagne par des laboratoires de référence et devrait être effectué au moins pour chaque souche de MDR-TB. L’interprétation des mutations génétiques en termes de pertinence clinique représente un défi dans de nombreux cas et constitue une partie essentielle des efforts de recherche actuels visant à généraliser l’utilisation de cette technologie [19]. Les laboratoires de référence en Allemagne et en Suisse proposent désormais le WGS.
Traitement de la tuberculose avec monorésistance à l’isoniazide
On estime qu’environ 8% de la tuberculose dans le monde présente une résistance à l’INH sans résistance à la RMP. L’OMS a donc publié en 2018 une recommandation distincte sur le traitement de la monorésistance à l’INH, qui préconise une quadruple thérapie par lévofloxacine avec ou à la place de l’INH pendant toute la durée du traitement, soit 6 mois [20,21]. Cette recommandation a été adoptée en 2020 [22,23].
En Allemagne, la proportion de résistance aux INH était de 9,4% en 2018 [4], et en Suisse, selon les données de l’Office fédéral de la santé publique, elle était de 6,2% des souches de tuberculose testées (Office fédéral de la santé publique, communication personnelle). La recommandation concernant le traitement de la monorésistance aux INH (tableau 1) sera réévaluée lors de la mise à jour de la ligne directrice allemande, qui a déjà été notifiée. Mais dans un premier temps, les recommandations de 2017 restent valables pour le traitement en Allemagne. Une condition importante pour le traitement est de tester rapidement et de manière fiable la résistance aux fluoroquinolones, souvent utilisées dans cette situation.
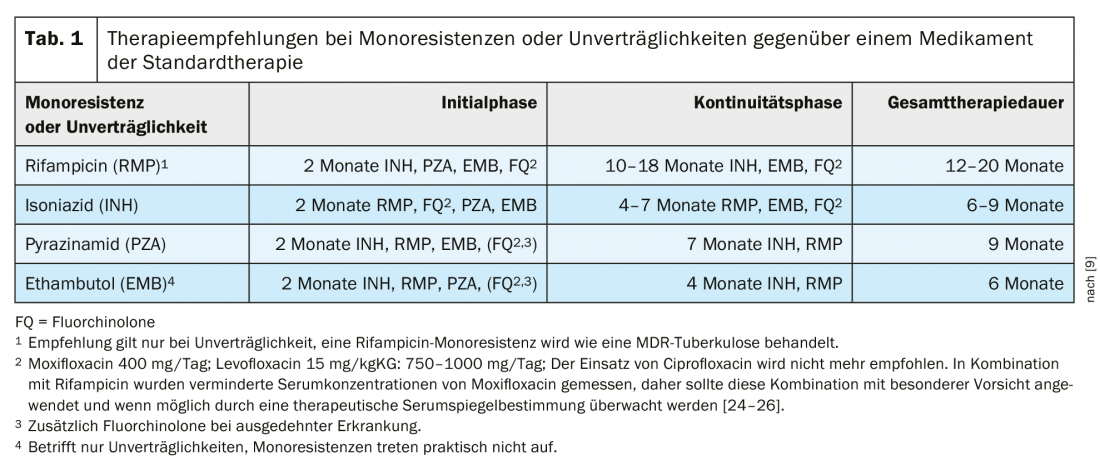
Traitement de la tuberculose avec monorésistance ou intolérance à la rifampicine
Dans les recommandations de l’OMS, la monorésistance à la rifampicine est assimilée à une tuberculose MDR. La résistance à la rifampicine (RR) se produit rarement en l’absence de résistance à l’isoniazide. Comme l’absence de rifampicine a de graves conséquences sur le succès du traitement, la TB-MR et la TB-RR sont souvent regroupées dans les documents de l’OMS. Dans les nouvelles recommandations de l’OMS, il est commenté qu’en cas de MDR/RR, dans le cadre du traitement MDR, l’utilisation d’isoniazide à haute dose (10 -15 mg/kgKG) est possible en cas de sensibilité avérée ou de résistance de bas niveau à l’isoniazide [21]. Les directives thérapeutiques allemandes actuelles recommandent un traitement différent de celui de la résistance à la rifampicine pour les patients intolérants à la rifampicine (tab. 1).
Traitement de la tuberculose multirésistante
Les recommandations de l’OMS ont été mises à jour sur la base des preuves existantes, initialement en 2019 [21]. Une mise à jour complète des recommandations a suivi en 2020, avec le Companion Handbook associé, qui vise à enrichir les recommandations d’aspects pratiques [22,23].
Les médicaments disponibles pour le traitement de la tuberculose pharmacorésistante sont classés dans de nouveaux groupes par l’OMS depuis 2018 (tableau 2). Cette classification reste valable avec les nouvelles recommandations de 2020. Les nouvelles recommandations accordent surtout une place nettement plus importante au nouveau médicament bédaquiline, mais aussi au linézolide. Pourtant, la recommandation d’un traitement entièrement oral représente un véritable changement de paradigme pour la plupart des patients.
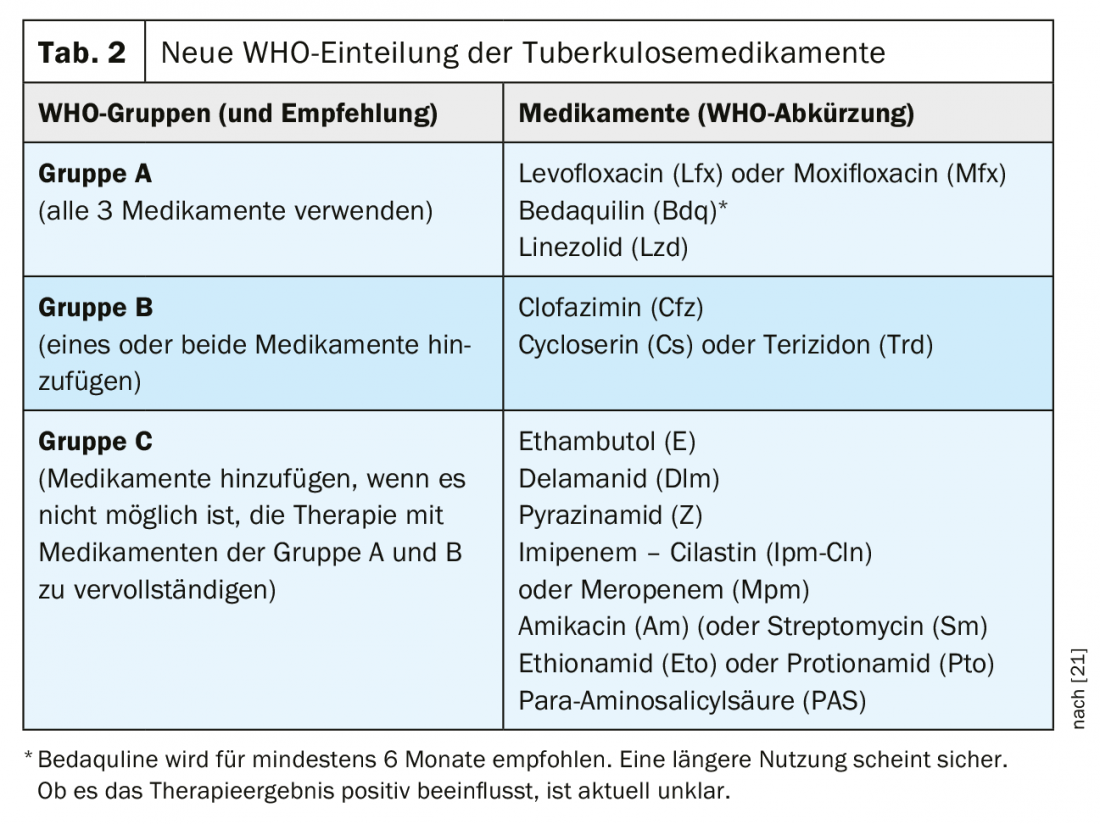
L’OMS recommande que le traitement de la tuberculose MDR [27] associe au moins quatre médicaments dont l’efficacité initiale est très probable.
- Les 3 médicaments du groupe A doivent être utilisés si possible et complétés par 1 médicament du groupe B.
- Si seulement 1 ou 2 médicaments du groupe A peuvent être utilisés, les deux médicaments du groupe B sont alors complétés.
- Si les groupes A et B ne permettent pas de composer un traitement complet, il convient de le compléter par des médicaments du groupe C.
L’European Respiratory Society (ERS), l’American Thoracic Society (ATS) et l’Infectious Disease Society of America (IDSA) recommandent au moins cinq médicaments efficaces pendant la phase intensive, et quatre médicaments par la suite [28].
Malheureusement, à l’exception des fluoroquinolones, les tests de résistance pour les médicaments des groupes A et B ne sont établis que dans des laboratoires de référence. Les nouvelles recommandations de l’OMS proposent toujours une durée de 18 à 20 mois pour ce traitement prolongé. Il est toutefois commenté que la durée du traitement peut être adaptée à la réponse individuelle au traitement antituberculeux MDR. Pour la plupart des patients atteints de TB-MR, une durée de traitement de 15 à 17 mois après la conversion de culture devrait être suffisante. Si l’on utilise l’amikacine ou la streptomycine, la phase intensive avec les aminoglycosides devrait durer 6-7 mois dans la plupart des cas [21].
Une nouveauté importante est le déclassement des aminoglycosides dans le traitement de la tuberculose MDR. L’OMS recommande de les retirer du traitement si possible. Seule l’amikacine (ou la streptomycine) doit être utilisée s’il n’y a pas d’autre possibilité de compléter le traitement contre la TB-MR. La capréomycine et la kanamycine ne sont généralement plus recommandées.
Les nouvelles recommandations de l’OMS pour 2020 prévoient désormais l’utilisation de la bédaquiline
- au-delà de 6 mois,
- en même temps que le nouveau médicament Delamanid
- ou pendant la grossesse
considéré comme suffisamment sûr. La base de données pour ces recommandations était limitée, c’est pourquoi le traitement doit pouvoir être bien surveillé, surtout dans de telles situations [22,23].
Prise de position sur les recommandations de l’OMS du point de vue allemand
Suite à la mise à jour des recommandations de l’OMS en 2019, une déclaration commune a été publiée par le centre de recherche Borstel (FZB) et le DZK, qui soutient les nouvelles recommandations de l’OMS.
Pour le traitement MDR en Allemagne, il est recommandé d’initier un traitement MDR composé de cinq médicaments, à savoir la bédaquiline, le linézolide, la lévo- ou moxifloxacine, la clofazimine et la térizidone, après confirmation par biologie moléculaire de la résistance à la rifampicine et exclusion de la résistance aux fluoroquinolones (gyrA gène position 90, 91 et 94 type sauvage). En cas de détection d’une résistance aux fluoroquinolones par biologie moléculaire, un système de port intraveineux doit être implanté et un traitement par bédaquiline, linézolide, clofazimine, térizidone, amikacine ou méropénem/amoxicilline-acide clavulanique doit être initié. L’objectif reste d’administrer initialement au moins cinq substances efficaces. Le choix de médicaments supplémentaires du groupe C doit se faire en fonction des résultats des tests de résistance [29].
L’amikacine n’est recommandée que pour le traitement des patients adultes atteints de TB-MR/RR :
- lorsqu’un régime thérapeutique composé de médicaments des groupes A et B ne peut pas être établi,
- les résultats des tests de résistance suggèrent que le médicament est efficace et qu’il est possible de s’assurer qu’une surveillance étroite est effectuée afin de détecter rapidement le développement d’effets secondaires [29].
Un tel monitoring est réalisable dans la plupart des centres spécialisés en Allemagne et en Suisse, de sorte que l’amikacine reste ici une option thérapeutique. Les nouvelles recommandations de l’OMS de 2020 soutiennent cette position dans les conditions mentionnées [22].
En Suisse, il n’existe pas de recommandations spécifiques pour le traitement de la tuberculose MDR. Actuellement, l’Office fédéral de la santé publique et la Ligue pulmonaire recommandent de consulter des experts en cas de résistance à la rifampicine. Pour cela, des experts sont joignables tous les jours ouvrables de 8h à 12h et de 14h à 17h au numéro gratuit de la Ligue pulmonaire suisse 0800 388 388 . Sous la direction de ces derniers, il existe un groupe d’experts composé de cliniciens, de microbiologistes et de spécialistes de la santé publique qui discutent de cas complexes et répondent aux questions des praticiens sur une plate-forme en ligne.
Traitement à court terme de la tuberculose multirésistante
Depuis 2016, l’OMS recommande un traitement à court terme de 9 à 12 mois avec une combinaison fixe de médicaments pour les patients sélectionnés atteints de tuberculose MDR et, avec les nouvelles recommandations, privilégie ce traitement par rapport au traitement individualisé plus long [22,23,30]. Les conditions préalables à un tel traitement de courte durée sont la sensibilité démontrée de l’agent pathogène aux fluoroquinolones et, idéalement, à toutes les autres substances utilisées. En outre, le patient ne doit pas avoir été traité auparavant avec l’un des médicaments utilisés pendant plus d’un mois. En Europe, cela ne s’applique probablement qu’à un petit nombre de patients, car une proportion élevée de cas de TB-MR présente une résistance supplémentaire [12,31]. Il n’est donc pas possible de recommander actuellement en Allemagne une utilisation préférentielle de la thérapie à court terme [9,29].
La combinaison de médicaments recommandée par l’OMS en 2016 contenait des aminoglycosides, qui ne devraient plus être utilisés. Des données récentes provenant d’Afrique du Sud ont montré qu’un traitement oral complet de courte durée utilisant la bédaquiline améliorait les résultats thérapeutiques et entraînait moins d’interruptions de traitement [32]. Pour les patients atteints de souches de MDR-TB chez lesquels une sensibilité aux fluoroquinolones a été démontrée et pour lesquels un traitement à court terme est indiqué, l’OMS recommande donc depuis 2020 d’abandonner les aminoglycosides au profit de la bédaquiline. Le traitement oral complet à court terme pendant 9 à 12 mois doit contenir de la bédaquiline, de la lévo- ou moxifloxacine, de l’éthionamide, de l’éthambutol, du pyrazinamide, de l’isoniazide à haute dose et de la clofazimine [22,23].
Nouveau traitement combiné pour la TB-MDR résistante aux fluoroquinolones
La bédaquiline, le prétomanide et le linézolide (BPaL) en association sur 6 à 9 mois sont autorisés aux États-Unis depuis le 14 août 2019 pour le traitement de la tuberculose ultrarésistante (XDR-TB) et en cas d’échec du traitement contre la tuberculose MDR. L’Agence européenne des médicaments a approuvé le pretonamide en juillet 2020 pour le traitement de la XDR- TB ou de la MDR- TB en l’absence d’autres options thérapeutiques. Le nouveau nitroimidazole Pretomanid a été développé par l’organisation à but non lucratif TB-Alliance et le traitement combiné a été testé sur 109 patients en Afrique du Sud. L’autorisation de mise sur le marché a été obtenue dans le cadre d’une étude en ouvert sans bras de comparaison (Nix-TB), qui a montré une bonne efficacité en cas de résistance compliquée, avec un taux de succès thérapeutique de 90% [33].
L’OMS a comparé les données de l’étude Nix-TB avec celles de patients ayant reçu de la bédaquiline et du linézolide dans le cadre d’un traitement combiné pendant 21 à 26 mois en moyenne. Un très bon succès thérapeutique de 97% (BPaL) et 92% (groupe de comparaison) a été observé dans les deux groupes [23]. L’analyse des données de l’étude Nix-TB a montré que des effets secondaires graves peuvent survenir chez 25% des patients sous BPaL. Le linézolide a été utilisé dans l’étude Nix-TB à une dose de 1200 mg par jour. Ce dosage est autorisé pour d’autres infections bactériennes avec une durée de traitement plus courte. Les effets indésirables liés à la dose, tels que la dépression de la moelle osseuse et la neuropathie périphérique, étaient par conséquent fréquents dans l’étude Nix-TB. D’après l’expérience acquise dans le cadre de l’étude, la posologie du linézolide peut être réduite à 600-300 mg après 4 semaines de traitement à haute dose en cas d’effets secondaires pertinents. Une interruption du traitement jusqu’à 35 jours semble également possible. La durée totale du traitement par BPaL doit être d’au moins 6 mois. Si aucune conversion de culture d’expectoration n’est obtenue après 4 mois, la durée du traitement doit être prolongée à 9 mois [23].
L’utilisation de BPaL n’est recommandée par l’OMS que pour les patients MDR-TB résistants aux fluoroquinolones et pour lesquels aucun autre traitement ne peut être mis en place. De plus, l’utilisation doit se faire dans des conditions d’étude et il ne doit pas y avoir eu de traitement préalable par la bédaquiline ou le linézolide pendant plus de 2 semaines [23].
D’autres études visant à améliorer la tolérance de la combinaison de médicaments sont en cours. L’étude ZeNix, par exemple, teste différents dosages de linézolide.
Conclusion et perspectives
L’incidence mondiale de la tuberculose (TB) baisse actuellement de 2% par an. Cette baisse est loin d’être suffisante pour atteindre les objectifs de la stratégie EndTB de l’OMS [2]. La résistance aux médicaments est un obstacle important à cet égard. Les modifications des recommandations thérapeutiques de l’OMS pour la tuberculose multirésistante résumées ici sont le résultat encourageant de l’augmentation des recherches dans ce domaine. L’établissement d’un diagnostic moléculaire et l’approbation de trois nouveaux médicaments pour le traitement de la TB-M/XDR (bédaquiline, délamanide et pretomanide) constituent des succès majeurs. Néanmoins, le nombre de cas de tuberculose MDR estimé chaque année ne diminue pas suffisamment et seuls 51% des cas de tuberculose confirmés dans le monde en 2018 ont même fait l’objet d’un test de résistance à la rifampicine.
En Allemagne et en Suisse, le nombre de cas de tuberculose MDR est faible et les ressources disponibles sont suffisantes. Le traitement est individualisé après un test de résistance détaillé et peut conduire à de meilleurs résultats thérapeutiques [34,35]. Les principaux défis de la lutte contre la tuberculose au 21e siècle concernent toutefois en premier lieu les pays à forte incidence et aux ressources limitées. Outre les développements innovants en matière de diagnostic et de traitement, la prévention, et en particulier la mise au point d’un vaccin efficace, sera d’une importance cruciale pour la lutte contre la tuberculose. Il est urgent d’améliorer l’accès mondial aux possibilités de diagnostic et de traitement déjà existantes et nouvelles pour chaque personne.
Messages Take-Home
- La tuberculose est une maladie rare en Suisse, mais 10 millions de nouveaux cas de tuberculose sont recensés chaque année dans le monde.
- Dans le cas de la tuberculose multirésistante, les deux principaux médicaments du traitement de la tuberculose, l’isoniazide et la rifampicine, ne sont plus efficaces.
- En Allemagne et en Suisse, le traitement est individualisé après un test de résistance détaillé.
- Les techniques de biologie moléculaire permettent d’établir un diagnostic rapide afin de mettre en place un traitement ciblé. Pour l’instant, ces résultats doivent encore être confirmés par un test phénotypique.
- Le traitement complexe et long d’une tuberculose MDR doit être dirigé par des experts expérimentés. Il existe des services de conseil gratuits de la Ligue pulmonaire suisse (tél. : 0800 388 388).
Littérature :
- Prideaux B, et al : The association between sterilizing activity and drug distribution into tuberculosis lesions. Nat Med 2015 ; 21(10) : 1223-1227.
- Rapport mondial sur la tuberculose 2019. Genève : Organisation mondiale de la santé 2019. Licence : CC BY-NC-SA 3.0 IGO.
- Rapport mondial sur la tuberculose 2018, Organisation mondiale de la santé, Genève.
- Rapport sur l’épidémiologie de la tuberculose en Allemagne pour 2018. Institut Robert Koch 2019.
- Mase SR, et al : Yield of serial sputum specimen examination in the diagnosis of pulmonary tuberculosis : a systematic review. Int J Tuberc Lung Dis 2007 ; 11(5) : 485-495.
- Manuel opérationnel de l’OMS sur la tuberculose. Module 3 : diagnostic – diagnostics rapides pour la détection de la tuberculose. Genève : Organisation mondiale de la santé 2020. Licence : CC BY-NC-SA 3.0 IGO.
- Lignes directrices consolidées de l’OMS sur la tuberculose. Module 3 : diagnostic – diagnostic rapide pour la détection de la tuberculose. Genève : Organisation mondiale de la santé 2020. Licence : CC BY-NC-SA 3.0 IGO.
- Tostmann A, et al : Tuberculosis transmission by patients with smear-negative pulmonary tuberculosis in a large cohort in the Netherlands. Clin Infect Dis 2008 ; 47(9) : 1135-1142.
- Schaberg T, et al. : Tuberculosis Guideline for Adults – Guideline for Diagnosis and Treatment of Tuberculosis including LTBI Testing and Treatment of the German Central Committee (DZK) and the German Respiratory Society (DGP). Pneumologie 2017 ; 71(6) : 325-397.
- Lange CI, Abukabar I, Alffenaar JW : Prise en charge des patients atteints de tuberculose multirésistante/extensivement pharmacorésistante en Europe : une déclaration de consensus TBNET. 2014.
- OMS, Rapport technique sur les concentrations critiques pour les tests de susceptibilité aux médicaments antituberculeux des médicaments utilisés dans le traitement de la tuberculose pharmacorésistante. 2018.
- Otto-Knapp R, et al. : Résistance aux médicaments de seconde ligne chez les migrants atteints de tuberculose multirésistante dans la région de Berlin. Pneumologie 2014 ; 68 : 496-500.
- Lange C, et al : Management of patients with multidrug-resistant/extensively drug-resistant tuberculosis in Europe : a TBNET consensus statement. The European Respiratory Journal 2014 ; 44 : 23-63.
- Public Health England National Infection Service. National Mycobacterium Reference Service-South (NMRS-South). Manuel de l’utilisateur 2019.
- Allix-Beguec C, et al : Prediction of Susceptibility to First-Line Tuberculosis Drugs by DNA Sequencing. N Engl J Med 2018 ; 379(15) : 1403-1415.
- Galagan JE : Genomic insights into tuberculosis. Nat Rev Genet 2014 ; 15(5) : 307-320.
- Nikolayevskyy V, et al : Whole genome sequencing of Mycobacterium tuberculosis for detection of recent transmission and tracing outbreaks : A systematic review. Tuberculosis (Edinb) 2016 ; 98 : 77-85.
- Merker M, et al : The Evolution of Strain Typing in the Mycobacterium tuberculosis Complex. Adv Exp Med Biol 2017 ; 1019 : 43-78.
- Meehan CJ, et al : Whole genome sequencing of Mycobacterium tuberculosis : current standards and open issues. Nat Rev Microbiol 2019 ; 17(9) : 533-545.
- OMS, Lignes directrices de l’OMS pour le traitement de la tuberculose résistante à l’isoniazide : Supplément aux lignes directrices de l’OMS pour le traitement de la tuberculose résistante aux médicaments 2018 ; Organisation mondiale de la santé : Genève.
- OMS, lignes directrices consolidées de l’OMS sur le traitement de la tuberculose pharmacorésistante 2019 ; Organisation mondiale de la santé Genève
- Lignes directrices consolidées de l’OMS sur la tuberculose. Module 4 : traitement – traitement de la tuberculose pharmacorésistante. Genève : Organisation mondiale de la santé 2020. Licence : CC BY-NC-SA 3.0 IGO.
- Manuel opérationnel de l’OMS sur la tuberculose. Module 4 : traitement – traitement de la tuberculose pharmacorésistante. Genève : Organisation mondiale de la santé 2020. Licence : CC BY-NC-SA 3.0 IGO.
- Weiner M, et al : Effets de la rifampine et du polymorphisme du gène de résistance à plusieurs médicaments sur les concentrations de moxifloxacine. Antimicrob Agents Chemother 2007 ; 51(8) : 2861-2866.
- Nijland HM, et al : La rifampicine réduit les concentrations plasmatiques de moxifloxacine chez les patients atteints de tuberculose. Clin Infect Dis 2007 ; 45(8) : 1001-1007.
- Alsultan A, Peloquin CA : Therapeutic drug monitoring in the treatment of tuberculosis : an update. Drugs 2014 ; 74(8) : 839-854.
- Ahmad N, et al : Correlats de traitement des résultats réussis dans la tuberculose pulmonaire multidrug-résistante : une méta-analyse de données de patients individuels. Lancet 2018 ; 392(10150) : 821-834.
- Nahid P, et al. : Traitement de la tuberculose pharmacorésistante. Un guide de pratique clinique officiel de l’ATS/CDC/ERS/IDSA. Am J Respir Crit Care Med 2019 ; 200(10) : e93-e142.
- Maurer B, et al : Prise de position commune sur la nouvelle recommandation de l’OMS concernant le traitement de la tuberculose multirésistante et résistante à la rifampicine. Pneumologie 2019 ; 1-4 (in press).
- Lignes directrices de l’OMS pour le traitement de la tuberculose pharmacorésistante – Update 2016.
- Günther G, et al. : Multidrug-resistant tuberculosis in Europe, 2010-2011. Maladies infectieuses émergentes 2015 ; 21 : 409-416.
- Communication rapide : changements clés dans le traitement de la tuberculose pharmacorésistante. Genève : Organisation mondiale de la santé 2019 (WHO/CDS/TB/2019.26). Licence : CC BY-NC-SA 3.0 IGO.
- Conradie F, et al : Treatment of Highly Drug-Resistant Pulmonary Tuberculosis. New England Journal of Medicine 2020 ; 382(10) : 893-902.
- Olaru ID, et al : Bedaquiline-based treatment regime for multidrug-resistant tuberculosis. Eur Respir J 2017 ; 49(5).
- Heyckendorf J, et al. : Guérison sans rémission de la tuberculose multirésistante en Allemagne. Eur Respir J 2018 ; 51(2).
InFo PNEUMOLOGIE & ALLERGOLOGIE 2020 : 2(3) : 6-11