La gestion du traitement des patientes atteintes d’un cancer de l’endomètre primaire avancé ou récidivant évolue. Cette possibilité est offerte par le potentiel du dostarlimab, qui s’exprime surtout chez les personnes atteintes d’un déficit de réparation des mismatch/d’une instabilité élevée des microsatellites. Cependant, d’autres évaluations intermédiaires alimentent également l’espoir d’en savoir plus.
Le cancer de l’endomètre est le sixième cancer le plus fréquent chez la femme dans le monde et le deuxième type de cancer gynécologique le plus fréquent. Dans le traitement de première ligne du cancer de l’endomètre primaire avancé ou récidivant, le carboplatine plus paclitaxel est généralement utilisé comme chimiothérapie standard. Cependant, les résultats à long terme restent médiocres, avec une médiane de survie globale inférieure à 3 ans. Les tumeurs déficientes en réparation de mésappariement (dMMR) avec une instabilité élevée des microsatellites (MSI-H) représentent 25 à 30 % des cancers de l’endomètre. L’expression accrue du récepteur de mort cellulaire programmée 1 (PD-1) et de ses ligands (PD-L1 et PD-L2) ainsi que la charge mutationnelle élevée des tumeurs dMMR-MSI-H les rendent donc potentiellement vulnérables aux thérapies anti-PD-1 et anti-PD-L1. C’est pourquoi le dostarlimab, un inhibiteur actif de point de contrôle immunitaire ciblant le récepteur PD-1, a été étudié plus en détail pour cette clientèle. Cette molécule a été approuvée en Suisse sur la base des résultats de l’étude GARNET pour le traitement de patientes adultes atteintes d’un cancer de l’endomètre (CE) dMMR-MSI-H récidivant ou avancé, qui a progressé pendant ou après un traitement antérieur par un schéma thérapeutique à base de platine. Les données montrent également une activité antitumorale durable chez les patientes atteintes de tumeurs à réparation déficiente (pMMR), stables au niveau des microsatellites (MSS), bien que la réponse ait été moins fréquente que chez les patientes atteintes de tumeurs dMMR-MSI-H. Étant donné que la chimiothérapie cytotoxique peut également avoir des effets immunomodulateurs, tels que l’interruption des voies de signalisation immunosuppressives et l’augmentation de la réponse des cellules T cytotoxiques, la combinaison de la chimiothérapie et de l’immunothérapie peut avoir des effets synergiques dans le microenvironnement de la tumeur. Des bénéfices cliniques, y compris une amélioration du taux de survie, ont été rapportés avec cette combinaison dans différents types de cancer.
La survie sans progression et la survie globale en ligne de mire
Une étude de phase III randomisée en double aveugle a analysé l’efficacité et l’innocuité du dostarlimab en association avec le carboplatine et le paclitaxel par rapport à un placebo plus carboplatine et paclitaxel chez 494 patientes atteintes d’un cancer de l’endomètre primaire avancé ou récidivant. Les patientes ont été randomisées pour recevoir un rapport 1 :1 soit 500 mg de l’anticorps monoclonal, soit un placebo par voie intraveineuse en association avec du carboplatine à raison d’une aire sous la courbe de 5 mg par millilitre par minute et du paclitaxel à raison de 175 mg par mètre carré de surface corporelle par voie intraveineuse toutes les trois semaines pendant les six premiers cycles, suivi de dostarlimab (1000 mg) ou d’un placebo par voie intraveineuse toutes les six semaines pendant trois ans au maximum ou jusqu’à la progression de la maladie, l’arrêt du traitement en raison d’effets toxiques, le retrait du patient, la décision de l’investigateur de retirer le patient ou le décès.
Les critères d’évaluation primaires étaient la survie sans progression (PFS) chez les patientes atteintes d’un cancer de l’endomètre H dMMR-MSI primaire avancé ou récidivant et dans la population globale, ainsi que la survie globale (OS) dans la population globale. La survie sans progression a été définie comme le temps écoulé entre la randomisation et le moment le plus précoce de l’évaluation radiologique d’une maladie évolutive ou du décès de toute cause en l’absence de maladie évolutive, selon ce qui survient en premier. La survie globale était définie comme le temps écoulé entre la randomisation et le décès de toute cause. Les critères d’évaluation secondaires comprenaient la survie sans progression, déterminée par un examen central indépendant en aveugle, la réponse objective, le contrôle de la maladie, la durée de la réponse, le délai avant la seconde progression de la maladie, les résultats rapportés par les patients et les analyses pharmacocinétiques et d’immunogénicité.
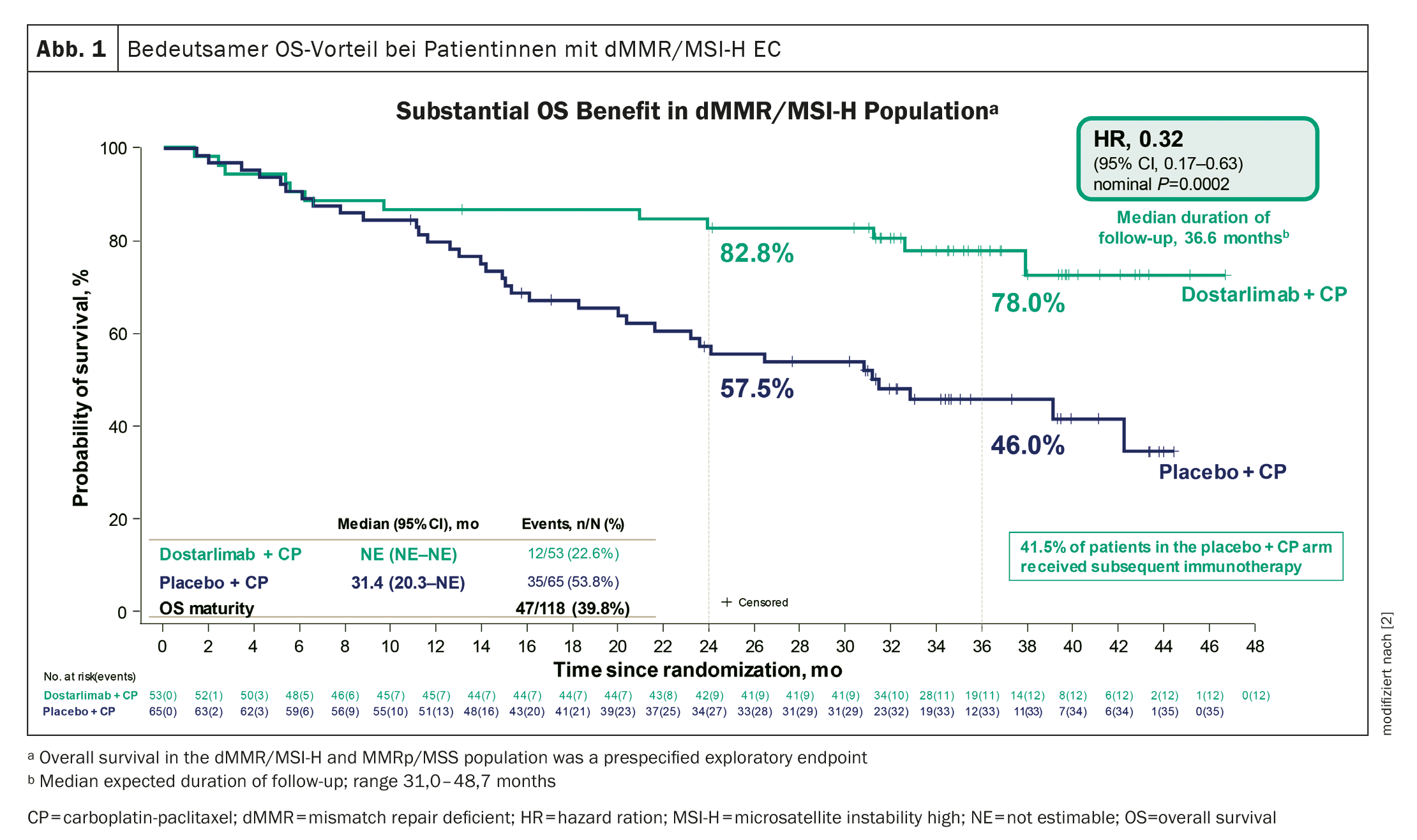
Avantage significatif en termes de survie globale
La durée médiane du suivi était de 24,8 mois dans la population dMMR-MSI-H et de 25,4 mois dans la population totale.
A la date de référence, 36% de la population dMMR-MSI-H dans le groupe dostarlimab et 72% dans le groupe placebo étaient décédés ou avaient vu leur maladie progresser.
Dans la population totale, 55,1% dans le groupe dostarlimab et 71,1% dans le groupe placebo étaient décédés ou présentaient une progression de la maladie.
Il s’est avéré que le traitement par dostarlimab était associé à une réduction de 72% du risque de progression de la maladie ou de décès chez les patients atteints de tumeurs dMMR-MSI-H par rapport au placebo.
Dans l’ensemble de la population, la PFS à 24 mois était de 36,1% dans le groupe verum et de 18,1% dans le groupe placebo.
L’OS était également plus long avec le traitement combiné par l’anticorps monoclonal qu’avec le placebo, avec une durée de suivi de 25,4 mois, mais les résultats n’ont pas atteint le niveau de signification fixé comme règle d’arrêt.
Aujourd’hui, les résultats actuels d’une deuxième évaluation intermédiaire dressent un tableau plus précis.
Un avantage considérable et sans précédent en termes de survie chez les patientes atteintes de CE dMMR/MSI-H a été démontré (figure 1). En outre, le traitement par dostarlimab a montré une amélioration statistiquement significative et cliniquement significative de la SG dans la population globale et un avantage cohérent dans la plupart des sous-groupes.
Des sous-groupes en bénéficient également
Alors que les tumeurs dMMR-MSI-H sont principalement endométrioïdes, les tumeurs pMMR-MSS sont plus hétérogènes et comprennent des sous-types histologiques à haut risque – y compris les carcinosarcomes. Les patientes atteintes de carcinosarcomes ont été incluses dans l’étude. Les tumeurs qui sont des MSS pMMR ont généralement une charge mutationnelle tumorale plus faible, mais l’expression de PD-1 est largement répandue dans le cancer de l’endomètre des MSS pMMR. Un bénéfice du schéma dostarlimab** a également été observé dans la population MSS pMMR, bien qu’il soit moins important que dans la population MSI-H dMMR. Le bénéfice du traitement s’est révélé cohérent en termes de survie sans progression et de survie globale.
** Le dostarlimab est actuellement autorisé en Suisse en combinaison avec la chimiothérapie uniquement pour la population de patients dMMR/MSI-H. Le dostarlimab est également autorisé en combinaison avec la chimiothérapie.
Profil de sécurité connu confirmé
Le profil de sécurité du dostarlimab-carboplatine-paclitaxel était conforme à celui des composants individuels du schéma thérapeutique. La fréquence des événements indésirables graves et sévères était environ 10% plus élevée avec le traitement par dostarlimab qu’avec le traitement par placebo. La fréquence d’arrêt de la chimiothérapie était similaire dans les deux groupes. La qualité de vie était également similaire dans les deux groupes pendant la chimiothérapie.
Dans l’ensemble, l’association dostarlimab, carboplatine et paclitaxel a amélioré de manière significative les résultats chez les patientes atteintes d’un cancer de l’endomètre primaire avancé ou récidivant nouvellement diagnostiqué, avec un bénéfice significatif observé dans les tumeurs dMMR-MSI-H – mais aussi au-delà. Les données confirment donc le traitement combiné comme nouveau standard pour les patientes atteintes d’un cancer primaire avancé ou récidivant, quel que soit le statut de réparation du mismatch.
Littérature :
- Mirza MR, Chase DM, Slomovitz BM, et al.: Dostarlimab for Primary Advanced or Recurrent Endometrial Cancer. N Engl J Med. 2023 Jun 8; 388(23): 2145–2158.
- Powell MA, Auranen A, Willmott L, et al.: Overall survival in patients with primary advanced or recurrent endometrial cancer treated with dostarlimab plus chemotherapy in Part 1 of the ENGOT-EN6-NSGO/GOG-3031/RUBY trial. Poster. Annual Meeting on Women’s Cancer (SGO), 16–18.03.2024, San Diego (USA).
- Mirza MR, Sharma S, Herrstedt J, et al.: Dostarlimab + Chemotherapy for the Treatment of Primary Advanced or Recurrent Endometrial Cancer: Analysis of Progression-Free Survival and Overall Survival Outcomes by Molecular Classification in the ENGOT-EN6-NSGO/GOG-3031/RUBY Trial. Poster. European Society of Medical Oncology (ESMO), 20–24.10.2023, Madrid (ES).
InFo ONKOLOGIE HÄMATOLOGIE 2024; 12(3): 26–27