Le syndrome des jambes sans repos est une maladie fréquente et généralement chronique, dont le traitement doit être adapté en permanence au cours de l’évolution. Ces dernières années, des études et des recommandations sur le traitement à long terme sont devenues disponibles. Elles accordent une plus grande attention à l'”augmentation”, un effet secondaire paradoxal des agonistes dopaminergiques, et accordent donc une plus grande place aux ligands α2δ et parfois aux opiacés.
Le syndrome des jambes sans repos (SJSR) est une maladie neurologique fréquente qui touche jusqu’à 4% de la population féminine et 2% de la population masculine. Bien que l’intensité des symptômes varie souvent d’un jour à l’autre et sur de longues périodes, le RLS persiste généralement toute la vie. Alors que la question de savoir si les troubles du sommeil causés par un RLS constituent un risque de maladie cardiovasculaire et cérébrovasculaire reste controversée, l’impact négatif d’un RLS sévère sur la qualité de vie de la personne concernée et de ses proches est bien établi.
Diagnostic – penser aux Mimics
Après avoir été longtemps méconnu, le RLS a fait l’objet d’une prise de conscience encourageante ces dernières années, tant chez les médecins que chez les non-spécialistes de la santé. Dans ce contexte, les participants ont également mis en garde contre le risque de surdiagnostic, qui peut entraîner des prescriptions de médicaments inutiles et les coûts et effets secondaires correspondants. La dernière classification des troubles du sommeil et de l’éveil (ICSD-3) tient compte de ce problème en recherchant une plus grande spécificité diagnostique. Comme auparavant, le diagnostic du RLS repose sur quatre critères cliniques obligatoires :
- Besoin de bouger les jambes, souvent associé à des sensations désagréables
- Renforcement au repos, c’est-à-dire en position assise et couchée
- Amélioration nette pendant l’activité physique
- Augmentation des symptômes le soir ou pendant la nuit.
Pour poser le diagnostic de RLS, les quatre critères doivent être remplis ou – étant donné que la durée des troubles peut s’étendre à toute la journée en cas de sévérité croissante de la maladie – avoir été remplis une fois au cours de la maladie. Un cinquième critère, également obligatoire, a été ajouté : la qualité de vie doit être limitée par l’ampleur des troubles.
Ces critères diagnostiques sont obligatoires, mais ne sont pas spécifiques au RLS. Les “RLS mimics” tels que les arthropathies, les œdèmes des jambes, les crampes des jambes ou un “positional discomfort” (uniquement en position assise, pas en position couchée, avec soulagement par simple changement de position des jambes) sont parfois décrits par les personnes concernées avec des termes similaires à ceux d’un RLS, mais peuvent généralement être bien délimités par des questions ciblées. Lors du diagnostic différentiel d’une polyneuropathie (à petites fibres), il faut garder à l’esprit que celle-ci augmente le risque de RLS et qu’une personne peut donc avoir les deux causes de paresthésies et d’envie de bouger les jambes. Dans les cas peu clairs, les résultats d’examens complémentaires tels que la mise en évidence de mouvements périodiques des jambes pendant le sommeil (PLMS) et l’éveil (PLMW), souvent associés au RLS, au moyen d’une polysomnographie ou – de manière moins coûteuse – d’une actigraphie ambulatoire des pieds, et tout particulièrement la réponse des symptômes à de faibles doses de dopaminergiques, peuvent aider. L’anamnèse familiale typiquement positive dans le RLS idiopathique n’est souvent pas fiable et une difficulté à s’endormir, bien que typique, est trop peu spécifique comme critère de diagnostic.
Après le diagnostic syndromique du RLS, un petit nombre d’examens de laboratoire sont généralement utiles en ce qui concerne les facteurs susceptibles de déclencher ou d’aggraver le RLS, par exemple l’insuffisance rénale ou la carence en fer.
Qui a besoin d’un traitement ?
Toutes les personnes répondant aux critères de diagnostic du RLS n’ont pas besoin d’un traitement médicamenteux. On considère généralement que les symptômes nécessitent un traitement lorsqu’ils sont présents au moins deux à trois jours par semaine et qu’ils affectent clairement le patient dans sa qualité de vie. Différentes échelles sont disponibles pour évaluer la sévérité de la maladie, ce qui permet une évaluation très importante de l’évolution. Dans la pratique, l’échelle de Johns Hopkins (tab. 1) est bien adaptée, car elle devrait également permettre d’évaluer l’augmentation à un stade précoce.

Il convient tout d’abord d’identifier les stimulants et les médicaments qui provoquent le RLS et de les éviter dans la mesure du possible (tableau 2). Les antidépresseurs peuvent certes aggraver le RLS dans jusqu’à 10% des cas (en particulier la mirtazapine [Remeron®]), mais environ 70% des patients présentant une comorbidité de RLS et de dépression en bénéficient. Un traitement causal est surtout possible en cas de RLS secondaire à une carence en fer. Bien que l’on ne sache pas encore de manière définitive quels sont les patients atteints de RLS qui bénéficient d’une substitution en fer, celle-ci est recommandée lorsque la ferritine <50-75 μg/l. Si les préparations orales entraînent une augmentation insuffisante de la ferritine ou sont mal tolérées, l’administration de fer par voie intraveineuse est une alternative.

Un traitement médicamenteux des mouvements périodiques des jambes pendant le sommeil (PLMS) sans présence simultanée de troubles du RLS à l’état d’éveil sous le concept de “Periodic Leg Movement Disorders” (PLMD) ne devrait être entrepris qu’avec une grande prudence, de petites doses de médicaments et sous contrôle étroit des troubles subjectifs tels que la fatigue, la somnolence ou l’insomnie, afin d’éviter dans tous les cas une augmentation.
Le choix du premier médicament
Si les mesures mentionnées ne permettent pas d’obtenir une amélioration suffisante, différentes classes de médicaments sont disponibles pour traiter le RLS (tab. 3). Le choix de la préparation dépend de la sévérité et de la fréquence des troubles, des comorbidités et des effets secondaires potentiels des médicaments (tab. 4).
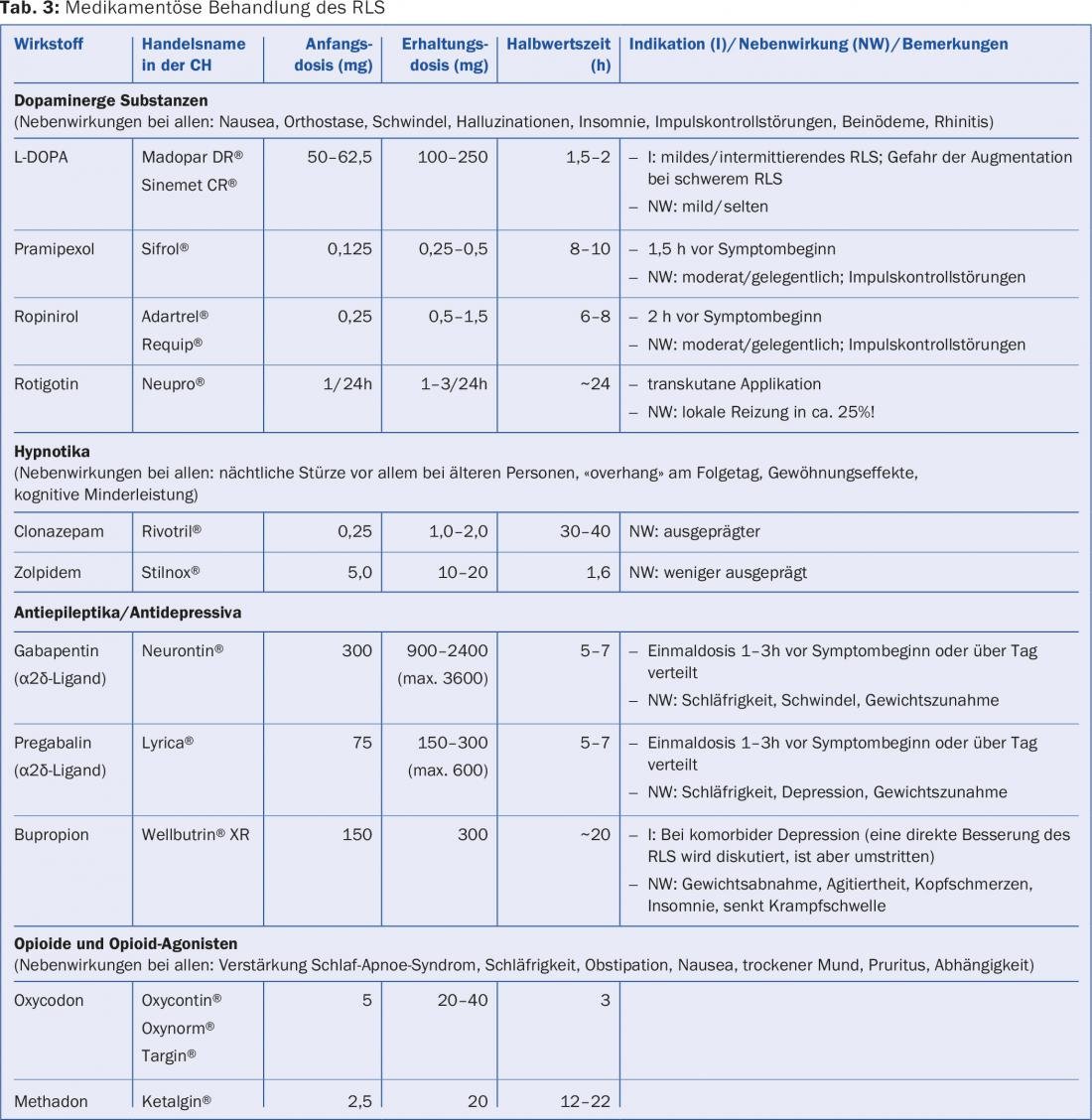

Les différents agonistes dopaminergiques (DA), sans doute les plus prescrits aujourd’hui, sont bien connus, tandis que la L-DOPA n’est plus que rarement recommandée en cas de troubles intermittents très légers du RLS.
L’efficacité à court terme de l’AD a été démontrée dans plusieurs études. Ils constituent généralement un bon choix, en particulier pour les patients qui n’ont besoin d’un médicament qu’occasionnellement, par exemple pour aller au théâtre le soir. Dans ce cas, un AD à courte durée d’action (pramipexole, ropinirole) peut par exemple être pris une à deux heures avant les symptômes attendus.
Les doutes sur le succès à long terme avec les dopaminergiques sont devenus de plus en plus actuels en raison de la perte d’efficacité, pas si rare, et de l’effet secondaire le plus important et malheureusement relativement fréquent, l’augmentation. Outre les effets secondaires généralement faciles à identifier, tels que les nausées, la somnolence diurne avec risque d’endormissement ou encore l’insomnie, il convient d’attirer particulièrement l’attention des patients, avant le début du traitement et lors des examens de contrôle, sur les troubles du contrôle des impulsions souvent méconnus, tels que l’alimentation incontrôlée, le shopping et le jeu, mais aussi l’hypersexualité.
Récemment, certains experts ont donc recommandé les ligands α2δ (prégabaline et gabapentine) comme médicaments alternatifs de premier choix. En particulier pour les patients présentant des troubles douloureux comorbides, par exemple dans le cadre d’une polyneuropathie, leur utilisation primaire est en tout cas judicieuse. La prégabaline peut être recommandée en complément en cas de trouble anxieux généralisé comorbide, qui est plus fréquent dans le RLS. Ces médicaments sont également sujets à des effets secondaires fréquents mais généralement réversibles, tels que la somnolence, les vertiges et la prise de poids. Dans une étude comparative d’un an entre la prégabaline et le pramipexole, la prégabaline a été arrêtée plus fréquemment en raison d’effets secondaires, alors que son efficacité était comparable.
Dans l’évolution naturelle du RLS, il y a toujours des phases spontanées avec peu de symptômes, raison pour laquelle il faut essayer d’arrêter une pharmacothérapie établie chez un patient asymptomatique ou peu symptomatique.
En cas d’admission à l’hôpital ou dans une maison de retraite, nous recommandons aux patients de télécharger sur le site www.restless-legs.ch la fiche d’information pour une admission à l’hôpital et de la soumettre aux médecins et soignants concernés.
Lorsque le traitement ne fonctionne plus
Si un patient atteint de RLS présente à nouveau des symptômes sous un traitement médicamenteux jusqu’ici efficace, il convient d’abord de rechercher les changements de comportement et les maladies concomitantes susceptibles d’aggraver le RLS. Une diminution de l’activité physique, une augmentation de la consommation d’alcool ou une insomnie pour d’autres raisons (par exemple, rester couché trop longtemps) peuvent aggraver un RLS. Les nouveaux médicaments prescrits ou l’arrêt d’un traitement opiacé pris depuis longtemps sont d’autres causes d’aggravation. Comme lors du diagnostic initial, il convient de rechercher à nouveau une carence en fer.
Chez les patients sous médicaments dopaminergiques, il faut penser à la possibilité d’une augmentation, dont l’incidence annuelle est d’environ 10% chez les personnes traitées à long terme. On entend par là la réapparition ou l’aggravation rapide des symptômes du RLS sous traitement en l’espace de quelques semaines, les troubles apparaissant de plus en plus tôt dans la journée, après une latence plus courte au repos (après s’être assis ou couché) et impliquant également des régions du corps non touchées auparavant, comme les bras. Outre la durée du traitement, une dose élevée et des aspects pharmacocinétiques (plus fréquents avec les préparations à courte durée d’action, notamment la L-DOPA) ainsi qu’une ferritine basse sont susceptibles de favoriser le développement de l’augmentation. A titre préventif, il est donc préférable d’éviter les doses élevées de médicaments dopaminergiques et d’utiliser éventuellement des formes galéniques à action prolongée.
Si une augmentation se produit sous un AD à courte durée d’action, on peut d’abord essayer de contrôler les symptômes qui apparaissent plus tôt dans la journée en répartissant la dose totale inchangée sur plusieurs prises (donc aussi plus tôt dans la journée). Une autre possibilité est de passer à une forme à libération prolongée de pramipexole ou de ropinirole, ou à l’AD transcutané et donc actif tout au long de la journée, la rotigotine, ce dernier provoquant parfois une intolérance cutanée en plus des effets secondaires habituels de l’AD. L’augmentation de la dose quotidienne d’AD entraîne certes un soulagement des symptômes à court terme, mais renforce l’augmentation à long terme, ce dont les personnes concernées doivent également être informées.
Si ces mesures ne donnent pas de résultats, il convient de passer à une autre classe de substances, en premier lieu un ligand α2δ. Comme l’arrêt de la médication dopaminergique aggrave le RLS à court terme, il convient d’augmenter le dosage de la préparation alternative avant de réduire progressivement l’AD dans la fourchette recommandée.
Enfin, comme cela a été démontré en 2013 dans une étude de plus grande envergure sur l’oxycodone/naloxone, les opiacés, y compris la méthadone, constituent une option pour les patients dont le SJSR ne peut pas être traité de manière satisfaisante par l’AD et les ligands α2δ (seuls ou en combinaison). Outre les risques de dépendance et de surdosage, également pertinents dans le cadre de l’utilisation d’opiacés pour d’autres indications, il convient de souligner, du point de vue de la médecine du sommeil, le renforcement possible d’un trouble respiratoire associé au sommeil. Globalement, l’utilisation à long terme d’opiacés dans le RLS doit être discutée avec un spécialiste.
Le traitement du RLS pendant la grossesse, qui s’accompagne malheureusement souvent d’une augmentation des symptômes, reste difficile. Les ligands DA et α2δ ne doivent pas être utilisés pendant cette période. La substitution d’une carence en fer revêt ici une importance particulière.
Bien que les bonnes données à long terme soient encore rares, les médicaments actuellement disponibles permettent d’aider à long terme la plupart des patients atteints de RLS. Des évolutions graves avec résistance au traitement sont toutefois possibles. Outre une bonne collaboration entre les médecins de premier recours et les spécialistes, le soutien des groupes d’entraide peut alors être précieux pour les personnes concernées (www.restless-legs.ch).
Littérature complémentaire :
- Allen RP, et al : Comparaison de la prégabaline avec le pramipexole pour le syndrome des jambes sans repos. N Engl J Med 2014 ; 370(7) : 621-631.
- Garcia-Borreguero D, et al : The long-term treatment of restless legs syndrome/Willis-Ekbom disease : evidence-based guidelines and clinical consensus best practice guidance : a report from the International Restless Legs Syndrome Study Group. Sleep Med 2013 ; 14 : 675-684.
- Sateia M : Classification internationale des troubles du sommeil. Troisième édition. Académie américaine de la médecine du sommeil 2014. ISBN : 0991543416.
- Trenkwalder C, et al., RELOXYN Study Group : Prolonged release oxycodone-naloxone for treatment of severe restless legs syndrome after failure of previous treatment : a double-blind, randomised, placebo-controlled trial with an open-label extension. Lancet Neurol 2013 ; 12 : 1141-1150.
PRATIQUE DU MÉDECIN DE FAMILLE 2016 ; 11(1) : 7-11