La survenue de douleurs suite à un accident vasculaire cérébral constitue un défi pour la médecine de la douleur. Bien que les connaissances sur les mécanismes physiopathologiques de la douleur neuropathique après un AVC aient considérablement progressé au cours des dernières années, les succès des approches médicamenteuses, neurochirurgicales, interventionnelles et autres restent actuellement limités. Une approche thérapeutique multimodale est donc impérative. Le présent article vise à donner un aperçu des aspects diagnostiques et thérapeutiques de cette entité pathologique.
Les douleurs chroniques modérées à sévères représentent un problème de santé publique fréquent en Suisse, avec une prévalence de 16%. On constate que peu de patients sont traités par des spécialistes de la douleur et qu’environ la moitié des patients reçoivent un traitement de la douleur inadéquat [1]. La présence de douleurs purement neuropathiques est également fréquente, avec une prévalence comprise entre 3,3% dans une enquête menée dans la population générale en Autriche [2] et 7% dans la population générale en France [3].
L’incidence des AVC en Europe est de 1,1 million par an, avec une augmentation estimée à environ 1,5 million par an d’ici 2025, en raison de l’augmentation de la proportion de personnes âgées dans la population [4]. La douleur chronique associée à l’AVC est observée chez 11 à 55% des patients ayant subi un AVC [5]. Les types de douleurs les plus fréquents après un AVC peuvent être des douleurs neuropathiques centrales, des douleurs nociceptives à l’épaule, une spasticité douloureuse et également des céphalées de tension. Les douleurs neuropathiques centrales surviennent chez 8% des patients ayant subi un AVC [6]. Des douleurs nociceptives à l’épaule sont rapportées entre 30 et 40% chez les patients ayant subi un AVC et présentant des déficits sensoriels et moteurs, des subluxations de l’épaule et des restrictions de mouvement [7]. Les douleurs musculo-squelettiques peuvent également se manifester dans le dos et les membres inférieurs, notamment au niveau des genoux et des hanches [8] (tableau 1).

Douleur centrale après un accident vasculaire cérébral
La définition de la douleur neuropathique selon l’Association internationale pour l’étude de la douleur (IASP) se base sur une lésion ou une maladie qui affecte le système somatosensoriel [9]. Pour diagnostiquer une douleur neuropathique, il convient, selon les critères de diagnostic de l’IASP, de rechercher dans l’anamnèse une douleur correspondant à une distribution neuroanatomique circonscrite, ainsi que des indices d’une lésion ou d’une maladie pertinente du système nerveux périphérique ou central. L’examen clinique doit montrer des signes sensoriels positifs et négatifs correspondant à une répartition neuroanatomique plausible et à la zone de la douleur. De plus, le diagnostic par appareillage devrait démontrer la présence d’une lésion ou d’une maladie du système somatosensoriel [9].
Dans la littérature anglophone, la douleur neuropathique centrale après un AVC est appelée “Central Post Stroke Pain” (CPSP). En l’absence de signes pathognomoniques pour le CPSP, le groupe de travail Klit et al. en s’inspirant des critères de diagnostic de l’IASP mentionnés ci-dessus, a récemment proposé des critères de diagnostic spécifiques pour le CPSP [10]. Les critères requis pour le diagnostic du SCPP sont donc la douleur dans une région du corps correspondant à une lésion du système nerveux central. L’anamnèse doit indiquer qu’un accident vasculaire cérébral a eu lieu et, par conséquent, que le début de la douleur est survenu après. De plus, la confirmation d’une lésion du système nerveux central par des examens d’imagerie (par ex. scanner ou IRM du crâne) est requise ou la présence de signes sensoriels négatifs ou positifs, compatibles avec une région du corps, correspondant à une lésion du système nerveux central doit être démontrée.
Comme il s’agit d’un diagnostic clinique d’exclusion, les autres causes de douleur, telles que les douleurs nociceptives ou neuropathiques périphériques, doivent être exclues ou improbables. Le diagnostic peut être étayé par des critères de soutien, tels que l’absence de lien primaire entre la douleur et le mouvement (par exemple des extrémités), l’absence de signes d’inflammation locale ou de signes d’une autre pathologie tissulaire locale comme cause de la douleur nociceptive. Une description typique de la douleur peut être une douleur à type de brûlure, de fourmillement, de pression, de piqûre, d’enfoncement, de contraction, de douleur au froid, d’électrisation, mais d’autres descriptions sont également observées. La présence d’une allodynie ou d’une dysesthésie au toucher ou au froid dans la zone douloureuse peut donner des indications supplémentaires (tab. 2).

Caractéristiques cliniques de la CPSP neuropathique
L’article de synthèse de Klit [10] rassemble les caractéristiques cliniques typiques du CPSP. La répartition de la zone douloureuse peut ne concerner qu’une petite zone, par exemple uniquement la main, ou des zones étendues du corps, allant jusqu’à la douleur hémiplégique. Le visage et le tronc peuvent également être évidés. Les patients présentant ce que l’on appelle un infarctus latéral du bulbe rachidien et le syndrome de Wallenberg qui en résulte peuvent également présenter des douleurs au visage du côté affecté et des douleurs au tronc et aux extrémités du côté opposé (syndrome croisé). Des douleurs périorbitaires sont également fréquemment rapportées. Une hémiplégie survient souvent après une lésion du thalamus. Les phénomènes sensoriels négatifs et positifs sont également typiques dans la SCPP, comme dans d’autres syndromes neuropathiques. Les troubles thermiques, notamment de la sensation de froid ou encore les troubles de la perception de la douleur ou de la perception des piqûres ou des pointes sont présents dans plus de 90% des cas. Les symptômes négatifs liés au toucher ou aux vibrations sont moins fréquents. Les phénomènes positifs tels que la douleur évoquée par des stimuli thermiques (en particulier froids) ou mécaniques (stimuli par piqûre d’aiguille), mais aussi l’allodynie aux stimuli tactiles, sont fréquents.
La douleur centrale post-AVC ne survient pas seulement typiquement après une lésion thalamique (“douleur thalamique”), mais est également rapportée après des hémorragies et des ischémies dans d’autres zones du cerveau [11]. Nos propres données montrent l’apparition de douleurs centrales après un AVC chez des patients présentant des infarctus du tronc cérébral, des lésions des ganglions médullaires et des lésions du cortex insulaire. Des causes très diverses ont été identifiées en ce qui concerne la genèse de l’AVC, comme les infarctus cérébraux microvasculaires ou emboliques, l’infarctus cérébral après un vasospasme dû à une hémorragie sous-arachnoïdienne ou encore une hémorragie intracérébrale [12].
Le délai entre la survenue de l’AVC et l’apparition de la SCPP peut être variable (apparition immédiate ou apparition de la douleur après plusieurs années), mais l’apparition de la douleur en quelques mois est la plus typique [13]. Dans une étude prospective portant sur 16 patients [6], un CPSP est apparu chez dix patients au cours du premier mois, chez trois autres patients entre un et six mois et chez trois patients après six mois. Par conséquent, un début tardif de la SCPP doit faire penser à d’autres causes de douleur ou à la survenue d’un nouvel AVC dans le cadre du diagnostic différentiel.
Rôle du diagnostic par appareil
Conformément aux critères de diagnostic de l’IASP mentionnés au début, il convient de procéder à un diagnostic par imagerie cérébrale, de préférence par IRM pour visualiser les structures cérébrales. Si une lésion correspondant à la douleur est mise en évidence, aucun autre diagnostic n’est nécessaire. Dans certains cas, une lésion de très petite taille peut être indétectable à l’imagerie. Si la clinique est typique (antécédents d’AVC et mise en évidence de phénomènes négatifs et/ou positifs correspondants), le diagnostic de CPSP peut être posé. En outre, on peut tenter de mettre en évidence une lésion sur le plan neurophysiologique. Les potentiels évoqués somatosensoriels [14] et les potentiels évoqués au laser [15], mais aussi un test sensoriel quantitatif [16] peuvent aider à détecter une lésion. Nos propres données montrent des résultats pathologiques lors de l’examen des potentiels évoqués au laser et du test sensoriel quantitatif dans la plupart des cas chez les patients souffrant de douleurs neuropathiques centrales après un accident vasculaire cérébral de différentes origines [12].
Mécanismes d’apparition de la douleur neuropathique après un AVC
La dernière revue de Klit et al. [10] donne un bon aperçu des mécanismes possibles de la douleur centrale après un accident vasculaire cérébral. L’hyperexcitabilité neuronale au niveau du cerveau joue un rôle important dans la pathophysiologie des douleurs neuropathiques d’origine centrale. Les facteurs qui peuvent favoriser l’hyperexcitabilité neuronale sont par exemple une activation gliale avec libération de chimiokines et de substances inflammatoires, un affaiblissement des systèmes inhibiteurs GABA-ergiques du thalamus, un déséquilibre entre les voies spinothalamiques latérales et médianes suite à une lésion à ce niveau ou encore la désafférentation de l’entrée sensitive. Les conséquences de tels mécanismes peuvent être la détection d’une activité spontanée dans le noyau ventrocaudal du thalamus ou encore une modification du flux sanguin cérébral dans le thalamus. Des mécanismes supplémentaires tels que la perturbation des boucles d’excitation cortico-thalamo-corticales ou de la réorganisation corticale, ainsi que d’autres mécanismes, sont discutés.
Approches thérapeutiques de la CPSP
La douleur chronique après un AVC peut entraîner une baisse de la qualité de vie, qui affecte l’humeur, le sommeil et les fonctions sociales [17]. En règle générale, le traitement multimodal de la douleur, qui comprend des méthodes somatiques, physiques et psychothérapeutiques, est supérieur au traitement monodisciplinaire pour les syndromes douloureux chroniques. A cet égard, ainsi que pour les différentes causes possibles de douleur présentées ci-dessus, le traitement de la douleur après un AVC devrait toujours être interdisciplinaire et multimodal. En particulier chez les patients souffrant de douleurs neuropathiques après un AVC, les traitements psychologiques tels que les stratégies d’adaptation et les thérapies comportementales peuvent conduire à une amélioration de la douleur [17].
En ce qui concerne les douleurs nociceptives, les mesures à prendre en fonction de la pathologie musculo-squelettique sont principalement orthopédiques (p. ex. traitement des pathologies de l’épaule), physiothérapeutiques (p. ex. traitement des facteurs de douleur musculaires) et ergothérapeutiques. En outre, un traitement de la spasticité douloureuse par baclofène oral peut être nécessaire. Dans certains cas spécifiques, la mise en place d’une pompe intrathécale antispasmodique peut être utile.
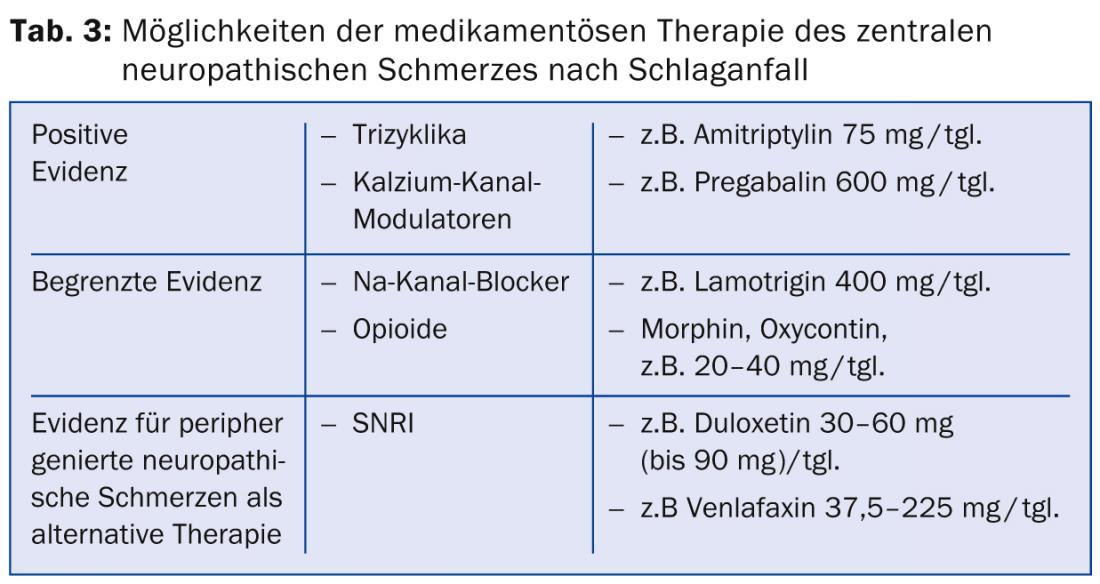
Approches thérapeutiques médicamenteuses : Les approches thérapeutiques médicamenteuses pour la douleur neuropathique après un AVC ont été évaluées dans des lignes directrices internationales telles que celles du groupe de travail sur la douleur neuropathique de la Société internationale de la douleur (NeuPSIG) [18] ou celles de la Fédération européenne des sociétés neurologiques (EFNS) [19]. Les options thérapeutiques médicamenteuses disponibles sont limitées. Il est possible que la multiplicité des mécanismes physiopathologiques mentionnés à différents niveaux neuronaux soit à l’origine de la réponse souvent médiocre aux médicaments disponibles pour le traitement des douleurs neuropathiques après un AVC. Aucun traitement n’est encore disponible pour un grand nombre des mécanismes mentionnés.
Il existe peu d’études randomisées et contrôlées sur le traitement des douleurs neuropathiques centrales après un AVC. Les tricycliques et les modulateurs des canaux calciques sont considérés comme des médicaments de premier choix. Des données d’études positives sont disponibles pour l’amitriptyline à la dose de 75 mg [20]. Le “number needed to treat” (NNT), c’est-à-dire le nombre de patients à traiter pour obtenir une réduction de 50 % de la douleur, a été estimé ici à 1,7. Des effets secondaires modérés tels que la fatigue et la sécheresse de la bouche ont été observés.
En ce qui concerne les anticonvulsivants du groupe des modulateurs des canaux calciques, une étude menée chez des patients souffrant de douleurs neuropathiques centrales a montré une efficacité significative de la prégabaline, avec un NNT de 4,0 [21]. Les effets secondaires ont été des vertiges, des troubles cognitifs, de la fatigue et des nausées. Par ailleurs, la lamotrigine, un antiépileptique de la famille des bloqueurs des canaux sodiques, a montré une efficacité modérée avec une bonne tolérance dans une étude sur la douleur centrale après un AVC [22]. L’efficacité de la lamotrigine n’est pas évidente dans d’autres pathologies douloureuses neuropathiques, de sorte que son efficacité est généralement considérée comme incertaine [23]. Une étude portant sur la carbamazépine à la dose de 800 mg/jour. n’a pas montré d’efficacité dans les douleurs neuropathiques après un accident vasculaire cérébral.
Dans une étude sur les douleurs neuropathiques d’origines diverses, l’administration d’opioïdes oraux a montré une réduction moyenne de la douleur de 23%, mais le nombre de patients souffrant de douleurs neuropathiques après un AVC était faible (10 sur 81) et sept d’entre eux ont quitté l’étude en raison d’effets secondaires [24]. Des études sur l’administration intraveineuse de morphine, de lidocaïne et de propofol ont montré une amélioration de la douleur après un AVC pendant la perfusion. Les traitements d’entretien oraux ultérieurs à base de morphine et de mexilétine ont été mal tolérés en raison d’effets secondaires [25–27].
Si les médicaments susmentionnés ne permettent pas d’obtenir une réduction suffisante de la douleur, il est recommandé de recourir aux médicaments de première et deuxième intention pour le traitement des douleurs neuropathiques générées en périphérie [18]. Il s’agit notamment, pour les médicaments de première intention, des inhibiteurs sélectifs de la recapture de la sérotonine et de la noradrénaline (IRSN) comme la duloxétine et la venlafaxine et, pour les médicaments de deuxième intention, des opioïdes à forte puissance comme la MST, l’oxycontine et d’autres opioïdes (tableau 3).
Approches thérapeutiques neurochirurgicales et interventionnelles : Comme nous l’avons montré, les possibilités de traitement médicamenteux des douleurs neuropathiques après un AVC sont limitées et donc souvent insatisfaisantes. Selon Dworkin et al. [23], des méthodes invasives peuvent être tentées après avoir épuisé les différentes méthodes thérapeutiques conservatrices ou combinées. Les données actuelles concernant les approches thérapeutiques neurochirurgicales et interventionnelles ont été rassemblées dans des revues récentes [10,28,29]. Les preuves de ces procédures étant limitées, elles doivent être réservées à des centres de traitement expérimentés.
La stimulation magnétique transcrânienne répétitive (SMTr) est une méthode neuromodulative et non invasive. Dans ce cas, l’effet est modéré et de courte durée, mais les effets secondaires graves sont rares. Des traitements répétés du cortex moteur par rTMS peuvent montrer une amélioration significative de la douleur [30,31]. De plus, cette thérapie peut être utilisée comme prédicteur de la réponse à la stimulation épidurale du cortex moteur [32].
L’efficacité de la stimulation épidurale du cortex moteur dans la douleur centrale après un AVC a montré une réduction de la douleur d’environ 45-50% après un an [28,33]. Les complications graves sont rarement rapportées. Des crises d’épilepsie, des infections et des problèmes techniques peuvent survenir en période périopératoire.
La stimulation cérébrale profonde (“deep brain stimulation”, DBS) peut également être envisagée comme traitement invasif. Ici, le thalamus sensoriel (nerf ventral postérieur) ou le gris périventriculaire sont stimulés. Selon les rapports, l’efficacité varie entre 25 et 67% [34,35]. En général, l’efficacité ne peut pas être clairement quantifiée, de sorte que des études supplémentaires sont nécessaires [28].
Une nouvelle méthode thérapeutique pour les patients souffrant de douleurs neuropathiques, y compris de douleurs neuropathiques centrales après un accident vasculaire cérébral, est le traitement par ultrasons focalisés de haute intensité (“high intensity focussed ultrasound”, HIFUS), qui est appliqué par voie transcrânienne, de manière non invasive, afin d’effectuer un ablation thermique d’une zone circonscrite du thalamus centrolatéral, ce qui peut entraîner un soulagement de la douleur [36].
Dr. med. Gunther Landmann
Dr. Emmanuelle Opsommer
Littérature :
- Breivik H, et al. : European Journal of Pain 2006 ; 10(4) : 287-287.
- Gustorff B, et al : Acta Anaesthesiol Scand 2008 ; 52(1) : 132-136.
- Bouhassira D, et al : Pain 2008 ; 136(3) : 380-387.
- Truelsen T, et al : Eur J Neurol 2006 ; 13 : 581-598.
- Jönsson AC, et al : J Neurol Neurosurg Psychiatry 2006 ; 77 : 590-595.
- Andersen G, et al : Pain 1995 ; 61 : 187-193.
- Lindgren I, et al. : Stroke 2007 ; 38 : 343-348.
- Kuptniratsaikul V, et al : Am J Phys Med Réhabilitation 2009 ; 88 : 92-99.
- Treede RD, et al : Neurology 2008 ; 70(18) : 1630-1635.
- Klit H, Finnerup NB, Jensen TS : Lancet Neurol 2009 ; 8(9) : 857-868.
- Weimar C, et al : Cerebrovasc Dis 2002 ; 14 : 261-263.
- Landmann G, Stockinger L, Opsommer E : Douleur centrale post-traumatique explorée par des potentiels évoqués par laser et des tests sensoriels quantitatifs : une étude de cas multiple. 30ème Congrès International de Neurophysiologie Clinique (ICCN). Berlin, Allemagne, 2014.
- Tasker R : États de douleur centrale. In : L JD, editor. Bonica’s management of pain Philadelphia : Lipponcott Williams & Wilkins, 2001 ; 433-445.
- Holmgren H, et al : Pain 1990 ; 40 : 43-52.
- Garcia-Larrea L, et al : Brain 2002 ; 125 : 2766-2781.
- Boivie J : Eur J Pain 2003 ; 7 : 339-343.
- Widar M, et al. : J Pain Symptom Manage 2004 ; 27 : 215-225.
- Dworkin RH : Am J Med 2009 ; 122(10 Suppl) : S1-2.
- Attal N, et al : Eur J Neurol 2010 ; 17(9) : 1113-1188.
- Leijon G : Pain 1989 ; 36 : 27-36.
- Vranken JH, et al : Pain 2008 ; 136 : 150-157.
- Vestergaard K, et al : Neurology 2001 ; 56 : 184-190.
- Dworkin RH, et al : Pain 2007 ; 132(3) : 237-251.
- Rowbotham MC, et al : N Engl J Med 2003 ; 348 : 1223-1232.
- Attal N, et al : Neurology 2000 ; 54 : 564-574.
- Attal N, et al : Neurology 2002 ; 58 : 554-563.
- Canavero S : Clin Neuropharmacol 2004 ; 27 : 182-186.
- Cruccu G, et al : Eur J Neurol 2007 ; 14 : 952-970.
- Kumar B, et al : Anesthesia and analgesia 2009 ; 108(5) : 1645-1657.
- Khedr EM, et al : J Neurol Neurosurg Psychiatry 2005 ; 76(6) : 833-838.
- Leung A, et al : J Pain 2009 ; 10(12) : 1205-1216.
- Andre-Obadia N, et al : Clin Neurophysiol 2006 ; 117(7) : 1536-1544.
- Fontaine D, Hamani C : Journal of neurosurgery 2009 ; 110 : 251-256.
- Katayama Y, et al : Stereotact Funct Neurosurg 2001 ; 77 : 183-186.
- Owen SL, et al : Pain 2006 ; 120 : 202-206.
- Martin E, et al : Ann Neurol 2009 ; 66(6) : 858-861.
PRATIQUE DU MÉDECIN DE FAMILLE 2014 ; 9(5) : 20-24